关于优化创新药临床试验审评审批有关事项的公告(征求意见稿)
2025-06-16 国家药品监督管理局(NMPA) 国家药品监督管理局官网 发表于上海
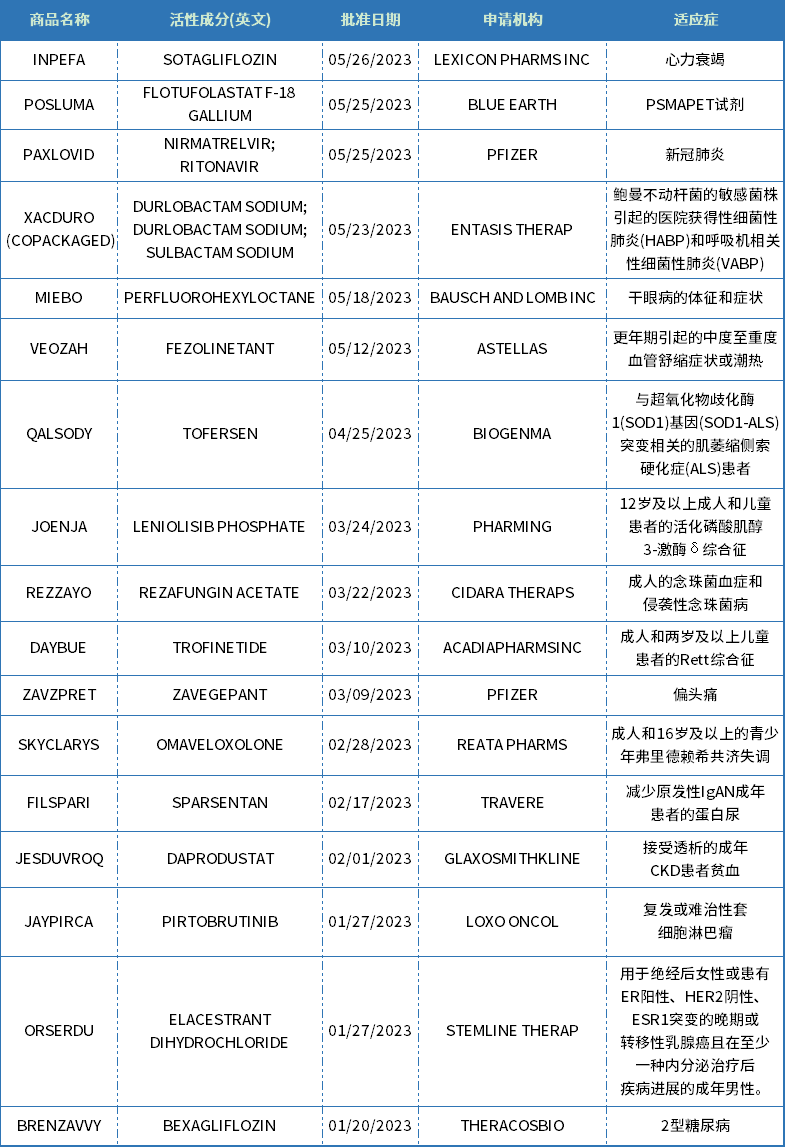
国家药监局在开展优化创新药临床试验审评审批试点工作经验基础上,组织起草了《关于优化创新药临床试验审评审批有关事项的公告(征求意见稿)》(附件1),现向社会公开征求意见。
关于优化创新药临床试验审评审批有关事项的公告(征求意见稿)
2025-06-16
为落实《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号)有关要求,支持创新药研发,国家药监局在开展优化创新药临床试验审评审批试点工作经验基础上,组织起草了《关于优化创新药临床试验审评审批有关事项的公告(征求意见稿)》(附件1),现向社会公开征求意见。
请于2025年7月16日前,将有关意见按照《意见反馈表》(附件2)格式要求反馈至电子邮箱ywyjc@nmpa.gov.cn,邮件标题请注明“优化创新药临床试验审评审批有关事项的公告意见反馈”,邮件附件的文件名请注明“××(单位/个人)意见反馈表”。