读书报告 | 错剪接的星图:新抗原导航T细胞重塑白血病免疫战场
2025-07-17 iCombo iCombo 发表于上海
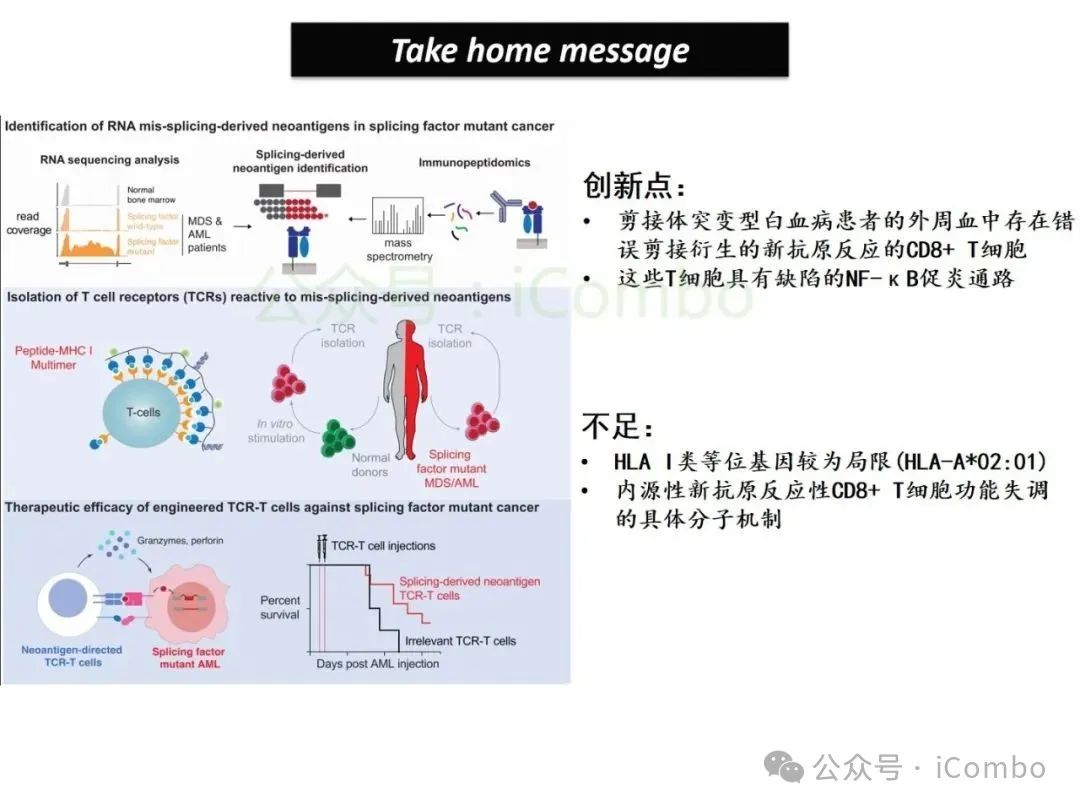
该研究不仅揭示了剪接异常相关新抗原的免疫识别机制,还为发展针对髓系恶性肿瘤的精准TCR-T细胞疗法奠定了分子基础,为克服AML/MDS免疫治疗瓶颈开辟了创新路径,具有重要临床转化价值。
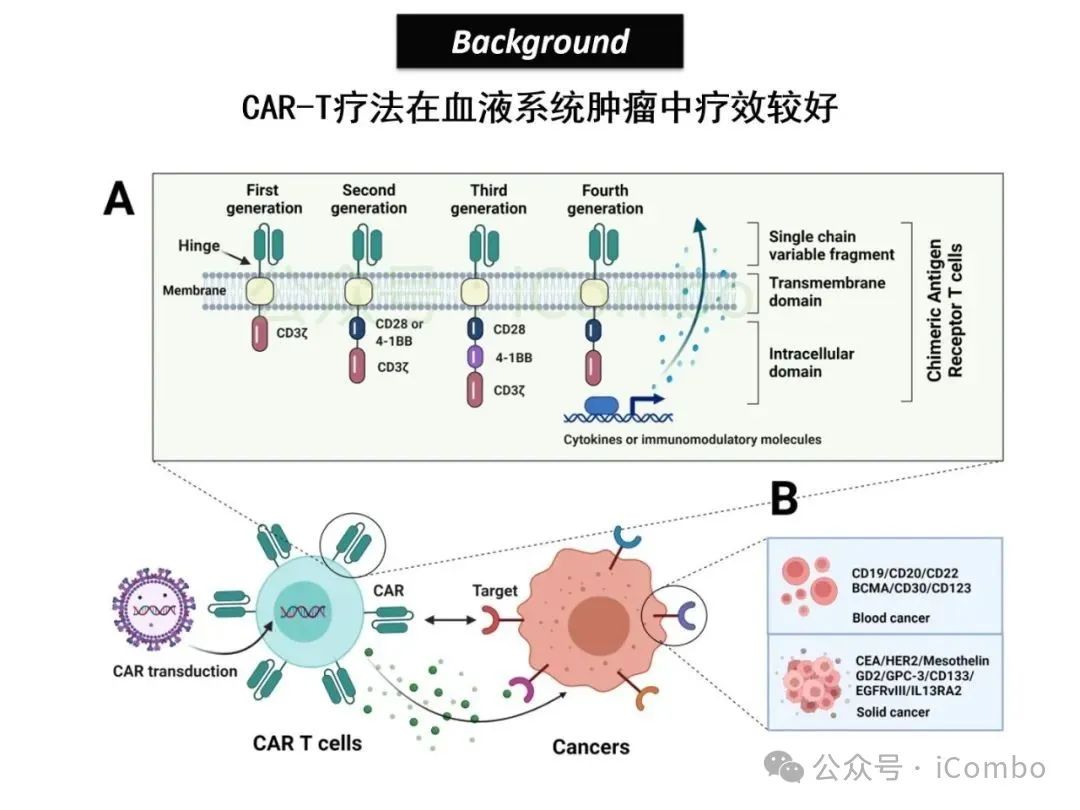
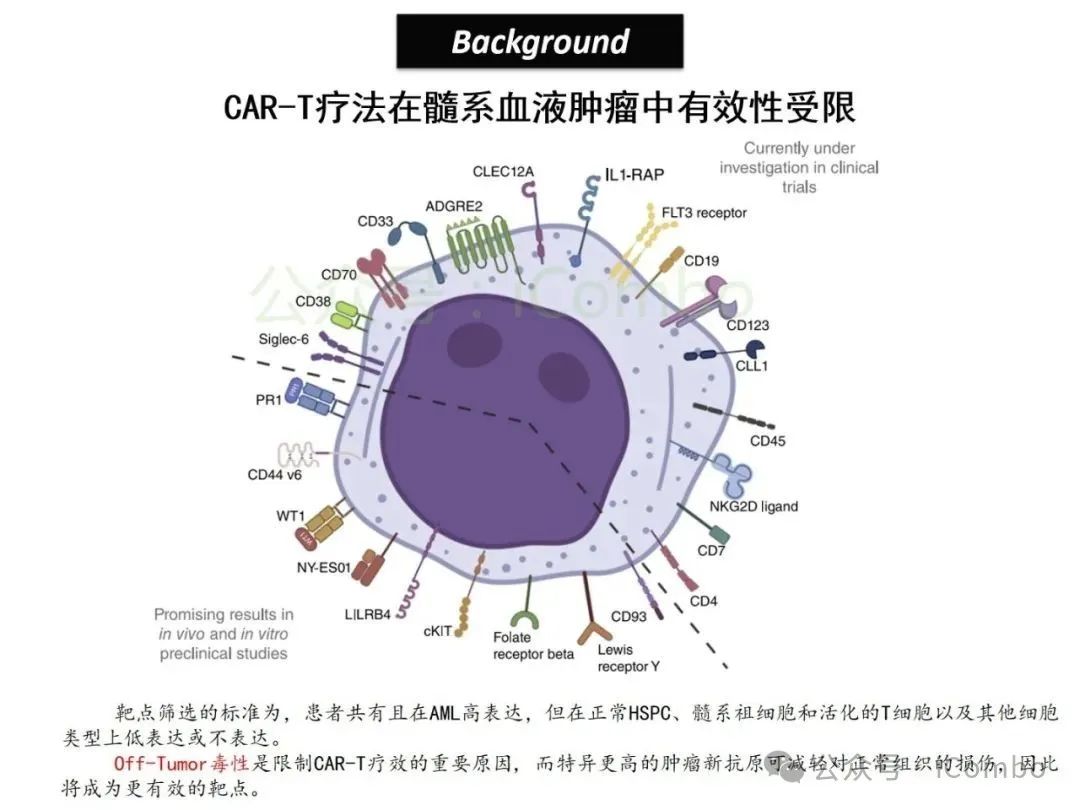
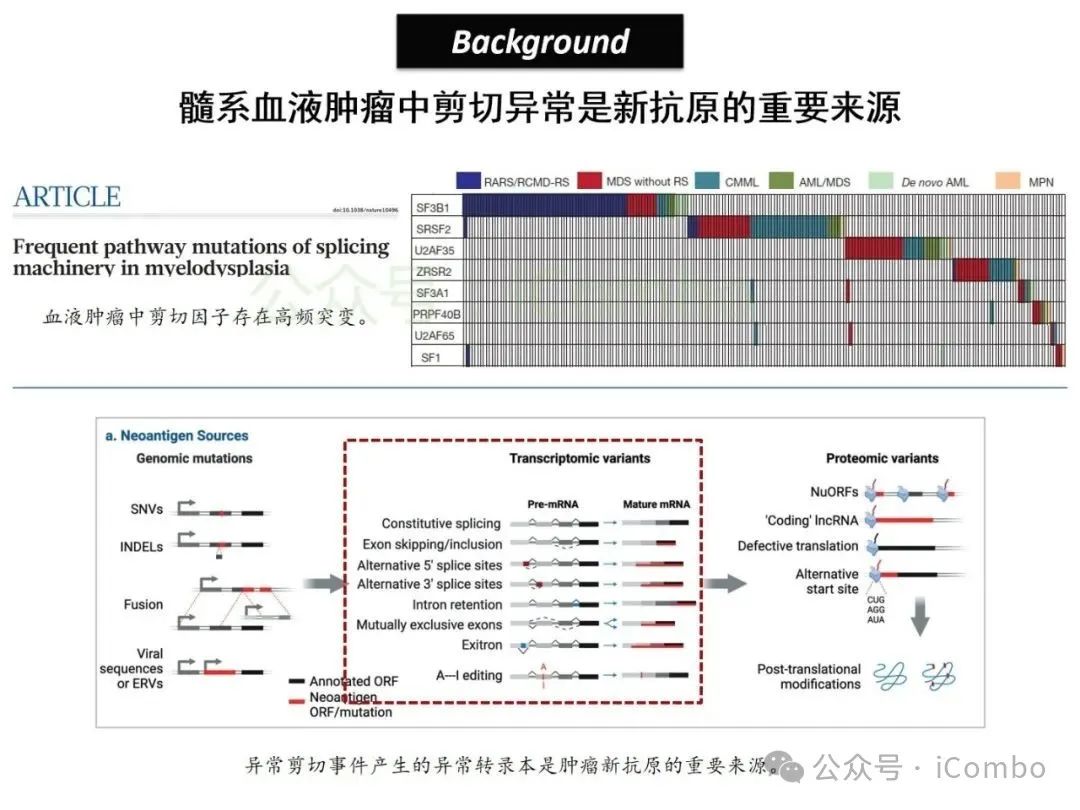
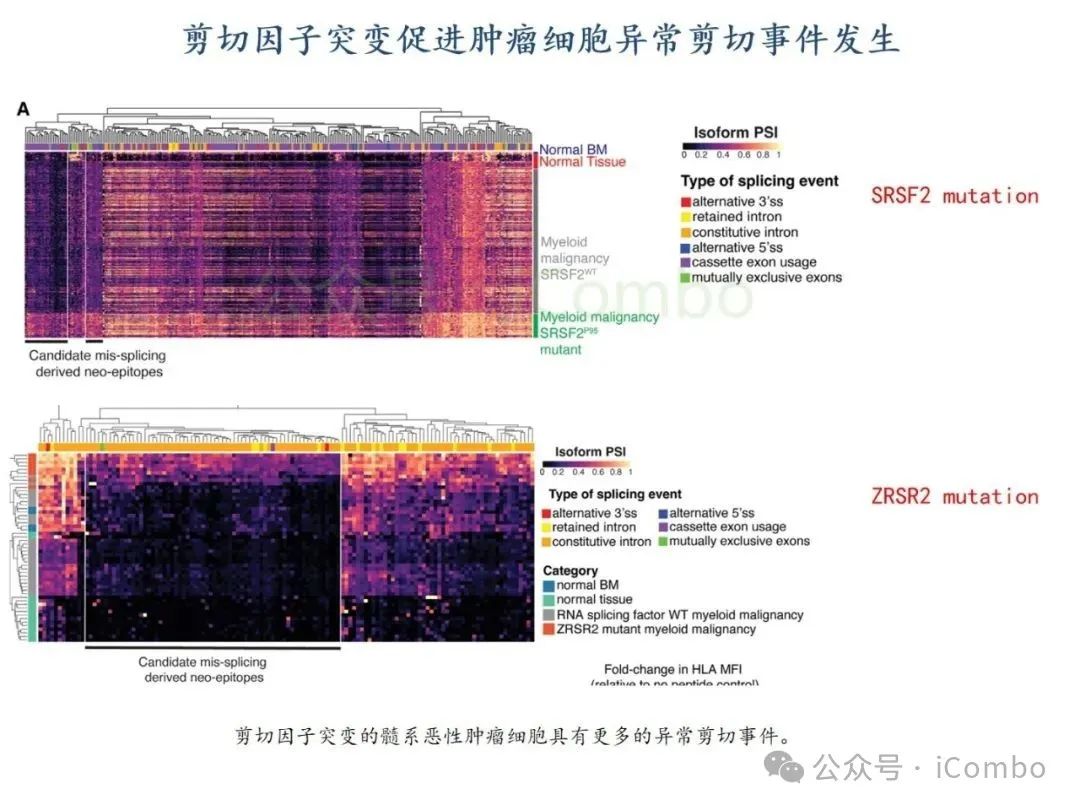
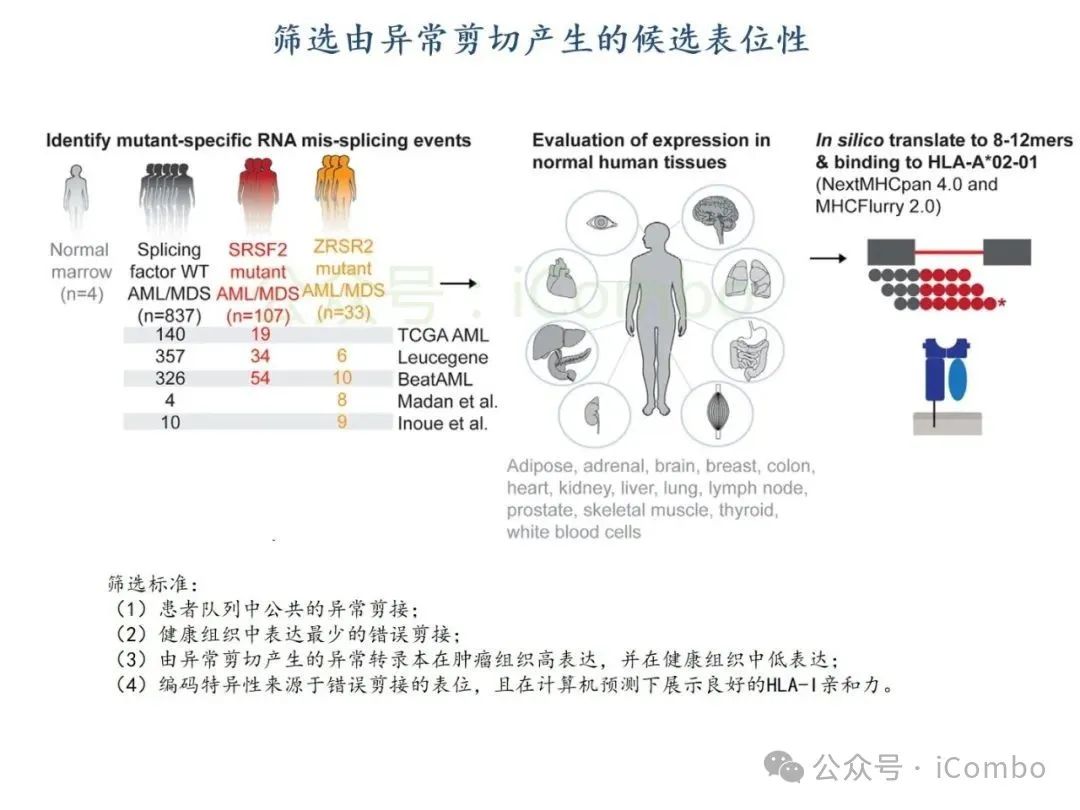
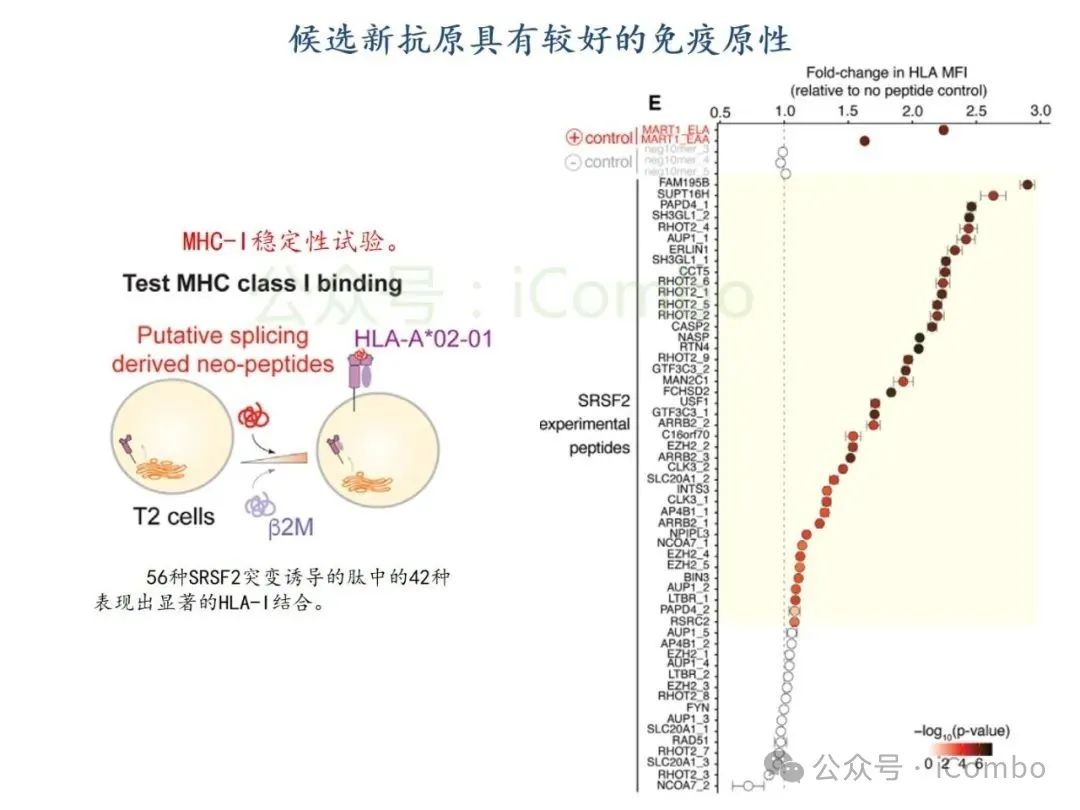
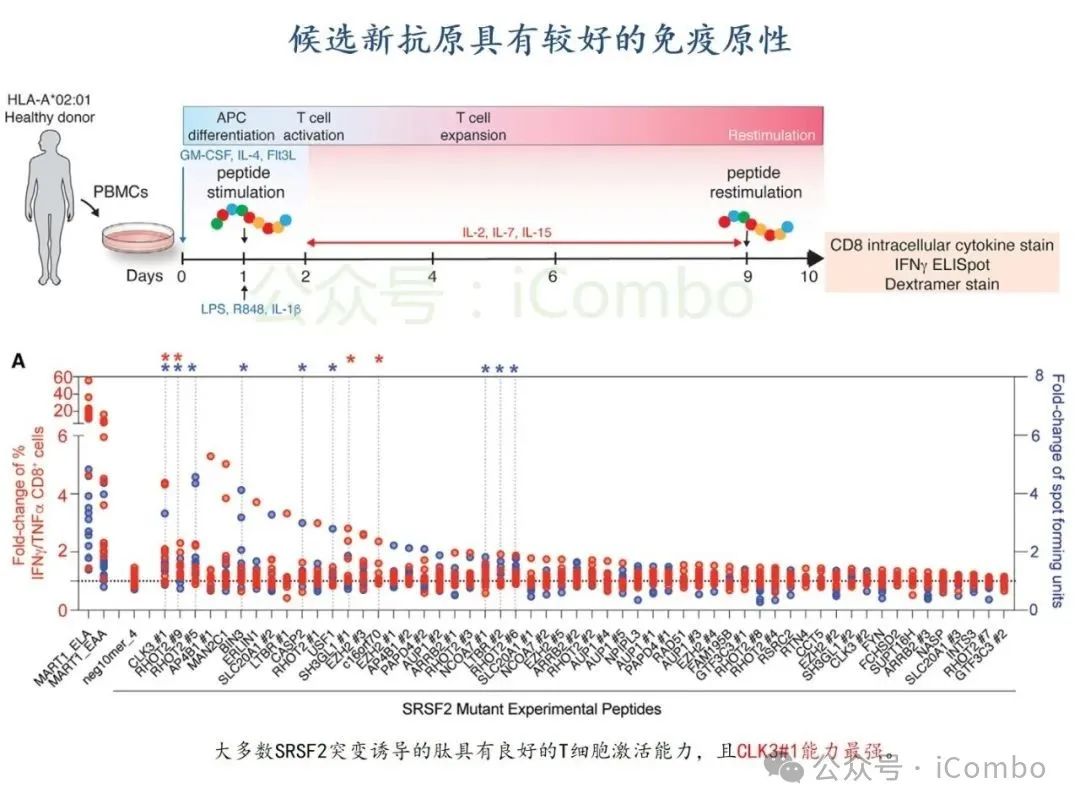
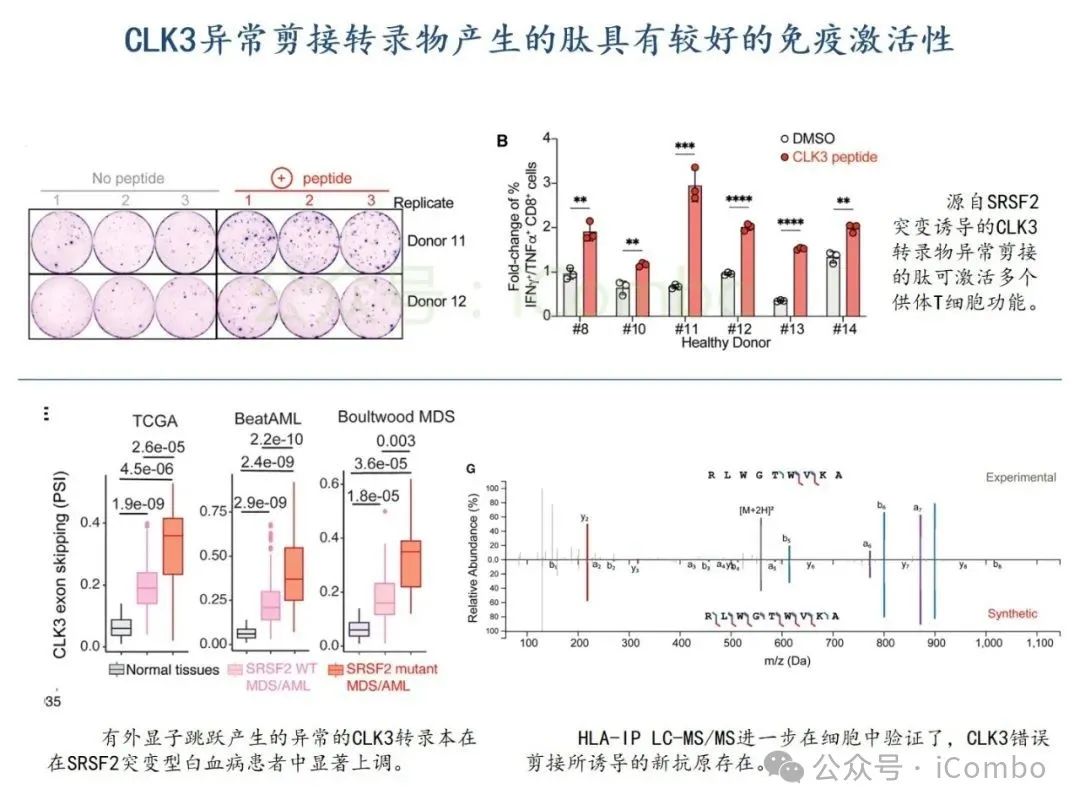
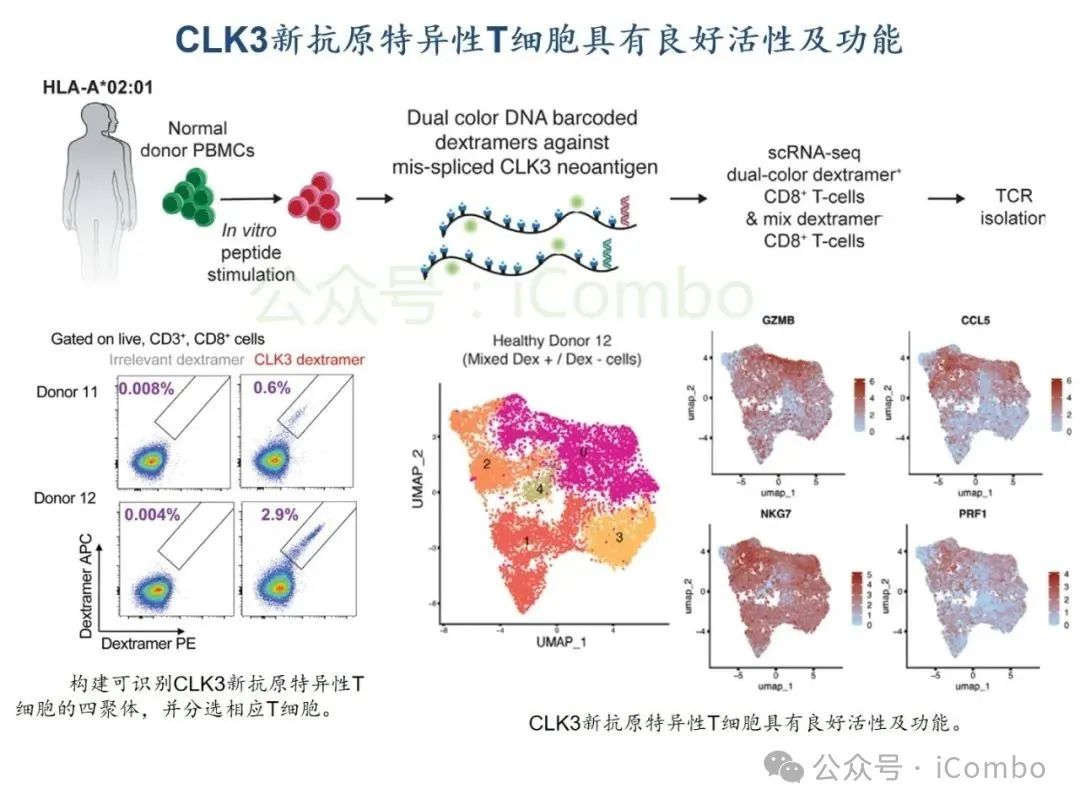
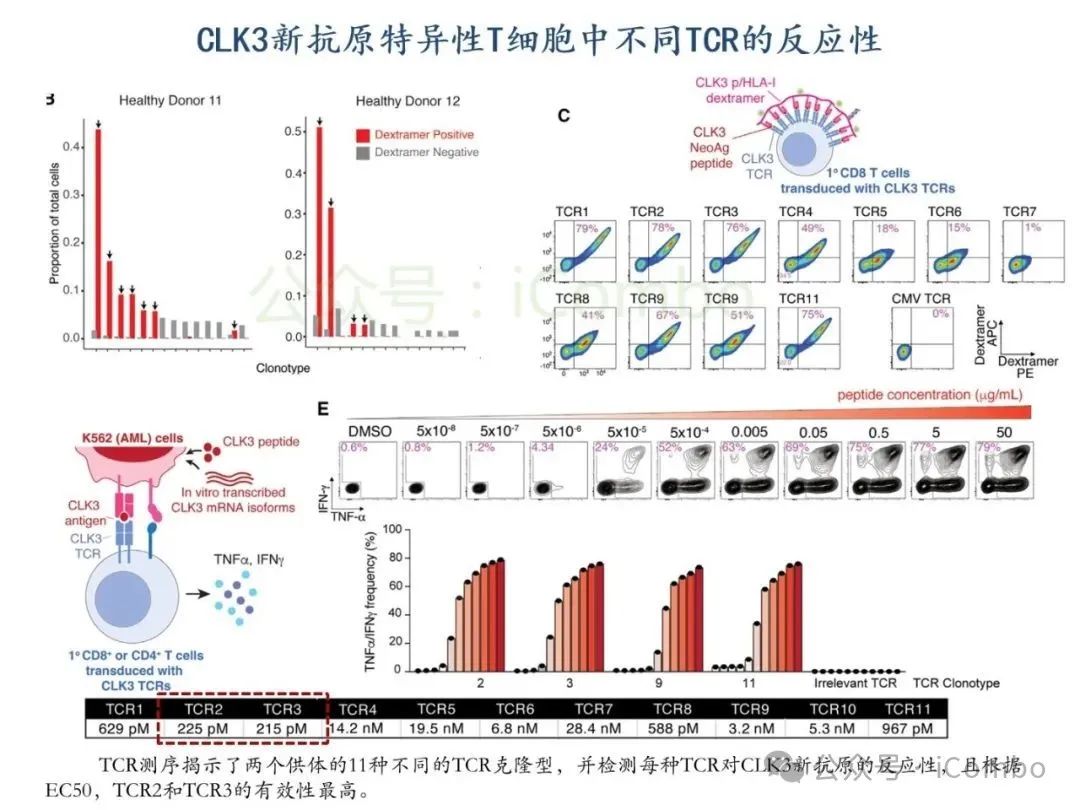
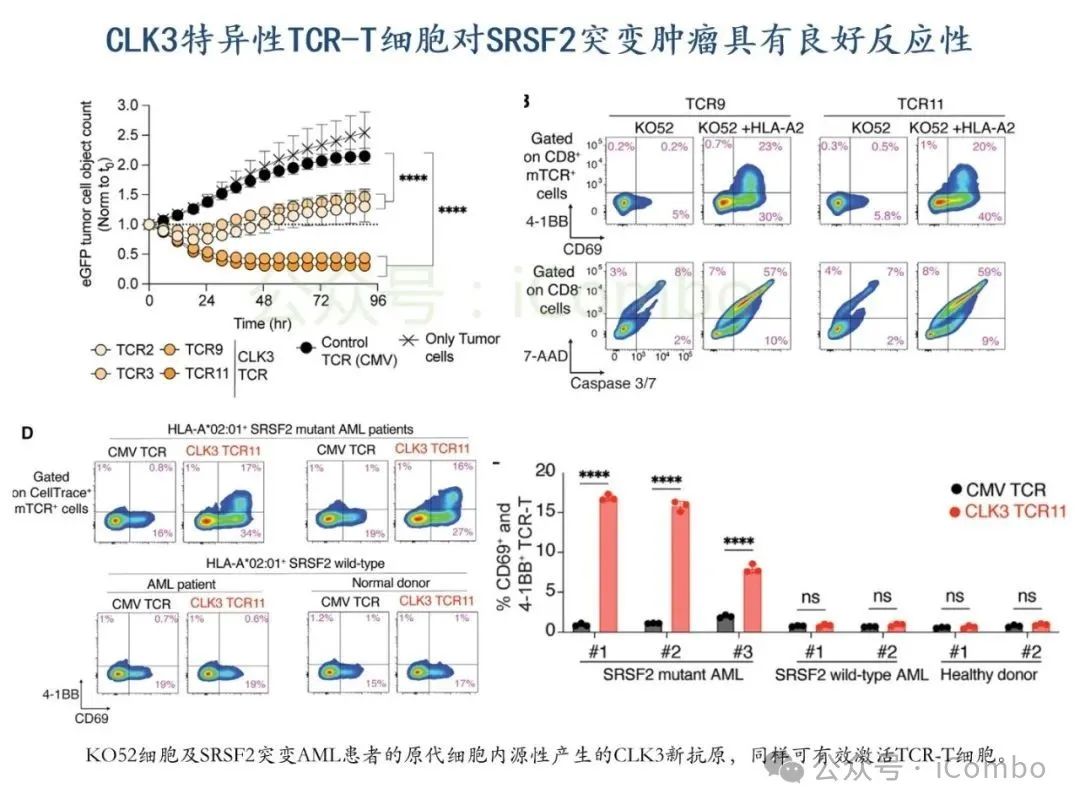
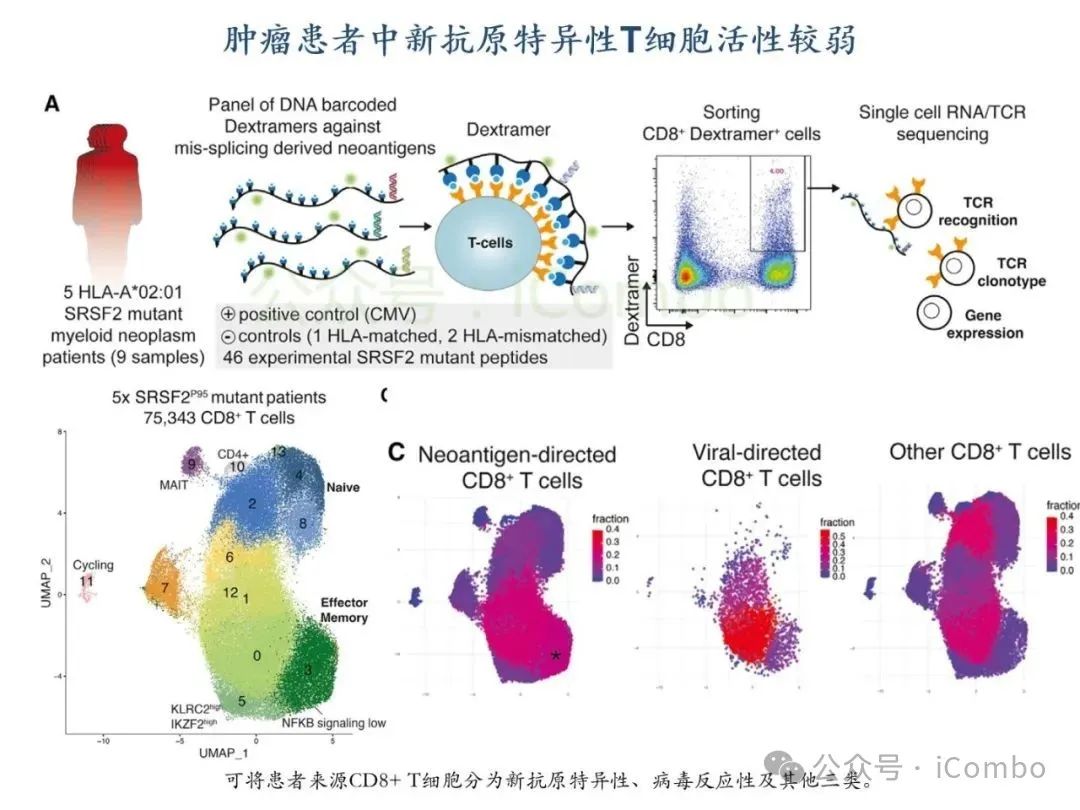
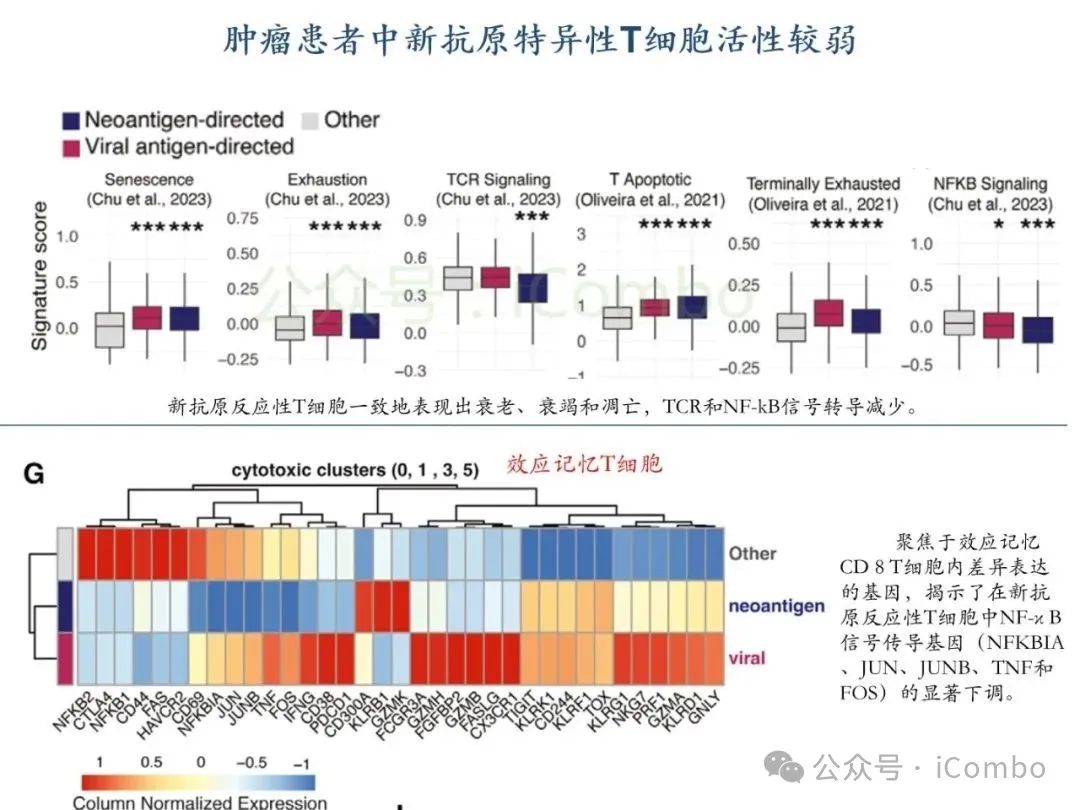
导读 2025年4月23日,纪念斯隆凯特林癌症研究所Omar Abdel-Wahab教授在《Cell》发表题为《Mis-splicing-derived neoantigens and cognate TCRs in splicing factor mutant leukemias》的研究论文,首次系统阐明剪接体突变相关新抗原的免疫原性特征及其TCR识别机制,为发展针对髓系恶性肿瘤的精准免疫治疗提供了新型靶标和治疗范式,具有重要转化医学价值。急性髓系白血病(AML)和高危骨髓增生异常综合征(MDS)作为恶性血液系统疾病,其临床治疗仍面临严峻挑战。尽管治疗手段持续演进,AML患者五年生存率仍不足20%,而高危MDS的有效治疗方案亦显匮乏。随着肿瘤免疫治疗的发展,T细胞工程化技术(如CAR-T/TCR-T疗法)在实体瘤及淋巴系统恶性肿瘤中展现出显著疗效,但在AML/MDS领域进展滞后。其核心瓶颈在于:① 白血病干细胞与正常造血祖细胞存在广泛抗原重叠,导致脱靶毒性风险。② 肿瘤微环境介导的免疫抑制状态致使T细胞功能耗竭。③ 肿瘤特异性抗原靶点匮乏。因此,鉴定AML/MDS特异性新抗原成为突破免疫治疗困境的关键。值得注意的是,剪接体组分基因(SF3B1、SRSF2、U2AF1、ZRSR2)突变在50%-70%的MDS及AML患者中呈现高频率特征。这类突变通过干扰pre-mRNA剪接保真性,导致异常转录本生成,进而产生可被MHC分子呈递的突变相关新抗原(neoantigens)。初步研究表明,此类剪接异常衍生的新抗原具有患者亚群共享特性,且与HLA-I分子呈现高亲和力结合,为开发通用型TCR-T疗法提供了潜在靶标。然而,其在AML/MDS中的免疫原性验证及治疗转化仍需系统探索。本研究通过系统性鉴定SRSF2或ZRSF2突变髓系白血病患者中保守性异常剪接事件衍生的新抗原,揭示这些肿瘤特异性表位可通过T细胞受体(TCR)介导的靶向策略实现精准免疫清除。研究证实,剪接因子突变导致CLK3、RHOT2等基因产生内源性表达的HLA-I限制性新抗原,并成功分离出具有特异性识别能力的TCR克隆。实验验证显示,基于新抗原的TCR-T细胞疗法可选择性杀伤SRSF2突变白血病细胞,在异种移植模型中显著降低肿瘤负荷。该研究不仅揭示了剪接异常相关新抗原的免疫识别机制,还为发展针对髓系恶性肿瘤的精准TCR-T细胞疗法奠定了分子基础,为克服AML/MDS免疫治疗瓶颈开辟了创新路径,具有重要临床转化价值。 (Cell. 2025 Jun 26;188(13):3422-3440.e24. doi: 10.1016/j.cell.2025.03. 047)。









本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#白血病# #T细胞#
6 举报