胰腺癌治疗新靶点,最新Nature!
2025-04-29 BioMed科技 BioMed科技 发表于陕西省
PDAC是致命癌症,缺乏有效疗法。研究发现PIKfyve是PDAC可靶向靶点,抑制它能减缓肿瘤进展,与KRAS-MAPK双重抑制有协同作用,为PDAC治疗提供新策略。
靶向PIKfyve驱动的脂质代谢减缓胰腺癌进展
PDAC仍然缺乏有效的治疗选择
胰腺导管腺癌PDAC是最致命的癌症之一,5年生存率只有13%。这在很大程度上是由于缺乏有效的治疗选择。PDAC肿瘤微环境是这种耐药性的核心,其特征是大量间质成纤维细胞和细胞外基质沉积,导致PDAC经历间质压力升高、血管性降低和营养物质可用性破坏胰腺导管腺癌(PDAC)存在于营养失调的微环境中,这使得它特别容易受到干扰癌症代谢的治疗的影响。例如,PDAC使用并依赖于高水平的自噬和其他溶酶体过程。尽管靶向这些途径在临床前研究中显示出潜力,但由于难以确定和描述药物开发的有利靶点,进展一直受到阻碍。
PDAC治疗新靶点PIKfyve
在这项研究中,密歇根大学Arul M. Chinnaiyan教授团队描述了PIKfyve,一种溶酶体功能不可或缺的脂质激酶,作为PDAC的可靶向易感性靶点。通过基因工程小鼠模型,作者确定了PIKfyve对PDAC进展至关重要。此外,通过全面的代谢分析,我们发现PIKfyve抑制迫使PDAC上调一个独特的转录和代谢程序,有利于从头合成脂质。在PDAC中,KRAS-MAPK信号通路是新生脂质合成的主要驱动因素。因此,同时靶向PIKfyve和KRAS-MAPK在许多临床前人类和小鼠模型中消除了肿瘤负担。综上所述,这些研究表明,通过抑制PIKfyve破坏脂质代谢,结合KRAS-MAPK导向的PDAC治疗可诱导合成致死。相关工作以“Targeting PIKfyve-driven lipid metabolism in pancreatic cancer”为题发表在Nature。

【文章要点】
一、Pikfyve对于前体PanIN病变发展为PDAC至关重要
在小鼠和人类样本中,胰腺上皮内瘤样病变(PanIN)和PDAC组织中Pikfyve的表达显著高于正常胰腺组织。这种Pikfyve表达的升高与细胞密度增加、血清饥饿和脂质缺乏等因素相关。在小鼠模型中,敲除一个或两个Pikfyve等位基因显著延长了小鼠的生存期。与对照小鼠相比,Pikfyve敲除小鼠的胰腺肿瘤负荷降低,保留了更多的正常组织结构。在更为恶性的KPC小鼠模型中,完全缺失Pikfyve导致胰腺肿瘤重量显著降低。组织病理学分析显示,与对照小鼠相比,完全缺失Pikfyve的KPC小鼠的肿瘤发生和进展程度明显降低。综上所述,PDAC细胞对Pikfyve依赖性显著增加,敲除Pikfyve可以抑制PDAC的发展和进展。这一发现提示Pikfyve可能是PDAC治疗的潜在靶点。
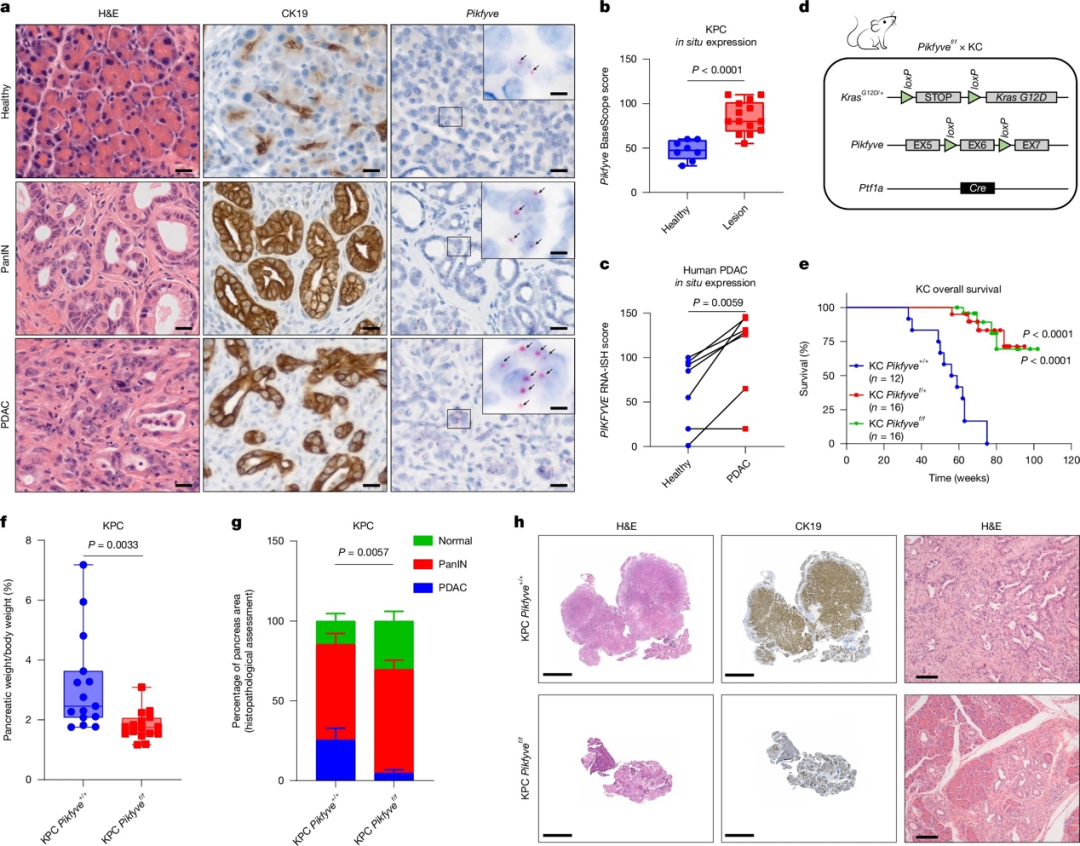
图1 Pikfyve对于前体PanIN病变发展为PDAC至关重要
二、药物抑制PIKfyve可阻断胰腺癌在体内的进展
基于基因组学干扰实验表明Pikfyve在抑制PDAC发展中的作用,作者接下来评估了药物抑制PIKfyve是否能产生类似效果。细胞热移位实验(CETSA)证实,PIKfyve抑制剂apilimod和ESK981能结合小鼠PIKfyve蛋白。这些PIKfyve抑制剂能够在短至30分钟内降低细胞中PtdInsP2和PtdIns5P的水平,并增加PtdIns3P的含量。作者对6周龄KPC小鼠进行为期4周的ESK981预防性治疗,结果显示ESK981组小鼠的胰腺重量接近野生型水平,病理学检查也发现其保留了更多正常组织结构,PanIN和PDAC负荷明显降低。在KPC7940B细胞株建立的异位移植瘤模型和UM19细胞株建立的原位移植瘤模型中,ESK981治疗都能显著降低肿瘤负荷,而不影响小鼠体重。综上所述,药物抑制PIKfyve,如使用ESK981,能够抑制PDAC的发展和生长,并且在小鼠中耐受性良好。
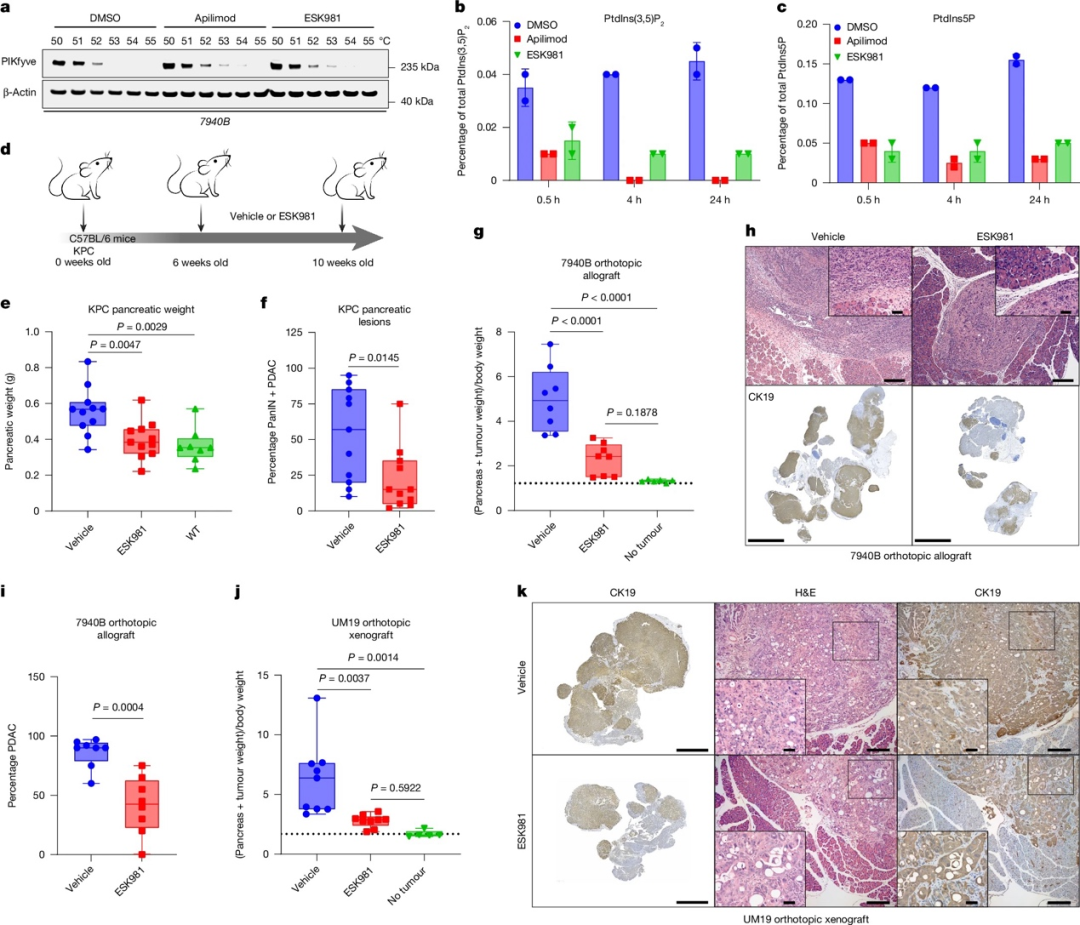
图2 药物抑制PIKfyve可阻断胰腺癌在体内的进展
三、抑制PIKfyve使PDAC细胞刺激脂肪生成转录和代谢程序
作者采用无偏CRISPR筛选的方法,全面评估了PIKfyve在PDAC代谢中的功能作用。作者在MIA PaCa-2细胞中进行两组不同剂量的PIKfyve抑制CRISPR筛选,结果显示高剂量组最大程度降低的靶基因集中在胆固醇、脂肪酸合成、脂肪酸延长和神经酰胺合成等核心代谢通路。这表明PDAC细胞对PIKfyve的抑制具有合成致死关系,需要依赖于新生脂肪酸合成通路。转录组分析和代谢组分析显示,PIKfyve抑制诱导PDAC细胞上调胆固醇稳态、mTORC1信号和脂肪酸代谢相关基因。代谢测定揭示,PIKfyve抑制导致7940B细胞中柠檬酸水平先降后升,同时上游的糖酵解代谢物显著降低,且大量促进了神经酰胺的合成。进一步研究发现,PIKfyve抑制引起溶酶体功能障碍,导致胆固醇在溶酶体膜上积累,诱导细胞依赖于新生脂肪酸合成。综上所述,这些结果说明PIKfyve在调节PDAC细胞代谢具有重要作用,为进一步开发针对PIKfyve的代谢靶向治疗提供了基础。

图3抑制PIKfyve使PDAC细胞刺激脂肪生成转录和代谢程序
四、KRAS-MAPK和PIKfyve双重抑制导致PDAC的代谢危机和协同生长抑制
作者进一步探讨了同时抑制PIKfyve和KRAS-MAPK通路对PDAC细胞的影响:KRAS抑制或MEK抑制能降低MYC的表达,减少MYC对FASN启动子的结合,表明KRAS-MAPK信号调控了PDAC细胞中脂肪酸合成基因的表达。单独PIKfyve抑制上调FASN和ACC1的表达,而同时抑制PIKfyve和KRAS则减弱了这种上调。同时抑制也减弱了PIKfyve抑制导致的脂质谱改变。在同种异体移植PDAC小鼠模型中,PIKfyve抑制剂ESK981联合MEK抑制剂trametinib治疗能完全消除肿瘤负荷,而单药治疗效果较为有限。在患者来源的原位移植瘤模型中,ESK981联合trametinib治疗能诱导大部分肿瘤消除,而单药治疗效果有限。在KPC小鼠自发性PDAC模型中,ESK981联合MEK抑制剂selumetinib可使小鼠存活时间大幅延长,且能诱导几乎所有肿瘤体积显著缩小。综上所述,这些结果表明,同时针对PIKfyve和KRAS-MAPK通路的组合疗法是一种高效的PDAC治疗策略,为后续临床应用提供了前景良好的依据。
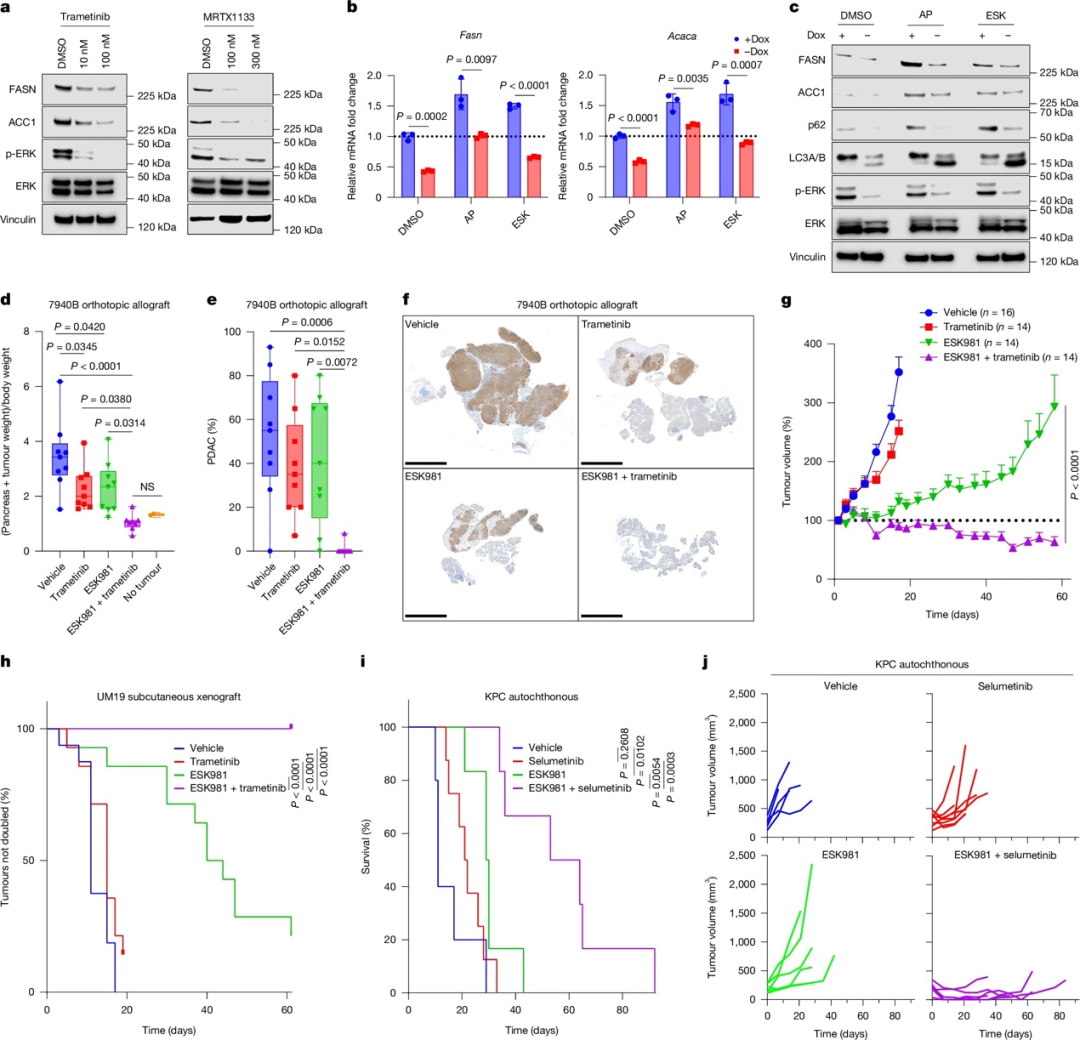
图4KRAS-MAPK和PIKfyve双重抑制导致PDAC的代谢危机和协同生长抑制
【结论与展望】
在这项研究中,作者提出PIKfyve作为破坏PDAC溶酶体功能的卓越治疗靶点。作者发现,PIKfyve和KRAS-MAPK具有双向合成致死关系。首先,PIKfyve功能是溶酶体依赖的脂质稳态所必需的,而KRAS-MAPK信号传导调节PDAC细胞的新生脂肪生成;其次,PIKfyve抑制导致溶酶体脂质代谢中断,迫使PDAC细胞上调并依赖于重新生成脂肪;第三,PIKfyve和KRAS-MAPK的双重抑制使PDAC陷入代谢危机,因为它无法获得细胞功能所需的脂质。鉴于突变体KRAS、pan-(K)RAS和MAPK途径抑制剂的快速发展,以及PIKfyve抑制剂ESK981,该药物目前正处于多中心2期临床试验(NCT05988918),这表明PIKfyve和KRAS-MAPK抑制剂联合使用是一种极有前景且可快速转化的治疗PDAC的治疗策略。
原文链接:
https://www.nature.com/articles/s41586-025-08917-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言




















#胰腺导管腺癌# #PIKfyve#
44 举报