J Hematol Oncol:姚浩/范方毅双靶点 CAR T 新突破!BCMA/GPRC5D 疗法在难治性骨髓瘤伴髓外病变中达 100% 缓解率,44.4% 完全缓解
2025-06-22 MedSci原创 MedSci原创 发表于上海
此次研究聚焦难治复发多发性骨髓瘤伴骨髓外病变的临床挑战,应用双靶点CAR T技术兼顾BCMA与GPRC5D,逻辑严谨且技术创新,初步展示出突破性的缓解率与可控安全谱。
亮点总结
- 创新性采用BCMA与GPRC5D双靶点设计的双特异性CAR T细胞,针对难治复发多发性骨髓瘤伴骨髓外病变患者,达到100%临床缓解率,44.4%完全缓解。
- 治疗安全性良好,66.7%患者出现轻中度(1-2级)细胞因子释放综合征,无重度神经毒性发生,安全可控。
- 12个月总生存率(OS)和无进展生存率(PFS)分别达到60%和63%,而中位生存时间尚未达到,提示持久治疗效果潜力。
研究综述
近期,发表于Journal of Hematology & Oncology的一项由西部战区总医院血液科姚浩等领导的单中心I期临床试验,评估了针对复发/难治多发性骨髓瘤(RRMM)伴骨髓外病变(EMD)患者的BCMA/GPRC5D双特异性CAR T细胞治疗的安全性与疗效。该研究针对RRMM伴EMD这一临床亟待突破的高风险群体,采用了创新的双靶点策略,期望克服单靶点治疗中的抗原逃逸和肿瘤异质性问题。共纳入12例患者,最终9例完成CAR T细胞输注并纳入有效分析,历时6个月以上的随访显示,治疗反应优异,安全可控,提示该策略作为一种潜在的突破性疗法,值得进一步多中心扩大样本进行深入验证。

研究背景
复发难治多发性骨髓瘤临床预后较差,尤其合并骨髓外病变(肿瘤细胞浸润骨髓外组织),其对传统治疗如蛋白酶体抑制剂、免疫调节药物及抗CD38单抗耐受性更强,生存期显著缩短[^1,^2]。目前,基于B细胞成熟抗原(BCMA)单靶点的CAR T细胞疗法虽已取得突破,但受限于肿瘤抗原下调、抗原异质性及抗原逃逸带来的复发,临床应用仍受挑战[^3–6]。
为了解决这一问题,研究者将G蛋白偶联受体GPRC5D作为第二靶点,因其在多发性骨髓瘤细胞上高表达而在多数正常组织中低表达而备受关注。双靶点CAR T细胞有望同时靶向两种抗原,提高肿瘤清除效率,减少抗原逃逸,提升治疗的持久性和广谱性[^9–12]。相关早期研究在小规模临床及动物实验中已显示出良好的抗肿瘤活性,然而针对RRMM伴EMD患者的临床报道尚缺乏。
研究方法概述
本研究为单中心、单臂、I期临床试验,纳入2023年7月至2024年9月期间诊断为RRMM伴骨髓外病变的患者共12例。患者在细胞采集后,针对个体肿瘤负荷情况采用桥接治疗:部分患者接受局部放疗或Elranatamab(BCMA靶向单抗)缓解肿瘤负荷,随后接受含氟达拉滨和环磷酰胺的淋巴清除方案,输注BCMA/GPRC5D双靶点CAR T细胞。输注剂量为1.0×10^6细胞/kg(1例为1.5×10^6细胞/kg)。主要终点为安全性和临床反应率,次要终点包括CAR T细胞扩增动力学、残留病变检测(MRD)及生存情况。疾病反应依据IMWG标准进行评估。
研究结果
患者基线特点及治疗背景
| 基线特征 | N=9 (%) |
|---|---|
| 中位年龄(范围) | 64岁(48–80) |
| 性别(女性) | 5(55.6%) |
| 中位诊断至治疗时间(月) | 48(7–160) |
| 单克隆免疫球蛋白类型 | IgG 4(44.4%),IgA 4(44.4%),IgD 1(11.1%) |
| 高危细胞遗传学 | 6(66.7%) |
| 骨髓外病变存在 | 9(100%) |
| R-ISS分期 | II 2(22.2%),III 7(77.8%) |
| 既往≥3条治疗方案 | 8(88.9%) |
| 既往自体干细胞移植(ASCT) | 2(22.2%) |
| 既往接受BCMA CAR T疗法 | 0(0%) |
临床反应情况
9例输注患者均观察到临床响应(ORR=100%)。其中完全缓解(CR)4例(44.4%)、非常好部分缓解(VGPR)2例(22.2%)、部分缓解(PR)3例(33.3%)。骨髓外病变也显示良好反应,4例完全消退,5例部分缩小。
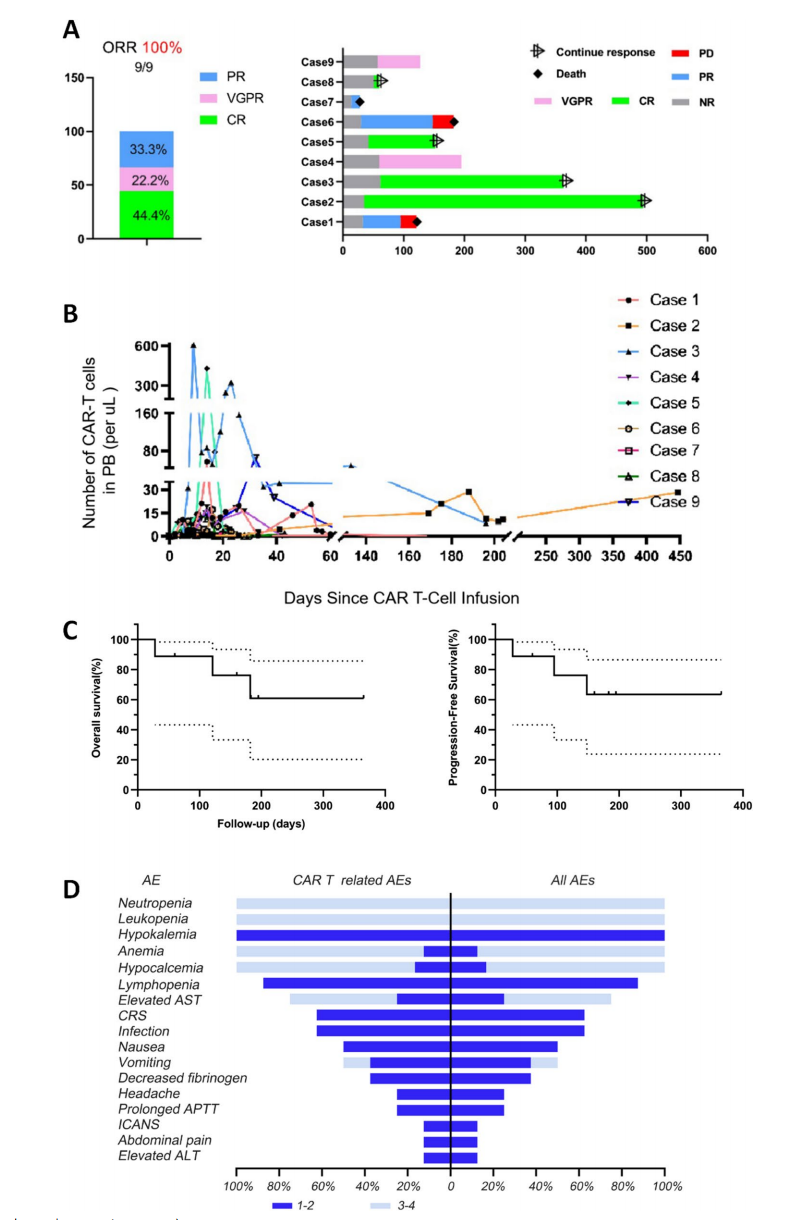
图:临床反应率及患者个体反应
CAR T细胞动力学
CAR T细胞在外周血中快速扩增,峰值多于输注后10-14天达到,且部分患者CAR T细胞检测时间超过400天,与更深且持久的临床反应相关。
生存分析
中位随访6.08个月(IQR 0.9–16.5个月),12个月OS率60%,PFS率63%,中位生存时间尚未达到,显示出潜在的长期疗效优势。
不良事件(AEs)
大多数患者经历了不同程度的血液学毒性,包括贫血、白细胞减少和血小板减少,88.9%患者出现血小板减少。细胞因子释放综合征(CRS)发生率为66.7%,均为1-2级,无严重神经毒性(ICANS)。其他免疫炎症标志物(IL-6、CRP、铁蛋白)短暂升高但均可逆。
研究价值与临床意义
本研究首次报道了BCMA/GPRC5D双特异性CAR T细胞在难治复发多发性骨髓瘤伴骨髓外病变患者中的临床应用,显示出极高的反应率和良好的安全性,证实双靶点策略克服单一靶点抗原逃逸的潜力。相较于过去单靶点CAR T细胞治疗,该新方案优化了抗肿瘤效果,尤其显著改善了骨髓外病变的治疗反应,解决传统治疗手段疗效有限的临床难题。
作为一项I期早期研究,其样本依然有限,且未设对照组,后续需要在更大规模、多中心的随机对照试验中验证疗效的持久性与安全性。此外,还应关注CAR T细胞扩增持续时间、免疫微环境的变化以及双靶点设计可能带来的脱靶效应风险。通过整合生物标志物与免疫监测,进一步优化输注剂量和桥接治疗方案,将可能提升治疗个体化水平。
本研究提示,未来骨髓瘤免疫治疗将更加注重多靶点结合、克服肿瘤异质性与免疫逃逸,这为难治复发患者带来新的希望,尤其是伴骨髓外病变高危群体。临床实践中,结合早期诊断、精确分子分型及新型联合治疗策略,或可实现转化治疗效果,改善患者长期生存和生活质量。
梅斯编辑点评
姚浩博士团队此次研究聚焦难治复发多发性骨髓瘤伴骨髓外病变的临床挑战,应用双靶点CAR T技术兼顾BCMA与GPRC5D,逻辑严谨且技术创新,初步展示出突破性的缓解率与可控安全谱。尤其是骨髓外病变完全缓解的实现,为临床提供了一种可行且潜力巨大的新策略。未来扩展样本量及延长随访,将有助于评估疗效持续性和免疫耐受性,同时探索与其他免疫调节剂联合治疗的可能性,是本领域值得期待的研究方向。
原始出处
Yao H, Ren SH, Wang LH, et al. BCMA/GPRC5D bispecific CAR T-cell therapy for relapsed/refractory multiple myeloma with extramedullary disease: a single-center, single-arm, phase 1 trial. J Hematol Oncol. 2025;18:56. DOI: 10.1186/s13045-025-01713-2.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#BCMA/GPRC5D 疗法# #难治性骨髓瘤伴髓外病变#
17 举报