抑制剂,最新Nature Cancer,治疗肿瘤的“万能钥匙”
2024-08-25 BioMed科技 BioMed科技 发表于上海
首次全面描述了BRD-810这一MCL1抑制剂的设计原理、体外和体内实验的数据、以及对心脏细胞的影响等。
什么是MCL1?
MCL1(Myeloid Cell Leukemia 1)是一种在细胞凋亡调控中发挥关键作用的抗凋亡蛋白,属于Bcl-2家族成员之一。它通过与促凋亡蛋白如BAX和BAK等相互作用,阻止这些蛋白形成线粒体外膜上的孔隙,从而维持线粒体的完整性和细胞的存活。在细胞环境中,MCL1的表达水平受到严格的调控,以确保细胞在面对压力和损伤时能够平衡生存与死亡的决策。
MCL1异常对肿瘤细胞有哪些影响?
在肿瘤细胞中MCL1的功能异常,可能导致对凋亡的抵抗,促进肿瘤的生长和扩散,同时影响肿瘤微环境中的免疫细胞和基质细胞,从而在肿瘤发展、转移和治疗抵抗性中发挥重要作用。此外,MCL1的过表达还与多种肿瘤的不良预后相关,使其成为癌症治疗中的一个潜在靶点。
MCL1影响哪些肿瘤的生长进程?
MCL1在多种肿瘤中发挥作用,包括但不限于急性髓系白血病、慢性淋巴细胞性白血病、非小细胞肺癌、乳腺癌、肝癌、胰腺癌、泌尿系统肿瘤如膀胱癌,以及某些类型的淋巴瘤和多发性骨髓瘤,其过表达通常与肿瘤的侵袭性、转移潜力和治疗抵抗性增加有关,同时也与患者的不良预后相关。
针对MCL1的治疗手段主要集中在开发能够抑制其抗凋亡功能的靶向药物,目前在研或已经进入临床试验的治疗策略包括:
1. MCL1抑制剂:这些药物可以直接结合MCL1蛋白,阻断其与促凋亡蛋白的相互作用,从而恢复肿瘤细胞的凋亡途径。
2. BH3模拟物:这类化合物模仿BH3-only蛋白的行为,能够与Bcl-2家族的抗凋亡蛋白(包括MCL1)结合,促使促凋亡蛋白的激活和肿瘤细胞的凋亡。
3. 基因编辑技术:如CRISPR/Cas9系统,理论上可以用来敲除或敲减MCL1基因,减少肿瘤细胞中的MCL1表达。
4. siRNA和shRNA:通过RNA干扰技术降低MCL1的mRNA水平,从而减少MCL1蛋白的产生。
5. 抗体药物偶联物(ADCs):利用特异性针对MCL1的抗体将细胞毒性药物直接传递到表达MCL1的肿瘤细胞。
6. 免疫治疗:某些免疫治疗策略可能通过调节肿瘤微环境来影响MCL1的功能,尽管这并不是直接针对MCL1的治疗方法。
7. 代谢途径干预:由于MCL1在细胞代谢中的作用,针对肿瘤细胞特定代谢途径的治疗可能间接影响MCL1的功能。
小分子抑制剂相比其他疗法,具有精准靶向特定分子靶点的能力,通常具有良好的口服生物利用度和药代动力学特性,便于制造和成本控制,同时提供了剂量调整的灵活性和联合治疗的潜力。它们还具备化学稳定性和快速作用的优势,能够适应不同的医疗环境,并有可能穿透生物屏障,为某些难以治疗的疾病部位提供疗效,代表了现代药物设计和治疗策略的创新。目前,针对MCL1治疗的抑制剂已被报道的有AMG 176、AZD5991、S64315、UMI-77、ABT-199、APR-246、BGB-15025等。近期,Trueline Therapeutics Inc.公司研发了一种新型的MCL1抑制剂-BRD-810。相较于其他的抑制剂,BRD-810表现出高度的选择性,快速的系统清除能力,这可能降低与长期MCL1抑制相关的毒性风险;在体外实验中对肿瘤细胞具有迅速的杀伤效果,同时对心脏细胞显示出较好的安全性;在体内模型中即使在短暂的药物暴露后也能快速诱导肿瘤细胞凋亡,显示出强大的抗肿瘤效果;此外,BRD-810的研究还提出了可能的生物标志物,有助于预测患者对治疗的反应,从而为个性化医疗提供支持。这些特性使得BRD-810在MCL1抑制剂领域具有潜在的临床优势。
麻省理工学院和哈佛大学布罗德研究所Todd R. Golub和Trueline Therapeutics Inc.公司的Ulrike Rauh及其团队首次全面描述了BRD-810这一MCL1抑制剂的设计原理、体外和体内实验的数据、以及对心脏细胞的影响等。相关研究内容以“BRD-810 is a highly selective MCL1 inhibitor with optimized in vivo clearance and robust efficacy in solid and hematological tumor models”为题发表在《Nature Cancer》上。

主要内容
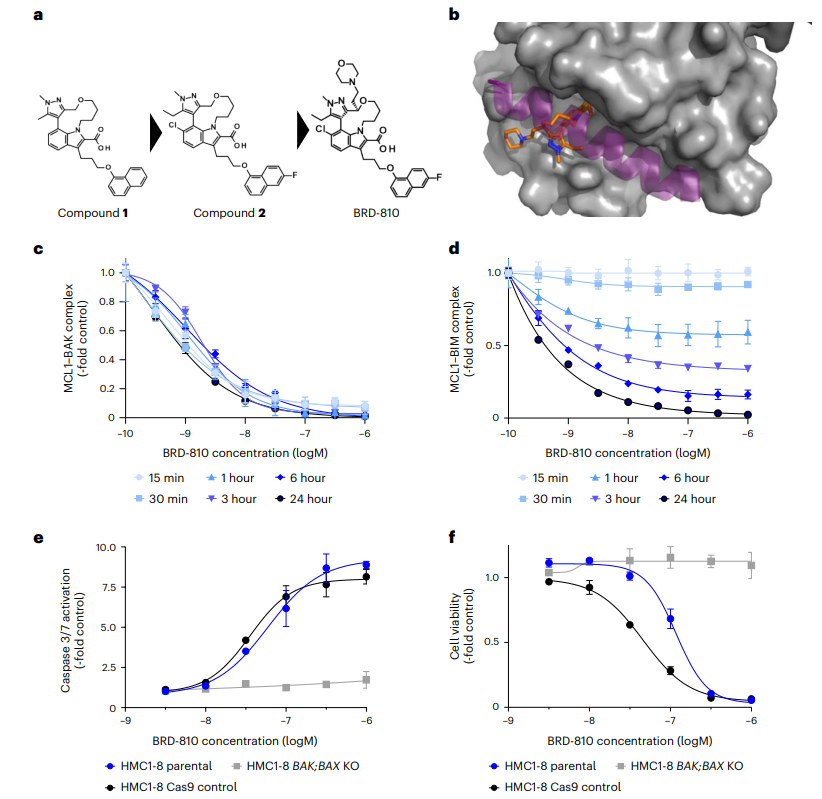
图1 BRD-810是强效和选择性的MCL1抑制剂
本文对BRD-810的分子结构以及其与MCL1的结合方式进行了展示。实验结果首先显示了BRD-810对MCL1与BAK或BIM蛋白复合物结合的解离作用。随后证明了BRD-810在不同浓度下对肿瘤细胞caspase 3/7激活和细胞活性的影响,证实了其诱导凋亡的效力和选择性。这些数据共同证明了BRD-810作为一种强效、选择性的MCL1抑制剂,在体外实验中对肿瘤细胞具有快速杀伤作用,且对心脏细胞影响较小,为其作为抗癌药物的潜力提供了科学依据。
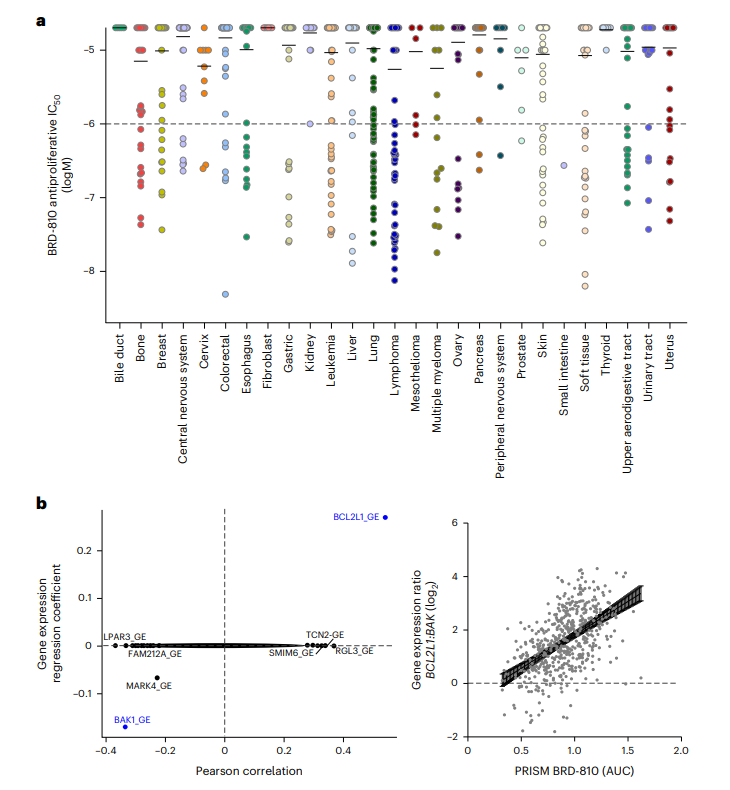
图2 BRD-810展示出的抗肿瘤效果
BRD-810在广泛的癌症类型中显示出抗肿瘤活性,并且通过基因表达分析,研究者发现了可能预测BRD-810敏感性的生物标志物,为未来的患者分层和个性化治疗提供了潜在的指标。
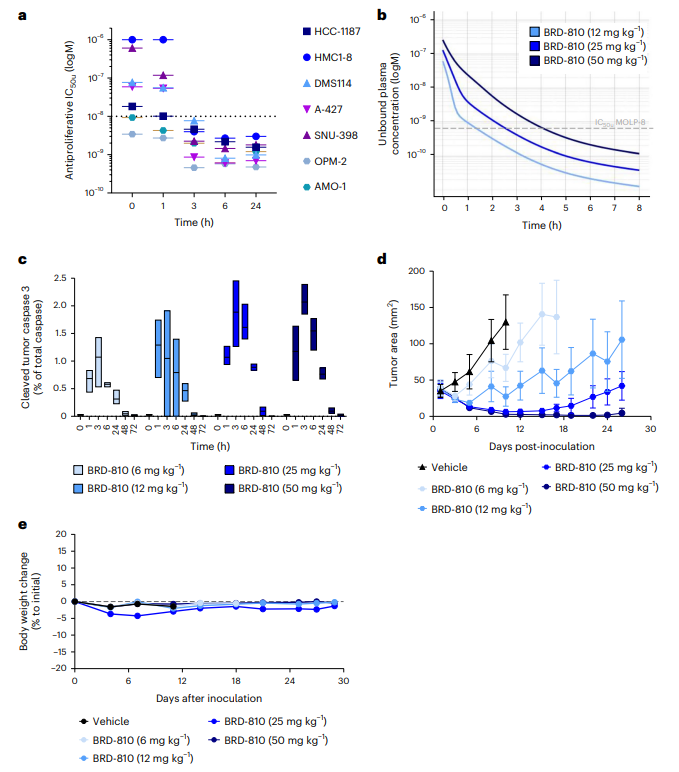
图3 BRD-810诱导的肿瘤细胞死亡的动力学以及其在体内抗肿瘤效果
BRD-810具有快速的细胞杀伤效果,并且在体内显示出抗肿瘤活性,同时在短期内未观察到明显的体重变化,表明BRD-810可能具有良好的耐受性和安全性。
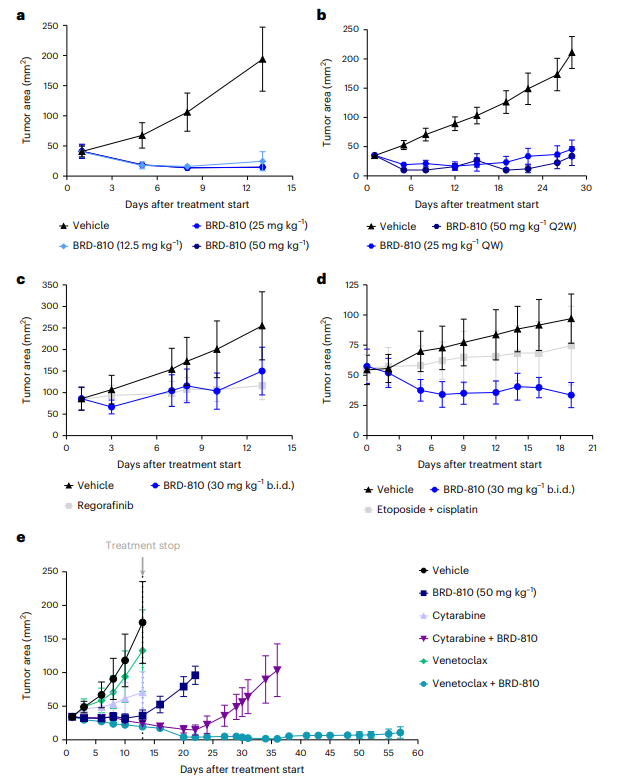
图4 BRD-810在多种血液和实体瘤异种移植模型中的体内抗肿瘤效果
BRD-810作为一种MCL1抑制剂,在不同类型的肿瘤模型中具有显著的抗肿瘤潜力,并且支持进一步的临床开发。
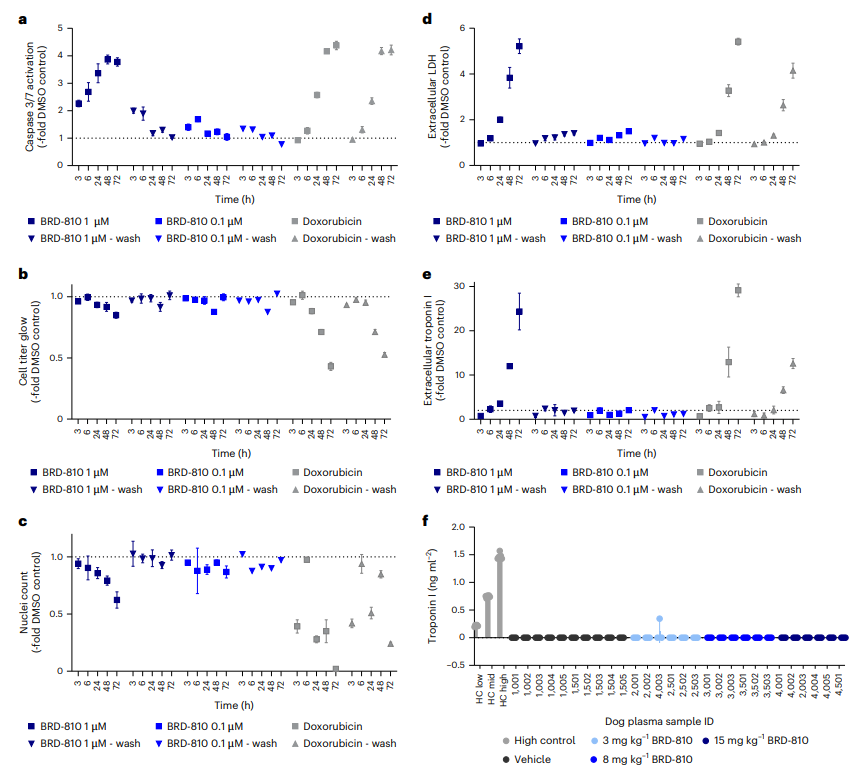
图5 BRD-810对人类诱导的多能干细胞(hiPSC)衍生的心肌细胞的影响
与多柔比星相比,BRD-810即使在超药理浓度下,对hiPSC衍生的心肌细胞显示出较低的毒性,且在犬类模型中未引起血液中肌钙蛋白I水平的显著升高,这表明BRD-810具有潜在的心脏安全性。这些发现支持BRD-810作为MCL1抑制剂在临床开发中的安全性,并强调了其快速清除特性在减少心脏毒性方面的潜在优势。
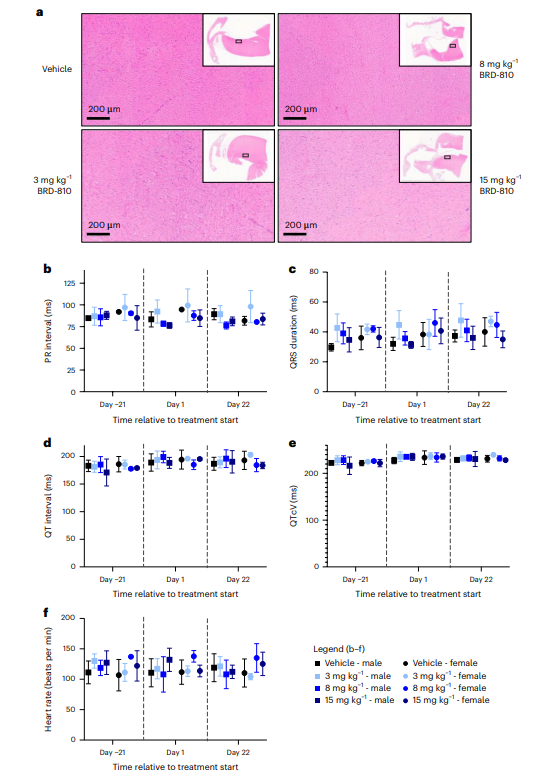
图6 BRD-810对犬类模型心脏组织和心电图(ECG)参数影响
BRD-810在犬类模型中显示出良好的心脏安全性,没有证据表明BRD-810引起心脏组织损伤或ECG参数的不利变化,进一步支持了BRD-810作为MCL1抑制剂在临床开发中的潜力。
总结与展望
BRD-810的设计考虑了快速系统清除,以最小化与MCL1抑制相关的潜在毒性。BRD-810能迅速诱导肿瘤细胞凋亡,而对心脏细胞影响较小。BRD-810作为一种有前景的MCL1抑制剂,其开发和研究将继续为癌症治疗领域带来新的希望,特别是对于那些对现有治疗无效或有严重副作用的患者。
原文链接:
https://doi.org/10.1038/s43018-024-00814-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#MCL1# #抗凋亡蛋白#
63 举报