J Clin Invest 西交大一附院王胜鹏/袁祖贻/闫炀团队揭示肺纤维化标志物和力学机制
2025-06-06 论道心血管 论道心血管 发表于上海
该研究首次揭示骨膜蛋白(Periostin)作为肺肌成纤维细胞的特异性标记物,并阐明机械敏感离子通道PIEZO1通过调控肌成纤维细胞活化驱动肺纤维化的分子机制。
特发性肺纤维化(IPF)是一种致命性间质性肺病,患者确诊后平均生存期不足5年。其核心特征是肺内肌成纤维细胞过度活化并分泌大量细胞外基质,导致肺组织瘢痕化和机械应力异常。全球每年新增IPF患者超50万,中国患病人数约占1/3,且发病率呈上升趋势。目前仅有两款药物可延缓疾病进展,但无法逆转纤维化。肌成纤维细胞作为肺纤维化中的核心效应分子,在肺组织结构维持、损伤修复和疾病进程中发挥着不可或缺的重要作用。然而,肌成纤维细胞的来源、命运及其感知机械信号的机制一直是困扰科学界的难题。
2025年6月2日,西安交通大学第一附属医院王胜鹏/袁祖贻/闫炀团队在国际权威期刊Journal of Clinical Investigation在线发表题为“PIEZO1 mediates periostin+ myofibroblast activation and pulmonary fibrosis”的研究论文,该研究首次揭示骨膜蛋白(Periostin)作为肺肌成纤维细胞的特异性标记物,并阐明机械敏感离子通道PIEZO1通过调控肌成纤维细胞活化驱动肺纤维化的分子机制。相关成果从独特力学视角揭示了IPF发病机制,有望改写这一“类癌症”疾病的治疗格局。
该研究团队利用自主开发的Postn-CreERT2;mTmG示踪小鼠和Postn-CreERT2;iDTR小鼠证实:骨膜蛋白(Postn)是肺损伤后肌成纤维细胞的标记物,特异性消融Postn+细胞可显著减轻博来霉素诱导的小鼠肺纤维化。研究人员发现PIEZO1在Postn+肌成纤维细胞中功能性表达,并通过感知细胞膜张力变化,激活钙离子内流和下游Yap/Taz信号通路,驱动肌动蛋白骨架重构和细胞增殖。总之,该研究确定了肺肌成纤维细胞中PIEZO1力学感知在特发性肺纤维化发挥重要作用,为治疗肺纤维化提供了全新的药物靶点。

首先,研究者利用自主开发的Postn-CreERT2基因编辑小鼠模型,结合谱系示踪技术证实:骨膜蛋白(Postn)是肺损伤后肌成纤维细胞的标记物,Postn+细胞几乎覆盖所有活化的肌成纤维细胞。通过构建Postn-CreERT2;iDTR小鼠模型,研究者进一步发现,特异性消融Postn+细胞可显著减轻博来霉素诱导的小鼠肺纤维化程度。此外,在特发性肺纤维化(IPF)患者的肺组织中,Postn+肌成纤维细胞高度富集于纤维化病灶内,这一结果进一步凸显了Postn标记物在肺纤维化中的重要临床相关性。
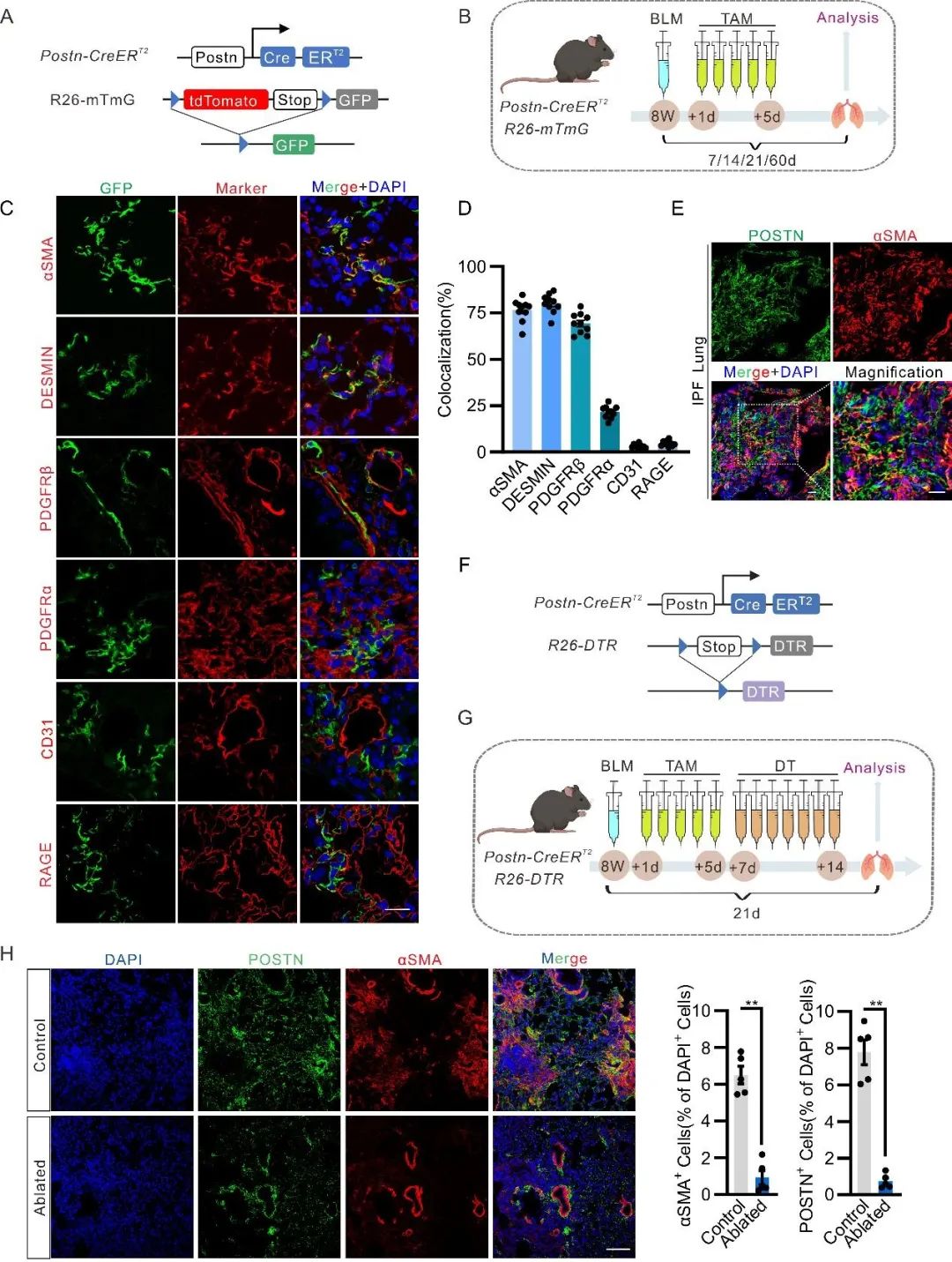
肌成纤维细胞的激活由生化信号和机械刺激协同驱动,而机械稳态的破坏是纤维化组织的重要特征。PIEZO1作为在包括肺组织在内的多种组织中表达的主要机械传感器,其在肺纤维化中的作用备受关注。研究者通过构建Piezo1-CreER谱系示踪小鼠,结合博来霉素(BLM)诱导的肺纤维化模型,利用免疫荧光、荧光寿命成像(Flim)、膜片钳(Patch)和钙内流检测等技术手段,证实PIEZO1在Postn+肌成纤维细胞中具有功能性表达。

接下来,为了探究肌成纤维细胞中Piezo1在肺纤维化中的作用,研究者构建了Postn-Piezo1-KO小鼠,通过博来霉素(BLM)诱导肺纤维化模型,发现肌成纤维细胞特异性敲除Piezo1可显著降低肺部炎症反应并改善肺纤维化程度。与此同时,利用GsMTx4药物抑制Piezo1功能的实验显示,药理性抑制Piezo1同样能显著改善肺纤维化。这些发现为肺纤维化的防治提供了全新的药物靶点。
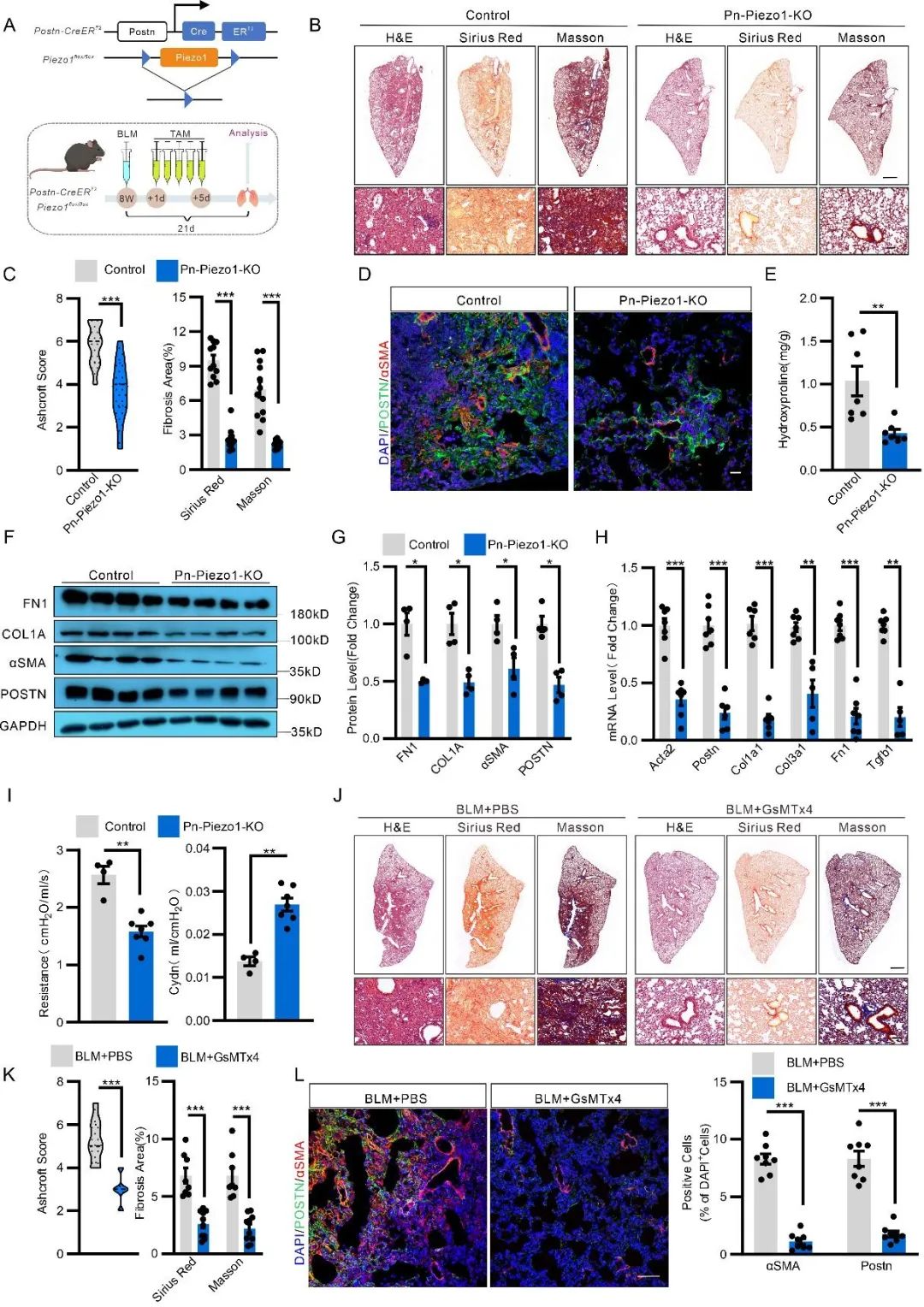
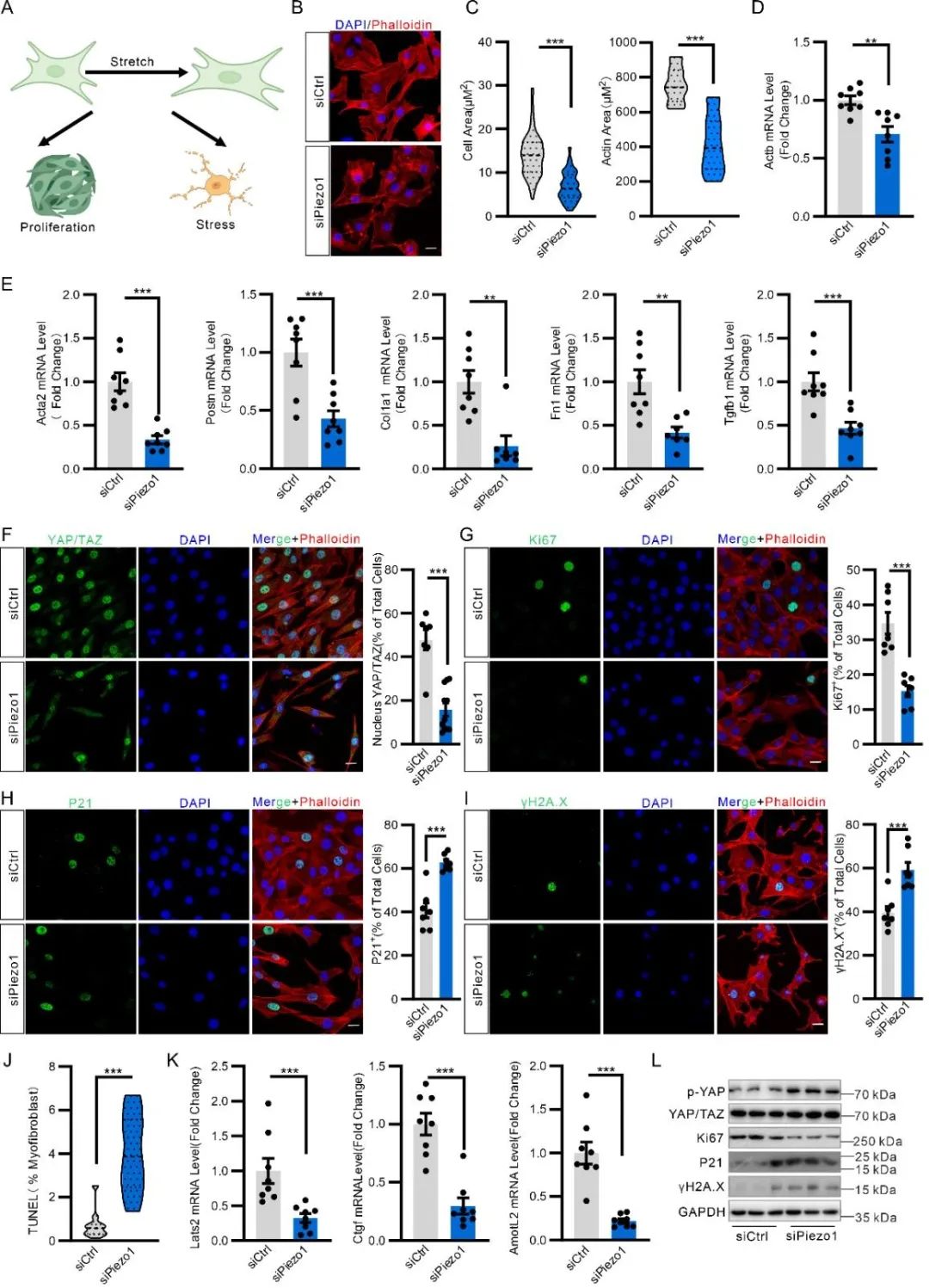
为了探究PIEZO1在体内对肌成纤维细胞状态的调控作用,研究者将Postn-Piezo1-KO小鼠与mT/mG报告系小鼠杂交,同步示踪缺乏Piezo1的肌成纤维细胞命运。结果发现,肌成纤维细胞Piezo1缺失会导致细胞增殖能力下降,并向凋亡状态转换。这一现象在Postn-YAP/TAZ-dKO小鼠(YAP/TAZ双敲除)中也得到了验证,表明PIEZO1可能通过调控YAP/TAZ信号通路影响细胞命运。
在体外研究中,研究者将NIH3T3小鼠成纤维细胞经TGF-β诱导分化为肌成纤维细胞,并培养于可进行单轴拉伸的硅膜上,模拟体内机械应力环境。通过qPCR、蛋白质免疫印迹(WB)和免疫荧光染色等技术检测发现:机械拉伸或添加PIEZO1激动剂Yoda1可激活PIEZO1,通过PIEZO1-RhoA/ROCK-YAP/TAZ信号轴促进肌成纤维细胞活化、增殖,抑制细胞凋亡,并加速细胞外基质(ECM)的合成与分泌;反之,敲除PIEZO1则会显著抑制肌成纤维细胞的活化与增殖,促进细胞凋亡,并减少ECM产生。
综上所述,该研究阐明肺肌成纤维细胞主要来源于Postn+细胞,而肌成纤维细胞中PIEZO1作为肺纤维化进程的关键力学调控因子,通过PIEZO1-RhoA/ROCK-YAP/TAZ信号轴驱动特发性肺纤维化的发生发展,有望为临床治疗肺纤维化提供全新的药物靶点。
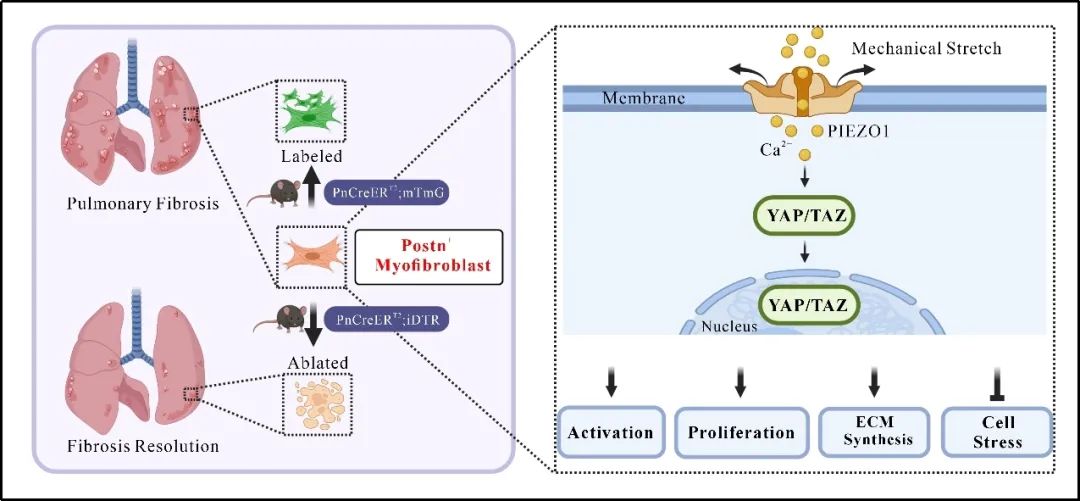
肺肌成纤维细胞Piezo1缺失缓解肺纤维化的机制图
西安交通大学第一附属医院博士生徐丽然、李婷,西安交通大学基础医学院副教授曹亚朋与西安交通大学第一附属医院博士后贺雨为该论文共同第一作者,王胜鹏教授、袁祖贻教授和闫炀教授为共同通讯作者。该工作得到了德国马克斯普朗克心肺研究所Stefan Offermanns教授和中国科学院分子细胞科学卓越创新中心周斌教授等团队的支持。
论文链接:
https://www.jci.org/articles/view/184158/pdf
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#特发性肺纤维化# #骨膜蛋白#
21 举报