大反转!从抗癌到促癌?Nature:功能饮料中这种常见成分,促进血癌生长;但曾因“抗癌”作用登上Cell
2025-06-05 木白 MedSci原创 发表于上海
CNS“大满贯”的功能饮料常见成分为何跌落“神坛”?
谁能想到,那个总被包装成“提神神器”的功能饮料小配角——牛磺酸,居然比主角还“风光”:抗癌、控体重、抗衰老三线“开花”,还分别登上了Cell、Nature、Science的CNS“三大刊”舞台。
不过,就在大家还沉浸在“牛磺酸=有益健康”的滤镜里时,近期,由来自美国罗彻斯特大学的研究团队发表在Nature的一项研究[1]却突然甩出一记“反转大招”——白血病细胞依赖牛磺酸转运蛋白吸收牛磺酸,并将其传送至细胞内部,进而助推癌细胞的生长与扩增。更令人意外的是,外源性补充牛磺酸竟会加速髓系白血病进展;相反,若阻断牛磺酸转运蛋白的功能,则可显著抑制白血病细胞的增殖与生存,提示这一转运蛋白或可成为未来治疗的潜在靶点。

牛磺酸:
LSC赖以生存的“秘密武器”
在与髓系白血病的“攻防战”中,癌细胞并非孤军奋战。它们善于借助“地利之便”——也就是骨髓中的肿瘤微环境(TME)来增强自身的生长优势。特别是白血病干细胞(LSC),它们通过与周围细胞之间复杂而精密的“信息交流”,不断获取支持信号,从而实现持续生长和逃避免疫清除。
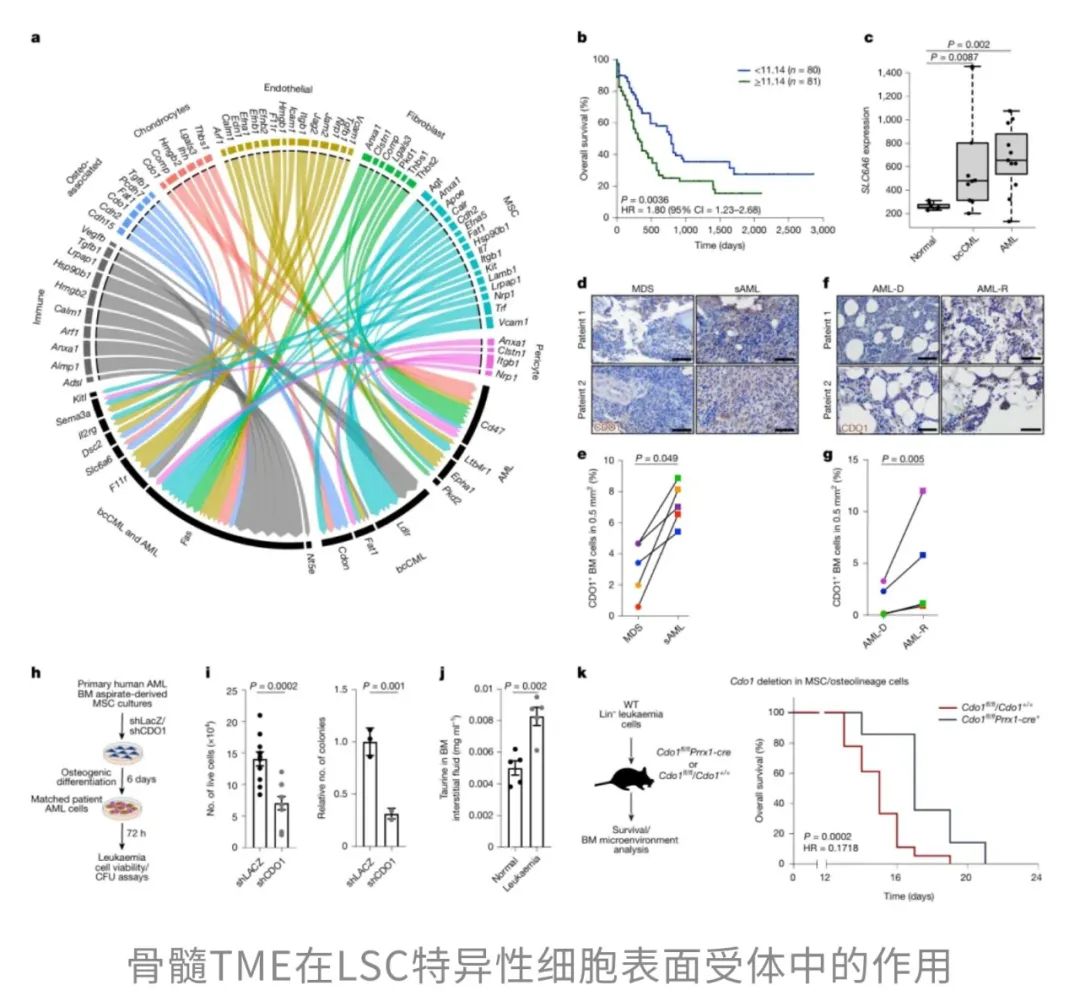
为了揭示这些“支持信号”的关键来源,研究团队绘制了一张详尽的“LSC–TME配体-受体互作图谱”,并从中筛选出22个在人类LSC中高表达的受体候选分子。但这些受体中,哪些真正对病情恶化有“推动作用”?研究者进一步将这些受体基因的表达水平与急性髓系白血病(AML)患者的临床预后数据进行关联分析。结果显示,只有低密度脂蛋白受体(LDLR)和SLC6A6的高表达与患者不良结局显著相关,提示它们可能是LSC赖以生存和白血病进展的重要“通信枢纽”。
其中,LDLR是调节胆固醇代谢的关键分子,其主要配体之一是载脂蛋白E(APOE)。进一步研究发现,APOE在骨髓间充质干细胞(MSCs)中的表达水平极高,提示其很可能是TME中支持白血病的重要信号分子。
相比之下,另一个受体SLC6A6则展现出更具“营养依赖性”的特征。SLC6A6编码的是高亲和力的牛磺酸转运蛋白TAUT,能够将骨髓环境中的牛磺酸高效地转运进入LSC。并且,SLC6A6在AML中的LSC显著上调,且其表达可被致癌基因直接诱导,强化了它在肿瘤发生中的功能基础。
在体外共培养实验中,研究者发现TAUT的缺失显著削弱了LSC在骨系细胞支持下的生长能力。这一结果提示,LSC 并不具备自身合成牛磺酸的能力,而是高度依赖TME中骨系细胞所提供的外源性牛磺酸。然而,即使TME中仍持续供应牛磺酸,缺乏TAUT的LSC也无法有效吸收和利用,进一步强调了TAUT在介导牛磺酸摄取中的关键作用。
那么,这些牛磺酸从哪来?

这一结果不仅体现在体外实验中,也在体内小鼠模型及人类患者来源的AML细胞中得到了验证:抑制牛磺酸的合成通路,不仅削弱了LSC的生长能力,还改善了实验动物的生存结局。补充牛磺酸可促进LSC的生长,加速白血病的进展。
也就是说,牛磺酸是骨髓TME中LSC生存和扩张的重要“营养源”,而LSC则通过SLC6A6作为“入口”源源不断地摄取这些营养分子。
另外,多组学分析进一步揭示了牛磺酸在LSC中的深层作用机制:一旦失去对牛磺酸的摄取能力,LSC中依赖RAG-GTP激活的mTOR信号通路便无法顺利启动,随之而来的,是其下游糖酵解代谢路径的明显受抑。这意味着,牛磺酸并非只是单纯的“营养物资”,它更像是点燃LSC能量引擎的“启动钥匙”。这一信号–代谢链路清楚地表明:牛磺酸在白血病细胞中,承担着调控能量代谢与信号转导的双重角色,是支撑其恶性生存状态的重要分子。
“双剑合璧”:
TAUT抑制剂联手Venetoclax,抗癌更有力
尽管TAUT在小鼠白血病模型中的功能已获得初步验证,但其在人类AML中的临床相关性以及作为治疗靶点的潜力仍有待深入评估。

这些结果不仅揭示了TAUT在牛磺酸代谢通路中的关键地位,也提示其可能是venetoclax耐药AML亚型的代谢弱点。换句话说,靶向TAUT不仅具备选择性,还能增强现有治疗的疗效,未来有望为难治性AML提供新的治疗选项与转化方向。
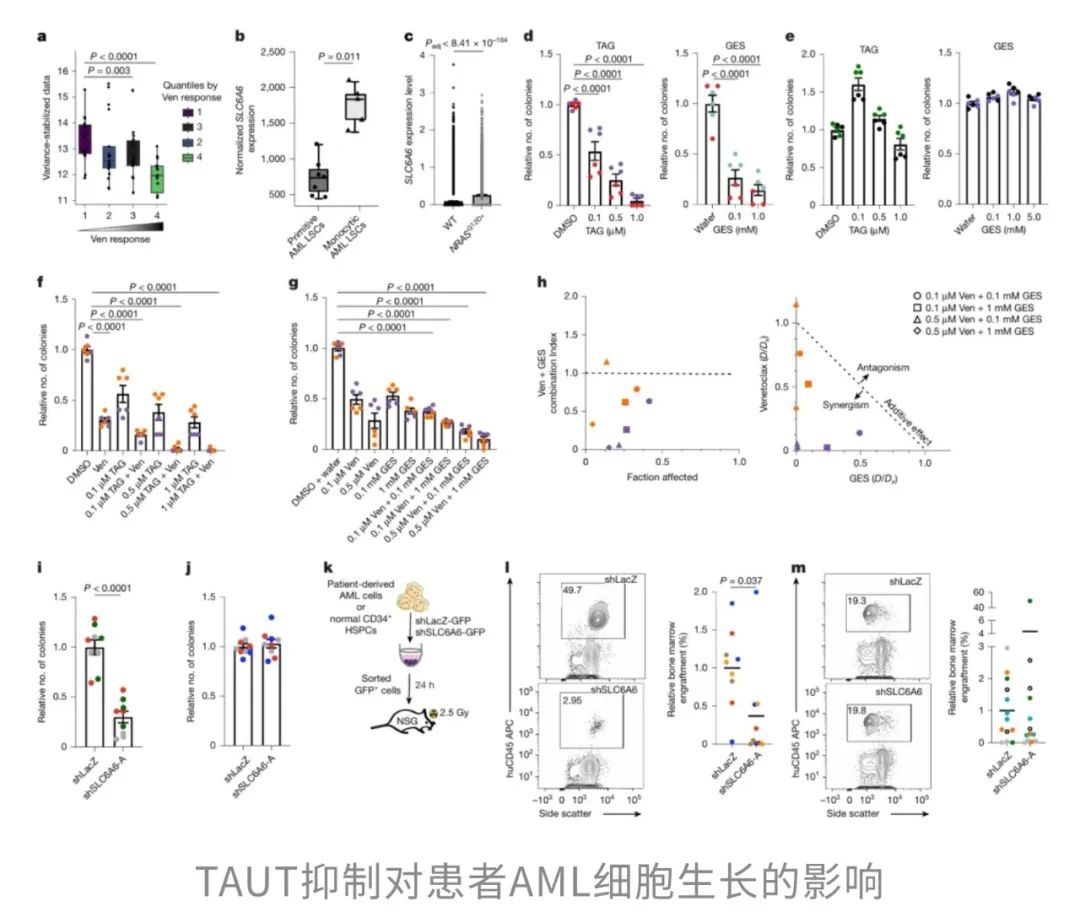
总的来说,这项研究表明,尽管牛磺酸在能量饮料和化疗辅助补充剂中广泛存在,在白血病患者中使用牛磺酸需要格外谨慎。高剂量的牛磺酸补充可能会促进白血病的生长。
免疫细胞“重振旗鼓”
就在大家被这项Nature新研究惊得一头雾水、开始质疑牛磺酸是否真的“站错了队”时,不妨回头看看之前Cell发表的另一项重量级研究[2]——它给出了几乎截然相反的结论:牛磺酸不仅不是肿瘤帮凶,甚至还是T细胞打赢肿瘤战役的关键能量补给。这不禁让人陷入思考:牛磺酸到底是“好”还是“坏”?是在助长癌细胞,还是在增强免疫力?

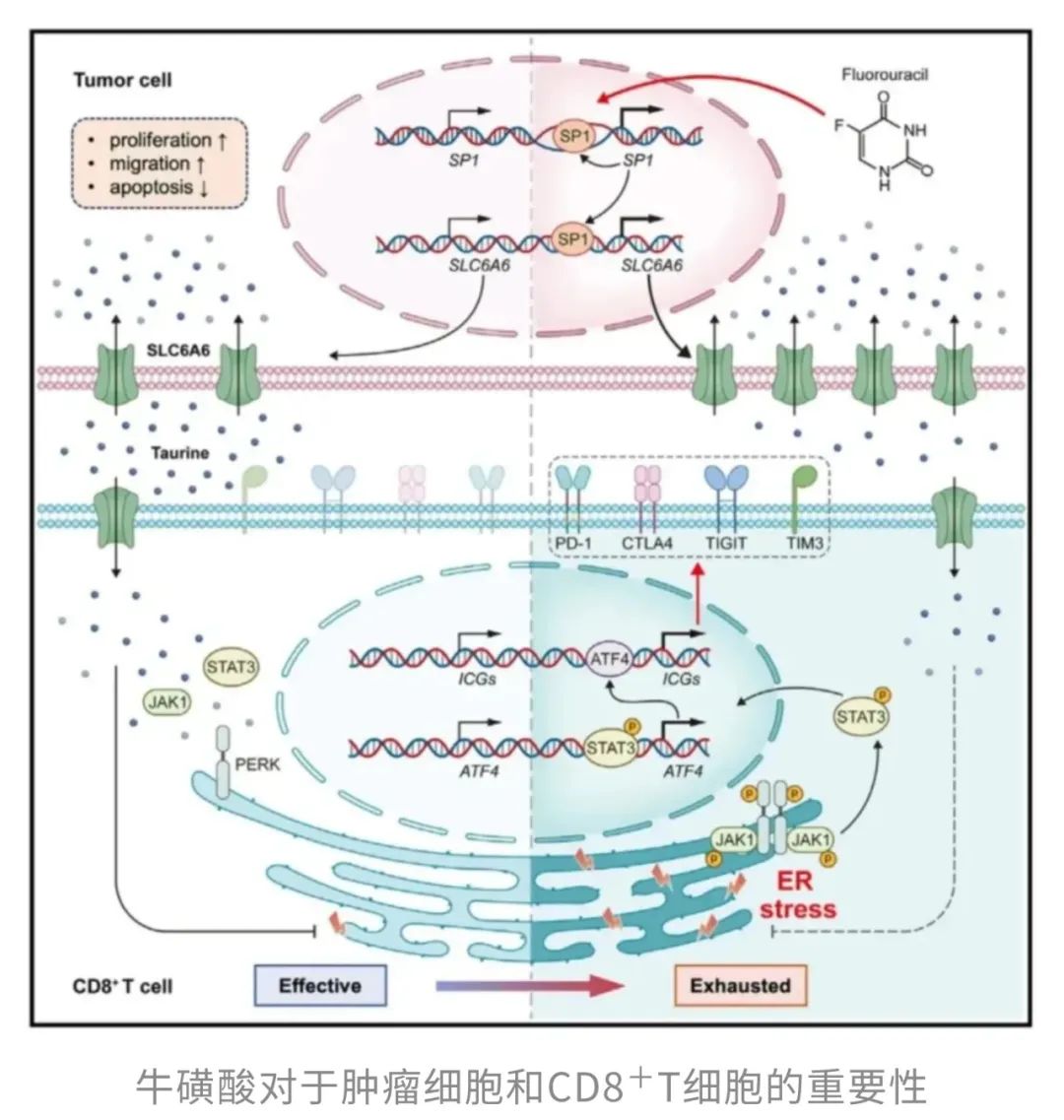
在肿瘤免疫这场“攻防战”中,牛磺酸转运蛋白SLC6A6再次扮演了关键角色。研究发现,在多种类型的肿瘤组织中,SLC6A6的表达水平显著升高,并与肿瘤侵袭性增强和患者预后不良密切相关。高表达的SLC6A6使得肿瘤细胞在微环境中具备更强的“资源掠夺”能力,优先摄取牛磺酸,从而让周围的CD8⁺ T细胞陷入严重的营养匮乏。
而这场由牛磺酸缺失引发的“饥饿战”,在T细胞内部激起了一系列连锁反应。具体而言,牛磺酸不足会激活CD8⁺ T细胞中的内质网(ER)应激反应,并通过PERK–JAK1–STAT3信号轴促使转录因子ATF4表达上调。并且,ATF4的活化不仅本身持续存在,还进一步诱导了包括PD-1在内的多个免疫检查点分子的高表达,使T细胞功能持续受限,逐步陷入深度衰竭状态。肿瘤细胞借由这一“牛磺酸饥饿策略”,悄无声息地削弱了免疫系统的反击能力。
更令人警觉的是,研究者在胃癌模型中还揭示了一个潜在的恶性循环:常规化疗虽能杀伤肿瘤细胞,却会激活转录因子SP1,而SP1又进一步诱导SLC6A6表达上调,反而助长了肿瘤细胞对牛磺酸的依赖和摄取。这意味着,在某些情境下,传统疗法可能在不经意间加剧了肿瘤的免疫逃逸。
不过,研究同样提供了逆转这一困局的希望。通过外源性补充牛磺酸,可显著缓解T细胞因营养缺乏所导致的ER应激,重启其免疫功能,恢复对肿瘤的杀伤能力。同时,牛磺酸的补充还能够增强化疗等现有治疗策略的总体效果,为未来肿瘤治疗提供了全新的联合干预思路。
牛磺酸的“分裂人生”
看似矛盾的两项研究,其实折射出牛磺酸在不同肿瘤类型和TME中的“双面角色”。
在白血病中,牛磺酸的角色更接近于“燃料”——它直接被癌细胞摄取,用于支持其能量代谢和快速扩增。研究[1]发现,LSC自身无法合成牛磺酸,完全依赖转运蛋白TAUT从骨髓TME中摄取。令人意外的是,骨髓中的成骨细胞谱系还高表达牛磺酸合成酶 CDO1,主动为LSC提供牛磺酸。这一代谢依赖形成了癌细胞与TME之间的“营养联盟”。
相反,在实体瘤中,牛磺酸则更像是一种“能量补给”,其缺失会严重削弱CD8⁺ T细胞的战斗力。由于肿瘤细胞高表达 SLC6A6,疯狂“抢占”牛磺酸资源,导致周围免疫细胞陷入严重营养匮乏,功能受损,进而出现免疫逃逸。
这种角色转换背后,也体现在各自截然不同的信号通路上。在白血病中,牛磺酸通过激活 Rag-GTP依赖的mTOR信号,驱动糖酵解,直接为癌细胞源源不断提供能量。而在实体瘤中,牛磺酸缺乏会触发CD8⁺ T细胞内质网应激,继而通过PERK–JAK1–STAT3通路诱导ATF4 上调,进一步驱动PD-1等免疫检查点基因表达,最终导致T细胞功能衰竭。
这两项结论“矛盾”的研究,实则揭示了同一个代谢本质——牛磺酸是一种高度竞争性的“营养战略物资”,其生物学效应取决于TME中哪一方占据主导地位:
-
如果癌细胞更强势(如白血病),牛磺酸就成了支持其代谢的“助燃剂”;
-
如果免疫细胞得势(如实体瘤联合牛磺酸补充),牛磺酸则转化为激活抗肿瘤免疫的“能量源”。
未来的肿瘤治疗策略,也许不该再将“促进”或“抑制”作为单选题,而应在精确识别的基础上,设计双向调控、因病制宜的综合干预手段,实现真正的代谢免疫双赢。
如此看来,牛磺酸的补充并非人人适用,尤其对白血病患者而言更需格外谨慎。若盲目摄入牛磺酸补充剂(如蛋白粉、能量饮料),反而可能在无意中“喂养”了癌细胞,增加疾病进展的风险。
当然,这并不意味着牛磺酸就是“有害物质”。在实体瘤的治疗中,适当补充牛磺酸反而可能有助于恢复T细胞功能,增强免疫系统的抗肿瘤能力。值得注意的是,牛磺酸也是很多功能饮料的常见成分,但本篇内容的重点并不是建议大家多喝功能饮料,而是强调“因人而异、因病制宜”。
对于没有牛磺酸代谢风险的普通人群来说,若想适度补充,不妨从天然饮食中寻找来源。鱼类、虾、蟹、贝类、畜禽肉、坚果和豆类等食物都富含牛磺酸,既美味又有营养。偶尔喝点功能饮料也无妨,但要记得控制频率,合理搭配膳食,维持整体营养的均衡才是健康的关键。
仍需指出的是,研究主要依赖特定数据库和小鼠模型,可能存在数据源和模型适用范围的局限,影响结论的全面性和广泛适用性。
参考资料:
[1]Sharma, S., Rodems, B.J., Baker, C.D.et al. Taurine from tumour niche drives glycolysis to promote leukaemogenesis. Nature (2025). https://doi.org/10.1038/s41586-025-09018-7
[2]Cao T, Zhang W, Wang Q, Wang C, Ma W, Zhang C, Ge M, Tian M, Yu J, Jiao A, Wang L, Liu M, Wang P, Guo Z, Zhou Y, Chen S, Yin W, Yi J, Guo H, Han H, Zhang B, Wu K, Fan D, Wang X, Nie Y, Lu Y, Zhao X. Cancer SLC6A6-mediated taurine uptake transactivates immune checkpoint genes and induces exhaustion in CD8+ T cells. Cell. 2024 Mar 28:S0092-8674(24)00303-9. doi: 10.1016/j.cell.2024.03.011. Epub ahead of print. PMID: 38565142.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#肿瘤微环境# #白血病干细胞# #牛磺酸#
23 举报