Hepatology:香港大学马桂宜提出基于DGKH介导的磷脂酸肿瘤代谢驱动肝细胞癌自我更新与治疗耐药性的分子机制
昨天 iNature iNature 发表于上海
该研究进行了加权基因共表达网络分析(WGCNA),发现其中一个模块与晚期病理分期及干细胞群体维持显著相关。
肝细胞癌(HCC)的特征是代谢通路异常,使癌细胞能够满足其能量需求并加速恶性进展。鉴定调控HCC治疗抵抗和自我更新的新型代谢关键因子至关重要,因为这些特性可能是肿瘤复发的根源。
2025年7月,香港大学马桂宜独立通讯在Hepatology在线发表题为“DGKH-mediated phosphatidic acid oncometabolism as a driver of self-renewal and therapy resistance in HCC”的研究论文。该研究进行了加权基因共表达网络分析(WGCNA),发现其中一个模块与晚期病理分期及干细胞群体维持显著相关。
通过整合HCC患者对酪氨酸激酶抑制剂无应答者的数据,进一步分析该模块,共鉴定出361个共同失调基因。值得注意的是,这些基因在细胞内信号转导通路中显著富集,其中二酰基甘油激酶η(DGKH)在低分化HCC肿瘤中富集程度最高。临床分析显示,与癌旁组织相比,DGKH在肿瘤组织中表达升高。DGKH高表达患者表现出更低分化状态,且对酪氨酸激酶抑制剂反应性更差。通过DGKH基因调控的HCC细胞系功能实验证实,DGKH可增强肿瘤的侵袭性特征,包括癌症干性、治疗抵抗和转移能力。在DGKH上游机制中,作者发现E1A结合蛋白p300(EP300)与DGKH启动子区域结合,从而增加其转录表达。从分子机制上看,DGKH通过产生磷脂酸促进mTOR信号通路活化。在免疫健全的小鼠模型中,索拉非尼联合肝脏定向AAV8介导的Dgkh敲降治疗显著降低了肿瘤负荷、自我更新能力、磷脂酸生成及mTOR信号通路活性。研究证明DGKH是调控癌症干性和治疗抵抗的关键肿瘤代谢因子,提示抑制DGKH可能成为更有效的HCC治疗策略。

肝癌是全球公共卫生的重大负担,2020年新增病例超过90万例,导致83万例死亡。全分期五年生存率约为20%,而区域性和远处转移性肝癌分别仅为12%和3%。令人担忧的是,肝癌发病率预计将持续上升。肝细胞癌(HCC)约占全球肝癌病例的75%,是最主要的亚型。酪氨酸激酶抑制剂(TKIs)如索拉非尼和仑伐替尼是晚期HCC一线治疗的关键药物。索拉非尼首次被证实具有临床获益,治疗组中位总生存期为10.7个月,显著优于安慰剂组的7.9个月。十年后,临床试验证实仑伐替尼在生存期和疾病控制率方面优于索拉非尼。然而,部分患者对TKI治疗存在原发性耐药:仑伐替尼组为17%,索拉非尼组达32%,这凸显了解决这一临床未满足需求的重要性。
解析TKI耐药机制需要深入探究肿瘤的复杂生物学特性。根据最新修订的"癌症特征"理论框架,TKI耐药患者的肿瘤通常表现为不受控的增殖能力和分化程序受损[9]。研究表明,具有增强干性特征的HCC细胞对TKI治疗更具抵抗能力。这种异常的信号传导和未分化状态至少部分源于代谢重编程。肝脏作为代谢中枢,通过调控碳水化合物、蛋白质和脂质代谢维持机体稳态,其代谢紊乱可能驱动HCC进展。因此,探究参与TKI耐药和肿瘤干性的代谢调控因子具有重要意义。
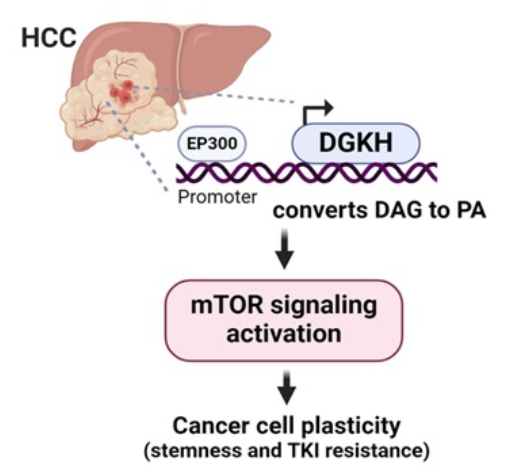
模式机理图(图片源自Hepatology )
二酰基甘油激酶(DGKs)是一类ATP依赖性酶家族,可催化二酰基甘油磷酸化生成磷脂酸(PA)。PA作为磷脂代谢的核心分子和致癌代谢物,调控多种致癌信号通路。DGK家族多个成员已被证实促进肿瘤进展,其中DGKA在胶质母细胞瘤、黑色素瘤、胰腺癌和卵巢癌等恶性肿瘤中作用最为广泛。在HCC中,DGKA和DGKG分别发挥促癌和抑癌作用。相比之下,二酰基甘油激酶η(DGKH)的研究较为欠缺。早期研究发现DGKH通过增强表皮生长因子(EGF)诱导的ERK信号通路促进癌细胞增殖,敲除DGKH可增强肺癌细胞对EGFR抑制剂的敏感性。然而,DGKH在HCC中的作用仍需进一步探究。
原文链接:
https://doi.org/10.1097/HEP.0000000000001158
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#肝细胞癌# #磷脂酸#
2 举报