Cancer Cell:秦骏/梁朝朝/袁怀瑞/董樑团队揭示双阴性前列腺癌耐药新机制
2025-04-28 iNature iNature 发表于陕西省
该研究发现KMT2C突变或缺失的肿瘤非常容易在ADT后转变为DNPC。
以雄激素受体(AR)和神经内分泌表型为特征的双阴性前列腺癌(DNPC)经常在雄激素剥夺治疗(ADT)后出现。然而,对DNPC的起源和调控机制的了解仍然有限。
2025年4月24日,中国科学院上海营养与健康研究所秦骏、安徽医科大学梁朝朝、中国科学院分子细胞科学卓越创新中心袁怀瑞、上海交通大学董樑共同通讯在Cancer Cell(IF=48.8)在线发表题为“KMT2C deficiency drives transdifferentiation of double-negative prostate cancer and confer resistance to AR-targeted therapy”的研究论文,该研究发现KMT2C突变或缺失的肿瘤非常容易在ADT后转变为DNPC。
该研究阐明DNPC主要来源于管腔细胞转分化,而不是基底细胞转化。抗雄激素治疗诱导KMT2C结合AR调节基因子集的增强子,保留腺癌谱系。KMT2C通过AR抑制后的增强子-启动子通讯维持ASPP2表达,而其失活减少ASPP2,触发Np63依赖的转分化。这种DNPC转换通过Np63介导的SREBP1c反式激活维持脂肪酸(FA)合成,通过HRAS棕榈酰化和MAPK信号激活促进DNPC生长。这些发现强调了KMT2C是DNPC发展的表观遗传学检查点,并表明了靶向脂肪酸合成的治疗潜力。

雄激素剥夺疗法(ADT)是晚期和转移性前列腺癌(PCa)的主要治疗方法。但是,在一种称为去势抵抗性前列腺癌(CRPC)的常见转移性疾病中,肿瘤经常复发。CRPC通常保留腺癌组织学(CRPC腺)并继续依赖雄激素受体(AR)信号传导。因此,开发了第二代AR抑制剂,包括恩扎卢他胺(ENZ)和阿比特龙(ABI),以更有效地靶向AR信号传导。但是,它们的有效性受到谱系可塑性的影响。 这导致独立于AR的生存机制的发展。在许多情况下,CRPC表现出雄激素无关的表型。这些AR或AR-low肿瘤表现出不同的可塑性,正如它们发展为神经内分泌前列腺癌(NEPC)所证明的。缺乏AR表达和NE分化的其他肿瘤被归类为双阴性PCa(DNPC)。DNPC占转移性CRPC病例的10%-25%,尤其是在用第二代AR抑制剂治疗后,并且与不良预后相关。
DNPC以其独特的基底/干细胞转录组为特征,表现为基因的异位表达,如KRT5、KRT6A、TP63和DSG3。这些肿瘤由具有固有可塑性的细胞组成,能够转变为鳞状样肿瘤。研究表明成纤维细胞生长因子(FGF)、表皮生长因子(EGF)和丝裂原活化蛋白激酶(MAPK)/信号调节激酶(ERK)通路细胞外活性增加允许DNPC茁壮成长。此外,多梳抑制物复合物1 (PRC-1)通过协调干细胞和免疫抑制促进DNPC转移。然而,从腺癌到DNPC的线性转变仍然是假设的,没有明确的证据确定其来源是管腔细胞还是基底细胞。因此,DNPC的转换机制和分子依赖性仍然不清楚。尽管起源于不同的组织,肺鳞癌(LUSC)和DNPC通常具有相似的转录组变化。Trp63产生两种亚型:ΔNp63,主要表达于上皮细胞,已知促进癌症进展,和TAp63,较少表达,与肿瘤抑制功能相关。ΔNp63驱动鳞状分化重编程,对LUSC的生长至关重要。YAP和ASPP2(由TP53BP2编码)抑制ΔNp63转录。
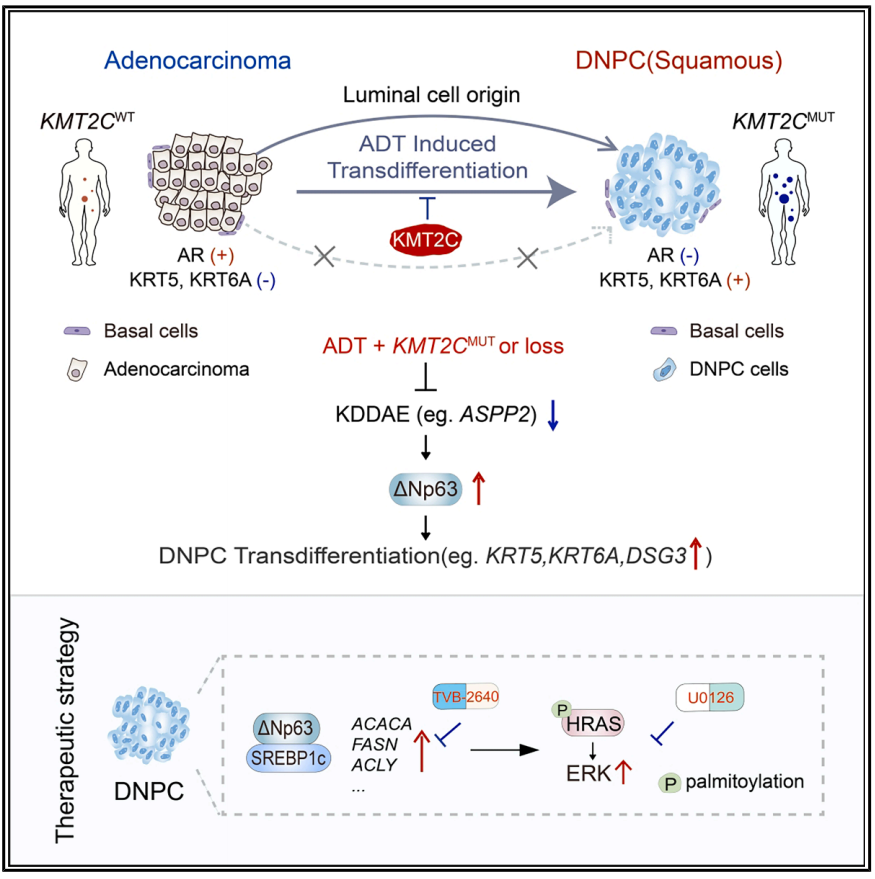
机理模式图(图源自Cancer Cell)
在此,研究人员发现,携带KMT2C基因突变或缺失的肿瘤在接受雄激素剥夺治疗(ADT)后,极易转变为双阴性前列腺癌(DNPC)。该研究进一步确定,DNPC 主要源于管腔细胞的转分化,而非基底细胞的转化。抗雄激素治疗促使 KMT2C 与部分受 AR 调控基因的增强子结合,从而维持腺癌细胞谱系。KMT2C 通过增强子-启动子通讯在雄激素受体抑制后维持 ASPP2 的表达,而其失活会降低 ASPP2 水平,从而引发 ΔNp63 依赖性转分化。这种 DNPC 转化通过 ΔNp63 介导的 SREBP1c 转录激活维持脂肪酸(FA)合成,通过 HRAS 棕榈酰化修饰和 MAPK 信号激活为 DNPC 生长提供能量。
参考信息:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00139-4#au23
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#雄激素剥夺治疗# #双阴性前列腺癌#
23 举报