南开大学AFM:糖尿病慢性伤口生物膜感染的pH响应型表面电荷转换纳米系统与抗生素协同治疗
2025-01-02 BioMed科技 BioMed科技 发表于陕西省
南开大学朱春雷提出了一种新的治疗策略,即使用pH响应性纳米粒子装载聚集诱导发射光敏剂和天然饱和脂肪酸(AIE/LA@HMONs−PyB),以实现有效的生物膜穿透和破坏。
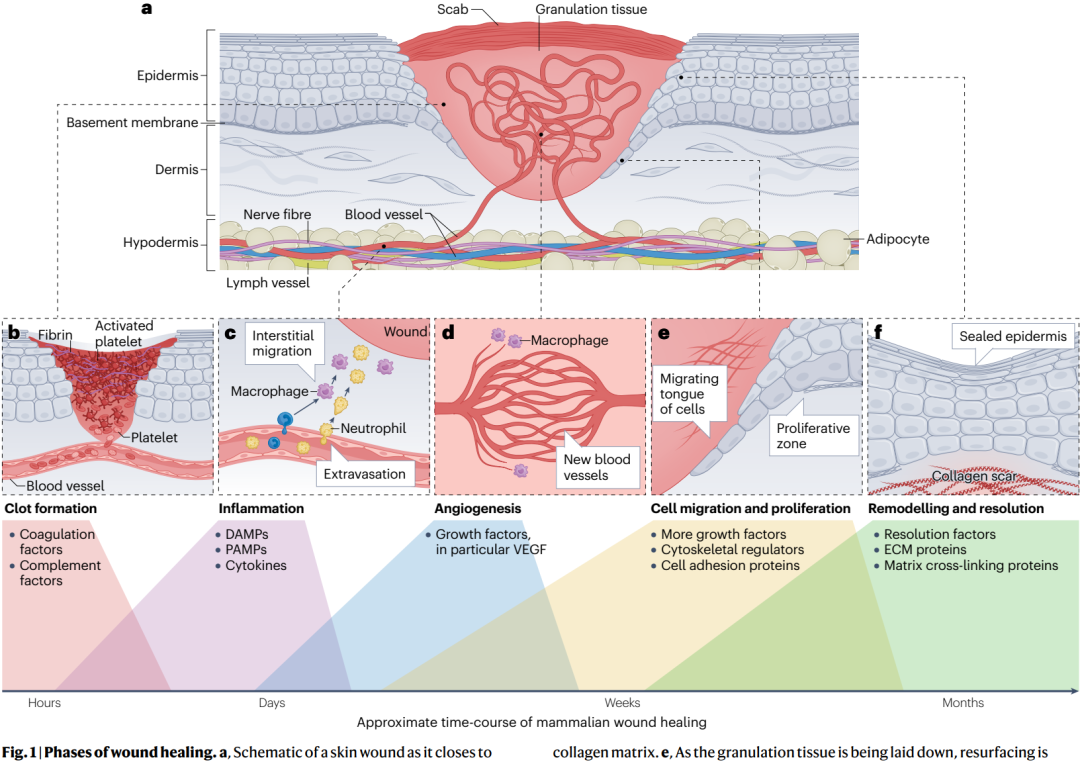
慢性伤口,特别是与糖尿病相关的伤口,由于其发展生物膜的倾向,对传统抗生素治疗产生抗性,构成了重大的临床挑战。为了解决这一问题,南开大学朱春雷提出了一种新的治疗策略,即使用pH响应性纳米粒子装载聚集诱导发射光敏剂和天然饱和脂肪酸(AIE/LA@HMONs−PyB),以实现有效的生物膜穿透和破坏。在生理条件下,AIE/LA@HMONs−PyB带有负电荷。然而,在感染部位积累时,AIE/LA@HMONs−PyB表面的吡啶甜菜碱基团能够在酸性生物膜微环境中迅速质子化并发生电荷反转,从而增强其穿透生物膜的能力。在光照射下,这些纳米粒子产生活性氧,有效破坏生物膜结构。这一过程使得环丙沙星在较低浓度下发挥协同作用,实现了对耐甲氧西林金黄色葡萄球菌(S. aureus)生物膜99.99%的体外抗菌效率。此外,在糖尿病伤口模型中,这种协同疗法通过减少炎症、促进血管生成和增强胶原蛋白再生,加速了伤口愈合。增强的穿透策略显著提高了这种联合方法的治疗效率,为推进慢性伤口愈合和提高患者预后提供了巨大希望。该研究以题为“A pH-Responsive, Surface Charge-Switchable Nanosystem with Enhanced Biofilm Penetration for Synergistic Photodynamic and Antibiotic Therapy of Diabetic Wounds”的论文发表在《Advanced Functional Materials》上。

方案 1展示了一种pH响应的、表面电荷可转换的纳米系统(AIE/LA@HMONs−PyB)的工作机制,该系统旨在增强对细菌生物膜的穿透能力并有效根除细菌。在生理条件下,该纳米系统带有负电荷,但在生物膜的酸性环境中,其表面的吡啶甜菜碱基团会迅速质子化并发生电荷反转,从而增强穿透生物膜的能力。在光照射下,这些纳米粒子能够产生活性氧种,有效破坏生物膜结构,进而使得抗生素(如环丙沙星)在较低浓度下就能发挥协同作用,显著提高对耐甲氧西林金黄色葡萄球菌(MRSA)生物膜的抗菌效率。这一策略不仅提高了治疗效果,还减少了抗生素的使用量,有助于减缓抗生素耐药性的发展,为糖尿病慢性伤口的治疗提供了一种新的有效方法。

方案1. pH响应的表面电荷可转换纳米系统用于根除细菌生物膜的示意图
【TPAI的物理化学性质】
图1展示了光敏剂TPAI的物理化学性质和光动力治疗(PDT)效应,包括TPAI的化学结构、紫外-可见光谱、不同甲苯分数的DMSO溶液中的荧光发射强度变化、能级图以及前线分子轨道(FMOs)和能量间隙。结果表明TPAI在620纳米处有一个显著的吸收峰,并且随着甲苯分数的增加,其荧光发射强度增强了约150倍,显示出典型的聚集诱导发射(AIE)特性。此外,TPAI具有小的单重态-三重态能量间隙,有利于光敏化过程中的有效系间穿越,且其最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)的能量分布表明在光激发时能有效分离电荷。这些结论证实了TPAI作为光敏剂在光动力治疗中的潜力,特别是在深层组织光穿透和活性氧种产生方面的优势。

图1. TPAI的物理化学性质
【纳米粒子的物理化学性质表征】
图2展示了AIE/LA@HMONs纳米粒子的物理化学特性。实验结果揭示了纳米粒子具有空心球形结构,粒径在60至120纳米之间,且具有良好的水分散性和储存稳定性。特别是,AIE/LA@HMONs−PyB纳米粒子在酸性条件下能迅速质子化并发生电荷反转,有效增强了穿透生物膜的能力。此外,AIE/LA@HMONs纳米粒子主要产生I型ROS,在光照射下表现出显著的光动力效应,这表明它们在光动力治疗中具有潜在的应用价值,尤其是在增强光敏剂的光动力效应和提高对生物膜的穿透性方面。

图2. 纳米粒子的物理化学性质表征
【AIE/LA@HMONs在不同pH条件下的电荷反转及其生物膜穿透能力】
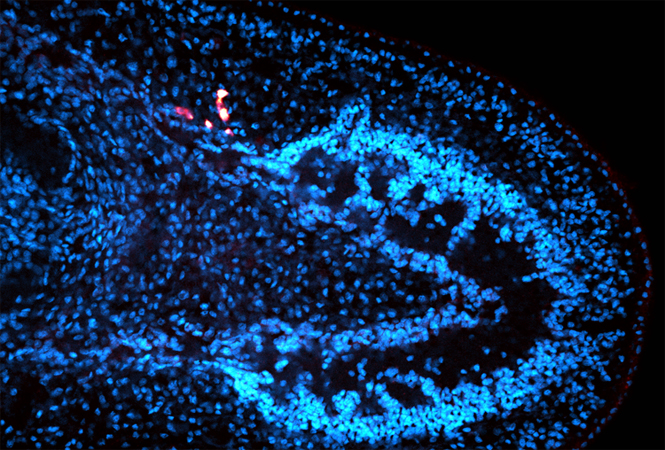
图3探讨了AIE/LA@HMONs纳米粒子在不同pH条件下的电荷反转特性及其在生物膜中的穿透能力。通过zeta电位分析,研究发现AIE/LA@HMONs−PyB纳米粒子在酸性环境下能迅速从负电荷转变为正电荷,这一快速的电荷反转特性对于生物膜的穿透至关重要。共聚焦激光扫描显微镜(CLSM)图像显示,AIE/LA@HMONs−PyB纳米粒子在生物膜中的分布随时间增加而增强,表明其具有较好的生物膜穿透和积累能力,特别是在酸性条件下能迅速变为正电荷,从而促进了对生物膜的深入穿透和更强的粘附。这些结果强调了AIE/LA@HMONs−PyB纳米粒子在提高生物膜穿透策略中的潜力,为开发有效的抗生物膜治疗策略提供了新的方向。

图3. AIE/LA@HMONs在不同pH条件下的电荷反转及其生物膜穿透能力
【用AIE/LA@HMONs有和没有激光辐照体外根除MRSA生物膜】
图4展示了AIE/LA@HMONs纳米粒子在有无激光辐照条件下对MRSA生物膜的体外根除效果。实验结果表明,在没有激光辐照的情况下,所有组别均未显示出显著的杀菌活性;而在接受激光辐照后,特别是AIE/LA@HMONs−PyB组,显示出高达99%的杀菌效率,远高于其他组别。通过扫描电子显微镜(SEM)和共聚焦激光扫描显微镜(CLSM)的观察,进一步证实了AIE/LA@HMONs−PyB组在激光辐照后能显著破坏生物膜的结构,减少生物膜厚度,并导致生物膜结构的瓦解。此外,通过结晶紫(CV)染色评估的生物膜生物量也显示,AIE/LA@HMONs−PyB组在激光辐照后具有最低的生物膜生物量,证实了其卓越的生物膜根除能力。这些结论强调了AIE/LA@HMONs−PyB纳米粒子结合光动力治疗在根除MRSA生物膜感染中的潜力和效率。结果表明LA@PHT-PHT-Ca2+纳米酶能够有效穿透血脑屏障,为癫痫治疗提供了一种潜在的药物载体。

图4. 用AIE/LA@HMONs有和没有激光辐照体外根除MRSA生物膜
【通过结合PDT和抗生素治疗体外根除MRSA生物膜】
图5展示了AIE/LA@HMONs−PyB纳米粒子与环丙沙星(CIP)联合治疗MRSA生物膜的体外根除效果。通过协同效应检查板分析显示,联合治疗表现出协同作用,其中环丙沙星的浓度仅为其最小抑制浓度(MIC)的四分之一。实验结果表明,联合治疗实现了高达99.99%的抗菌效率,显著高于单独使用光动力治疗(PDT)或抗生素治疗。扫描电子显微镜(SEM)和共聚焦激光扫描显微镜(CLSM)图像进一步证实了联合治疗后生物膜结构的破坏和细菌的杀灭。结晶紫(CV)染色结果也显示,联合治疗组的生物膜生物量显著减少,表明联合治疗能有效地根除MRSA生物膜。综上所述,证实了AIE/LA@HMONs−PyB纳米粒子与环丙沙星联合治疗在体外对MRSA生物膜具有卓越的根除效果,为临床治疗提供了一种有效的抗生物膜感染新策略。

图5. 通过结合PDT和抗生素治疗体外根除MRSA生物膜
【MRSA生物膜在不同处理下的转录组测序分析】
图6通过转录组测序分析探讨了光动力治疗(PDT)和环丙沙星(CIP)联合作用对MRSA生物膜的影响机制。分析发现,与未处理的对照组相比,经PDT和CIP处理的MRSA生物膜中有283个差异表达基因(DEGs),其中129个基因下调,154个基因上调。热图分析显示,与氧化应激、DNA合成和细菌膜相关的基因表达发生了显著变化,包括氧化应激响应基因的上调和DNA复制相关基因的下调,反映出PDT诱导的活性氧(ROS)激活了应激途径,而CIP抑制了细菌DNA旋转酶。此外,GO和KEGG通路富集分析表明,联合治疗显著影响了与DNA合成、氧化应激响应和代谢过程相关的途径,如五碳糖磷酸途径和氧化磷酸化,这些途径对维持细胞氧化还原平衡和能量产生至关重要。同时,代谢途径如甘油脂代谢和组氨酸代谢受到干扰,表明治疗后生物膜的代谢功能减弱,而群体感应途径的变化也突显了PDT和CIP联合作用对生物膜形成和调控的影响。这些结论揭示了PDT和抗生素联合治疗在分子层面上对MRSA生物膜的破坏机制,证实了联合治疗策略在根除生物膜感染中的潜在效果。

图6. MRSA生物膜在不同处理下的转录组测序分析
【MRSA感染糖尿病小鼠的体内抗菌行为】
图7展示了在MRSA感染的糖尿病小鼠模型中,结合光动力治疗(PDT)和环丙沙星(CIP)的联合治疗策略的体内抗菌效果。实验中,通过监测不同治疗组小鼠的伤口愈合情况、体重变化以及存活率,发现AIE + CIP/L组(即接受了PDT和CIP联合治疗并结合激光辐照的组)的小鼠伤口愈合速度最快,体重恢复也最为迅速,且存活率最高。此外,通过细菌活性的定量分析和细菌菌落的观察,AIE + CIP/L组显示出了显著的细菌减少,证实了联合治疗策略在降低感染、促进伤口愈合方面的优越效果。这些结论表明,PDT和CIP的联合治疗在体内对MRSA感染的糖尿病伤口具有显著的治疗效果,能够加速伤口愈合过程,减少感染,并提高小鼠的生存率。

图7. MRSA感染糖尿病小鼠的体内抗菌行为
【不同处理后感染伤口组织的组织学分析】
图8通过组织学分析评估了不同治疗策略对MRSA感染糖尿病小鼠伤口组织的影响。H&E染色和Masson三色染色显示,与对照组相比,AIE + CIP/L组(即接受了光动力治疗和环丙沙星联合治疗并结合激光辐照的组)展现出更明显的炎症细胞减少、新毛囊生成和表皮层变薄,表明该组伤口愈合效果最佳。此外,免疫荧光和免疫组化染色用于评估伤口区域的炎症因子、血管生成和胶原蛋白再生情况,结果显示AIE + CIP/L组在降低炎症因子TNF-α和IL-6、增强CD31表达(血管生成标志物)以及促进COL I和COL III(胶原蛋白类型I和III)再生方面均表现最佳,这些结果表明联合治疗策略不仅有效减轻了炎症,还通过促进血管生成和胶原蛋白再生显著加速了伤口愈合过程。综合这些结论证实了光动力治疗和抗生素联合治疗在促进糖尿病小鼠MRSA感染伤口愈合中的潜在疗效和生物安全性。

图8. 不同处理后感染伤口组织的组织学分析
【小结】
该论文开发了一种pH响应型、表面电荷可转换的光动力纳米系统,并将其与抗生素治疗相结合,用于治疗与生物膜感染相关的慢性伤口。该系统通过在生物膜的酸性微环境中快速质子化,实现表面电荷的正负转换,显著增强了生物膜的穿透和粘附能力。光照射下,该系统产生的活性氧有效破坏了耐甲氧西林金黄色葡萄球菌(MRSA)生物膜的三维结构,使得抗生素(如环丙沙星)能够在更低浓度下渗透并灭活细菌,从而产生协同的抗生物膜效果。体外实验显示,这种光动力治疗和抗生素联合疗法对MRSA生物膜展现出了99.99%的抗菌效率。此外,将这种联合策略应用于MRSA生物膜感染的糖尿病伤口,显著加速了伤口愈合过程,通过减少炎症、促进血管生成和增强胶原再生。这项研究提供了一种新的纳米系统,对于有效治疗慢性生物膜感染性伤口具有重要的潜力,其创新性地将表面电荷可转换的纳米粒子与光动力治疗和抗生素相结合,不仅应对了紧迫的临床挑战,也为抗菌治疗的新范式奠定了基础,这种策略在克服生物膜相关感染和改善慢性伤口管理的治疗结果方面展现出了希望。
原文链接:
https://doi.org/10.1002/adfm.202418711
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#慢性伤口# #光动力治疗#
45 举报