EGFR突变肺腺癌发生鳞状细胞癌转化,连续基因检测发现FGFR1/NSD3扩增,或为转化驱动基因
2025-07-19 苏州绘真医学 苏州绘真医学 发表于上海
本病例报告重点描述了在多次活检标本中观察到的基因变异,并对相关文献进行了综述。
肺腺癌向小细胞肺癌的组织学转化是肺癌中公认的耐药机制。然而,向鳞状细胞癌的转化较为少见,且相关基因组改变尚不清楚。本文报告一例携带表皮生长因子受体(EGFR)突变的肺腺癌转化为鳞状细胞癌的病例。在整个转化过程中均检测到EGFR L858R突变,在疾病进展过程中进行的基因检测显示,成纤维细胞生长因子受体1(FGFR1)和核受体结合SET结构域蛋白3(NSD3)存在扩增,这两种基因最近被认为是肺鳞状细胞癌中潜在的驱动基因。本病例报告重点描述了在多次活检标本中观察到的基因变异,并对相关文献进行了综述。
背 景
表皮生长因子受体(EGFR)突变是肺腺癌的关键驱动因素,在东亚人群中尤为常见。尽管EGFR酪氨酸激酶抑制剂(TKIs)初始疗效显著,但由于多种机制,耐药性通常在1-2年内出现。在这些机制中,组织学转化是EGFR TKIs公认的耐药机制之一。转化为小细胞肺癌最为常见(67%),而转化为鳞状细胞肺癌也有报道,尽管发生率较低(15%),且其机制仍知之甚少。本文描述了一个病例,该病例在疾病过程中获取了多个临床标本,研究人员能够检测转化前后的基因组改变。值得注意的是,研究人员发现了成纤维细胞生长因子受体1(FGFR1)和核受体结合SET结构域蛋白3(NSD3)的扩增,这两种基因最近被认为是肺鳞状细胞癌中潜在的驱动致癌基因。这些发现连同肿瘤特征,为肺腺癌向肺鳞状细胞癌的转化提供了见解。
病 例
患者男,66 岁,无明显既往病史或家族病史,有8包年吸烟史,于2018年6月因咳嗽就诊。计算机断层扫描(CT)显示右中叶有一肿瘤,CT引导下活检证实为肺腺癌伴胸膜转移。肿瘤分期为cT3N0M1a(IVa期),通过Cobas EGFR突变检测发现EGFR L858R突变(图1A)。患者接受一线阿法替尼治疗,原发性肿瘤缩小,达到部分缓解。2021 年 6 月,因原发性肿瘤增大,在原发灶进行第二次CT引导下活检。病理分析证实为肺腺癌(图1B),EGFR突变检测同时检出L858R和T790M突变。因此,启动二线奥希替尼治疗。约 10 个月后,原发性肿瘤进一步增大,提示疾病进展(PD)。2022 年 3 月,同一部位第三次CT引导下活检,组织学检查显示腺癌伴异型性增加(图1C)。对第三份活检样本进行下一代测序(NGS),结果显示EGFR L858R突变阳性,但T790M阴性。随后,患者开始三线治疗,包括卡铂、培美曲塞和贝伐珠单抗。2022 年 11 月的肿瘤评估显示原发灶增大,证实PD,治疗改为多西他赛联合雷莫芦单抗作为四线治疗。由于四线治疗期间原发灶迅速增大,研究人员怀疑肿瘤组织学转化。2023 年 3 月,支气管镜重复活检证实转化为鳞状细胞癌(图1D)。对该组织再次采用NGS检测,显示NSD3和FGFR1扩增,而此前NGS检测未检出这些变异(表1)。第一和第二次活检样本仅进行了基于PCR的EGFR检测,未评估这些变异。对原发肿瘤进行放疗(60 Gy/30 Fr),随后给予五线卡铂联合替吉奥治疗。然而,约两个月后,尽管先前发现的转移灶仍局限于胸膜腔,但在颈后皮下区、左腋窝淋巴结和降结肠发现新的转移灶。2023 年 9 月,因存在穿孔风险,手术切除降结肠肿瘤。病理分析证实为鳞状细胞癌,诊断为转移性肺癌(图1E)。对此次组织再次进行NGS检测,仍显示NSD3和FGFR1扩增(图2)。2023 年 10 月,启动吉西他滨作为六线治疗,随后分别以阿法替尼再挑战和长春瑞滨作为七线和八线治疗。但肿瘤进展未能控制,患者于 2024 年 7 月死亡。尸检显示,原发灶主要由鳞状细胞癌组成,但也发现少量腺癌成分。大多数转移灶为鳞状细胞癌且位于胸腔外,而大多数腺癌转移灶则局限于胸腔内。
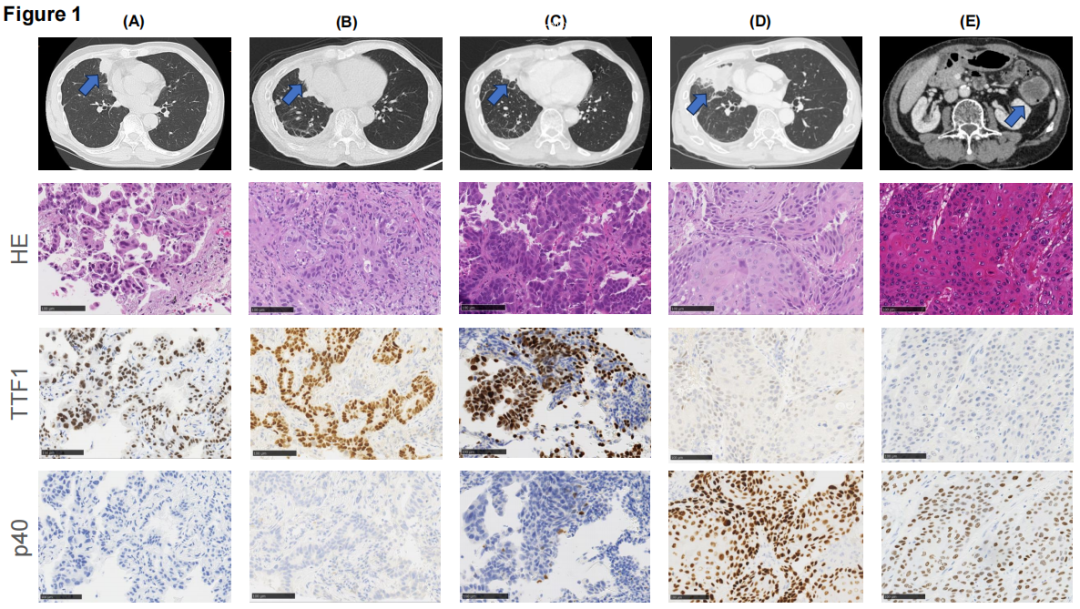
▲图1
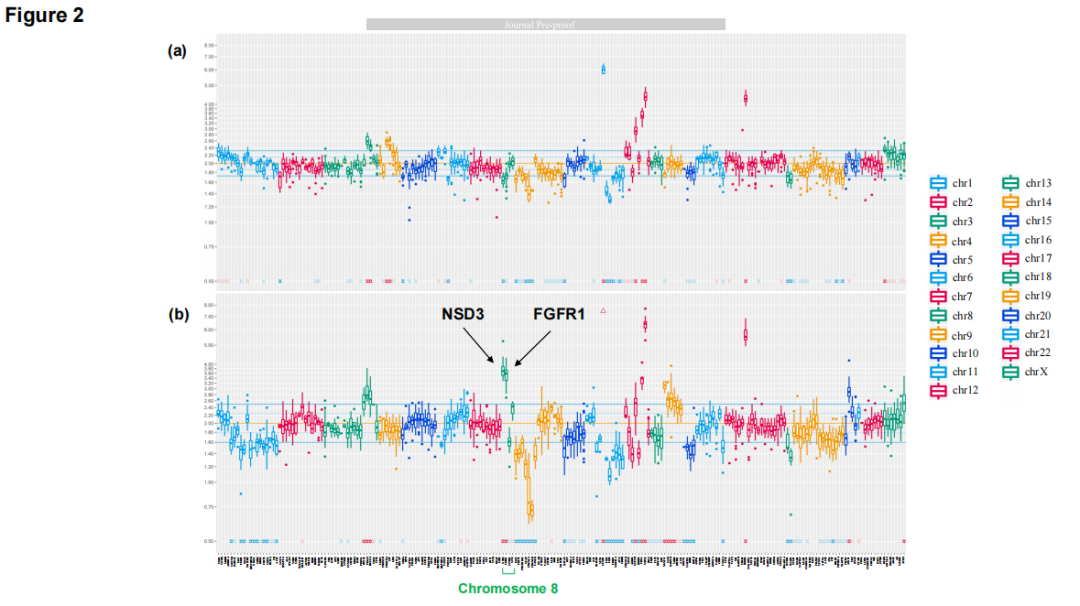
▲图2
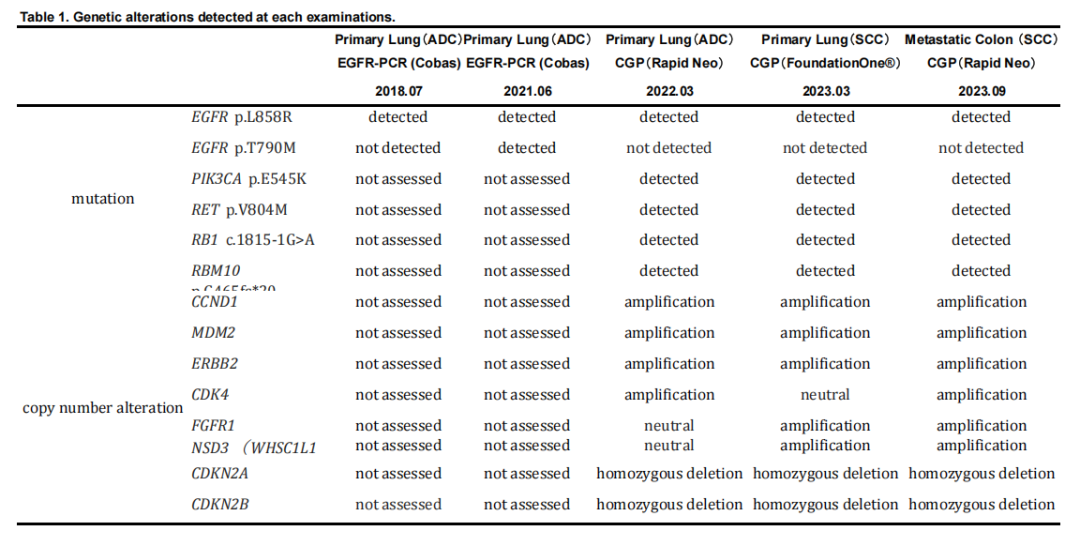
▲表1 每次检测中检出的基因变异
讨 论
与肺腺癌向小细胞癌转化的报道相比,有关向鳞状细胞癌转化前后基因组信息的报道仍然有限。PI3K/AKT/mTOR通路的改变以及最近发现的NSD3扩增已被确定为向鳞状细胞癌转化的主要驱动因素。在临床实践中,反复进行基因检测面临着重大挑战。据研究人员所知,这是首次在转化后标本中发现FGFR1和NSD3扩增的病例报告,强调了它们在肺鳞状细胞癌转化中的潜在作用。还应考虑多线治疗对肿瘤微环境的影响,因为治疗压力可能导致观察到的基因和组织学发送变化,潜在地驱动转化过程。此外,EGFR L858R突变的持续检出表明,本病例代表组织学转化而非新发鳞状细胞癌。本病例研究的一个局限性是,由于保险覆盖范围和样本质量的限制,每次活检使用了不同的基因检测平台。此外,初始活检样本未进行多基因检测,这可能妨碍了相关基因变异的尽早检出。积累此类病例将阐明鳞状细胞癌的转化机制,并改善肺癌的个性化治疗。
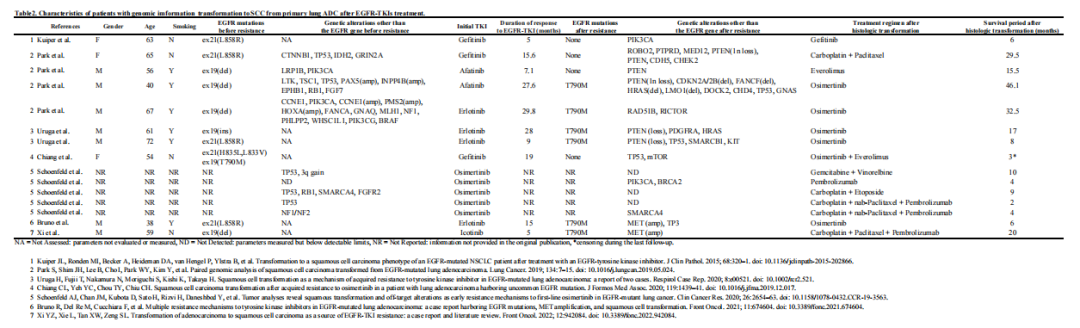
▲表2 EGFR-TKI治疗后原发性肺腺癌转化至SCC患者的基因特征
总之,本文报告一例EGFR突变阳性肺腺癌转化为鳞状细胞癌的病例。重复活检和基因检测揭示了肿瘤内基因和组织学改变,这些改变可能导致了肿瘤发生转化。再活检时的测序为转化和癌症进展的潜在机制提供了有价值的见解。
我司实体瘤全外显子组基因检测、实体瘤1299基因检测(NGS方法学),均涵盖了EGFR、FGFR1、NSD3基因,预测可能获益的靶向、免疫及化疗药物,评估肿瘤遗传风险。
参考文献:
Fukunaga N, Terai H, Nomura R, Kurebayashi Y, Nakamura K, Kawano R, Shigeta K, Okabayashi K, Kinoshita K, Ogata A, Shigematsu L, Ito F, Takaoka H, Fukushima T, Nukaga S, Ohgino K, Yasuda H, Nishihara H, Kitagawa Y, Fukunaga K, Acquisition of FGFR1 and NSD3 Amplifications During the Transformation of EGFR-Mutated Lung Adenocarcinoma into Squamous Cell Carcinoma: A Case Report, JTO Clinical and Research Reports (2025), doi: https://doi.org/10.1016/ j.jtocrr.2025.100862.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肺腺癌# #EGFR突变#
6 举报