JCO:新药对肺癌、乳腺癌等多种实体瘤均有效!30%患者肿瘤部分消失,效果维持近13个月
2025-03-06 医学新视点 医学新视点 发表于陕西省
在研药物宗格替尼是口服 HER2 特异性酪氨酸激酶抑制剂,1a 期试验显示其治疗 HER2 突变实体瘤有初步疗效且安全性可控,上市申请已获 CDE 受理并被优先审评。
多种恶性肿瘤均可发生人表皮生长因子受体2(HER2)突变,如乳腺癌、胃癌、肺癌等。靶向HER2药物的出现改变了部分肿瘤患者的临床治疗现状,特别是乳腺癌和胃癌,但原发性和获得性耐药是当前治疗面临的重要挑战。非小细胞肺癌(NSCLC)中,约2%~5%为HER2突变型NSCLC,这部分患者易发生脑转移、治疗困难、预后差。目前,仅有一款抗体-药物偶联物(ADC)——德曲妥珠单抗(trastuzumab deruxtecan)获批用于治疗既往接受过系统性治疗的HER2突变型NSCLC,患者的治疗选择比较有限。因此,对于NSCLC及其他实体瘤患者而言,仍需要有更多靶向HER2的新药。
宗格替尼(zongertinib)是一款在研的口服HER2特异性酪氨酸激酶抑制剂(TKI),可选择性抑制HER2并规避EGFR,能够在降低脱靶毒性的同时,保持抗肿瘤活性。
近日,美国临床肿瘤学会(ASCO)旗下《临床肿瘤学杂志》(Journal of Clinical Oncology)发表Beamion LUNG-1的研究结果表明,对于HER2突变的实体瘤(包括HER2突变型NSCLC)患者,使用宗格替尼可获得良好的抗肿瘤活性,客观缓解率(ORR)为30%、中位持续缓解时间(DoR)为12.7个月,安全性可控。

截图来源:Journal of Clinical Oncology
Beamion LUNG-1的1a期临床试验在全球7家医学中心开展,旨在评估每日一次(60~360 mg)或每日两次(15~150 mg)、口服给药、剂量递增的宗格替尼用药安全性、耐受性和初步疗效。研究纳入经组织学或细胞学确诊HER2突变晚期、不可切除和/或转移性实体瘤、标准治疗失败或无法耐受的成人患者105例。所有患者中位年龄60岁、基线时27例(26%)存在脑转移、54例(51%)为NSCLC,14例(14%)为结直肠癌,12例(11%)为乳腺癌、既往中位治疗线数为4线。
研究主要终点为最大耐受剂量(MTD)和剂量限制性毒性(DLT)。结果显示,有2例患者在MTD评估期间发生DLT,分别为使用240 mg和360 mg宗格替尼(每日一次)后发生3级腹泻和3级血小板计数降低。整体而言,目前在两组患者中未观察到最大耐受剂量。
所有可评估的患者中,32例确认存在客观缓解(均为部分缓解),整体ORR为30%(95%CI:23%~40%),其中NSCLC(19例)、乳腺癌(4例)、结直肠癌(2例)、宫颈癌(2例)、以及外阴癌、胃肠道癌、食管癌、卵巢癌和胆道癌患者各1例。其他指标如下:
-
疾病控制率(DCR):83%(95%CI:75%~89%);
-
中位DoR:12.7个月(95%CI:6.9个月~不可评估);
-
中位疾病持续控制时间:8.4个月(95%CI:6.9个月~13.8个月);
-
中位无进展生存期(PFS):接受每日一次和每日两次宗格替尼治疗的患者,中位PFS分别为8.3个月(95%CI:5.5个月~13.8个月)和8.0个月(95%CI:2.8个月~不可评估)。
数据截止时,32例确认客观缓解和13例未确认客观缓解的患者中,分别有23例和5例仍在接受治疗。
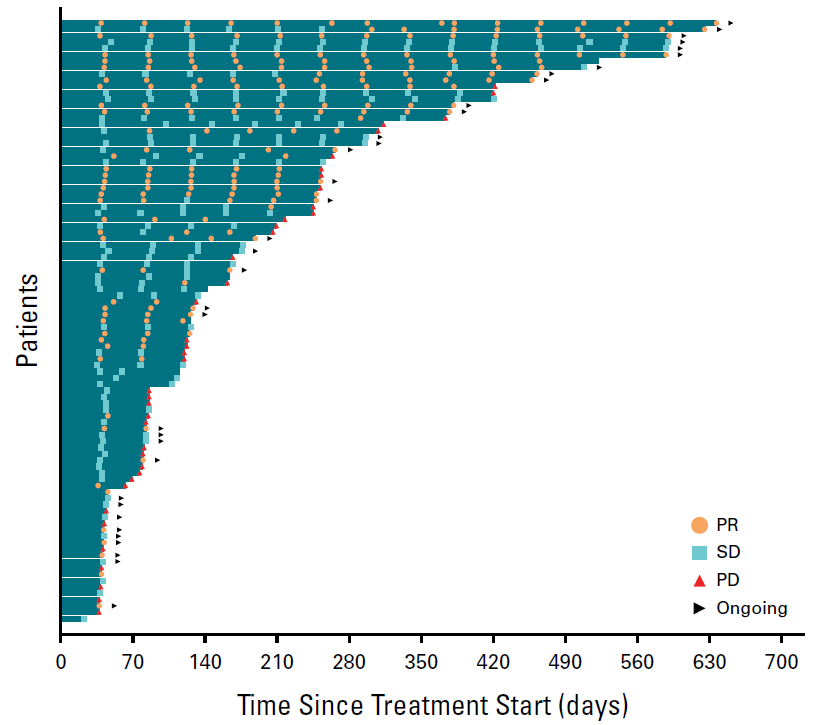
▲持续治疗时间和患者缓解情况评估的泳道图(图片来源:参考文献[1])
仅在NSCLC患者中,相关指标如下:
-
ORR:19例患者确认存在客观缓解(均为部分缓解),ORR为35.2%(95%CI:24%~49%);
-
DCR:93%(95%CI:82%~97%);
-
中位DoR:尚不能确定;
-
中位疾病持续控制时间:17.2个月(95%CI:8.4个月~不可评估);
-
中位PFS:接受每日一次和每日两次宗格替尼治疗的NSCLC患者,中位PFS分别为17.2个月(95%CI:8.3个月~不可评估)和8.7个月(95%CI:2.3个月~13.8个月)。
数据截止时,19例NSCLC确认存在客观缓解的患者中,仍有13例正在接受治疗。
安全性方面,100例(95%)患者报告了治疗后不良事件(TEAEs),其中分别有32例(30%)、2例(2%)和11例(10%)患者发生3级、4级和5级不良事件。32例(30%)、12例(11%)和3例(3%)患者因不良事件中断、减少和停止用药。86例(82%)患者报告了治疗相关不良事件(TRAEs),主要为腹泻、皮疹和贫血,多为1级或2级,仅有3例患者发生了3级治疗相关不良事件。结合其他靶向HER2药物不良反应数据来看,初步数据提示宗格替尼安全可控。
总之,本次1a期试验结果表明,宗格替尼在HER2突变实体瘤(包括HER2突变型NSCLC)治疗中展现出初步的疗效和耐受性特征。文章表示,该研究的1b期试验正在进行中,旨在评估宗格替尼在HER2突变型NSCLC患者中扩展的推荐剂量。
据中国国家药监局药品审评中心(CDE)官网显示,宗格替尼上市申请已经获得受理。此前,宗格替尼被CDE正式纳入优先审评,适应证为治疗携带HER2激活突变且既往接受过系统治疗的不可切除或转移性NSCLC成人患者。
参考资料
[1] John V. Heymach et al., HER2-Selective Tyrosine Kinase Inhibitor, Zongertinib (BI 1810631), in Patients With Advanced/Metastatic Solid Tumors With HER2 Alterations: A Phase Ia Dose-Escalation Study. JCO 0, JCO-24-01727
DOI:10.1200/JCO-24-01727
[2]中国国家药监局药品审评中心(CDE)网站.Retrieved Jan 15,2025, From https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[3]在研肺癌创新药zongertinib在华成功递交上市许可申请.Retrieved Jan 15,2025, From https://mp.weixin.qq.com/s/kTc0g95y9lAnBWpr7LLcrQ
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#非小细胞肺癌# #宗格替尼#
43 举报
人表皮生长因子受体突变恶性肿瘤治疗
27 举报