Nature Cancer:致癌microRNA和受体配体相互作用塑造了胚胎肿瘤细胞的层级结构
2025-06-28 儿童肿瘤前沿 MedSci原创 发表于上海
ETMR 是恶性儿童脑肿瘤,预后差。研究发现其细胞层级类似胎儿大脑发育,C19MC 在干细胞样细胞高表达,FGFR 和 Notch 信号促进肿瘤生长,靶向治疗或成新方向。
具有多层菊形团的胚胎性肿瘤(ETMR)是一种发生于整个中枢神经系统 (CNS) 的恶性儿童肿瘤,以其预后极差,存活率很低而一直是治疗儿童脑肿瘤的挑战。ETMR的典型特征是染色体19微小RNA簇(C19MC)的异常激活,但其具体作用机制和细胞结构尚未充分研究。
近日,丹娜法伯癌症研究所的 Volker Hovestadt 和 Mariella G. Filbin 等在 Nature Cancer 上发表了一篇 Cellular hierarchies of embryonal tumors with multilayered rosettes are shaped by oncogenic microRNAs and receptor-ligand interactions 的文章,旨在通过单细胞转录组学和空间成像技术,揭示一个空间上独特的细胞层级结构,该结构涵盖了高度增殖的神经干细胞样细胞和分化程度更高的神经元样细胞。C19MC 主要在干细胞样细胞中表达,并控制着一个调控干细胞特性和谱系定型的转录网络。对恶性细胞类型之间受体-配体相互作用的系统分析表明,成纤维细胞生长因子受体(FGFR)和 Notch 信号作为致癌通路。此研究为了解ETMR病理生物学提供了基础,并为未来靶向治疗提供了强有力的理论基础。


方法:
- 样本采集与处理:收集了11例患者的ETMR样本,包括新鲜和冷冻样本,进行单细胞RNA测序(scRNA-seq)和单核RNA测序(snRNA-seq)。
- 基因表达分析:利用Bowtie、RSEM等工具对测序数据进行比对和定量,筛选高质量细胞。
- 肿瘤细胞识别:通过拷贝数变异(CNV)推断,区分恶性和非恶性细胞。
- 细胞异质性分析:采用t-SNE、Harmony整合、多基因签名、免疫荧光(IF)和空间成像,分析肿瘤细胞的不同亚群。
- 发育模仿分析:将肿瘤细胞与胎儿大脑发育数据比对,寻找发育阶段的相似性。
- 调控网络分析:利用单细胞调控网络推断和聚类(SCENIC)分析转录因子调控网络,定义细胞层级和发育路径。
- 微小RNA靶基因识别:通过AGO2-eCLIP技术,系统性识别C19MC微小RNA的靶基因。
- 功能验证:设计锁定核酸(LNA)反义寡核苷酸抑制C19MC微小RNA,观察对肿瘤细胞增殖和凋亡的影响。
- 受体-配体相互作用分析:利用CellPhoneDB推断肿瘤细胞间的信号交流,重点关注FGFR和Notch信号通路。
- 药物筛选与临床应用:筛选FGFR和Notch抑制剂,验证其在细胞模型中的效果,并在一例患者中尝试临床应用。
研究结果:
- 肿瘤异质性:发现ETMR由两个主要恶性细胞亚群组成,图1,分别表现为“干细胞样”和“分化神经元样”,空间分布在不同的肿瘤区域。恶性细胞类型受主转录调控因子控制,并在ETMR内形成空间上独特的微环境,类似于在正常大脑发育中发现的微环境。
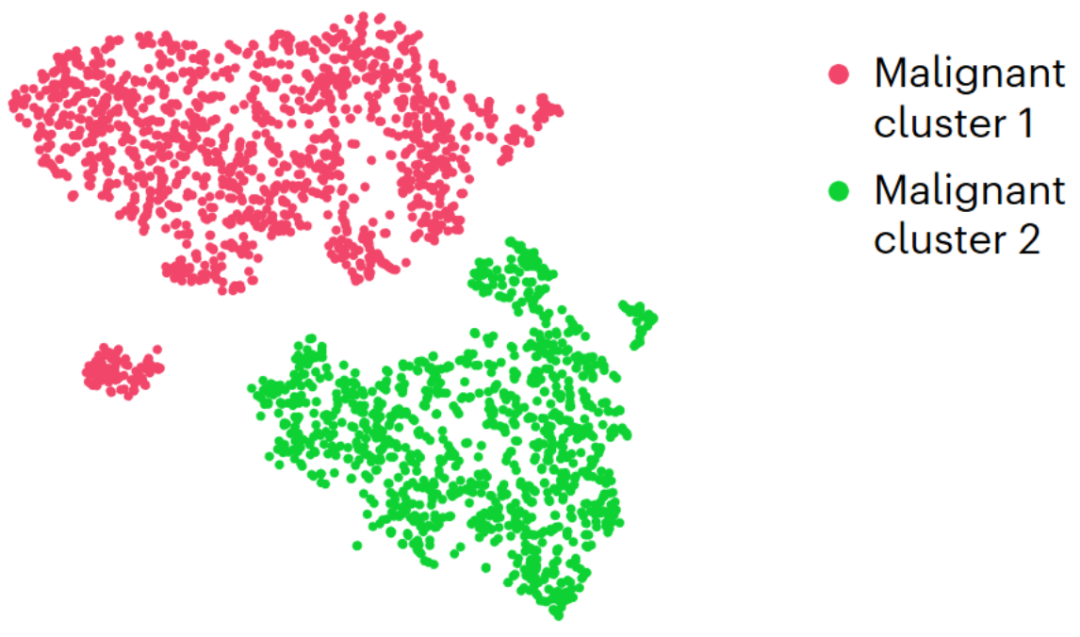
图1 显示了恶性肿瘤簇 1(干细胞样)和恶性肿瘤簇2(分化神经元样)特有的 100 个基因的相对表达
单细胞调控网络推断和聚类(SCENIC )分析细化了先前对恶性细胞群的划分,并提出了一个细胞层级结构,从干细胞样细胞(与恶性细胞簇 1 重叠)到神经元样细胞(恶性细胞簇 2),中间有一个中间细胞簇(来自细胞簇 1 和细胞簇2 的细胞),这在每个患者样本中均有检测到。
- C19MC表达:高表达主要集中在干细胞样细胞中,空间定位在肿瘤的类神经母细胞结构中。基因组分析显示C19MC的扩增在所有恶性细胞中普遍存在,但其表达受Ttyh1融合蛋白调控如图2所示。
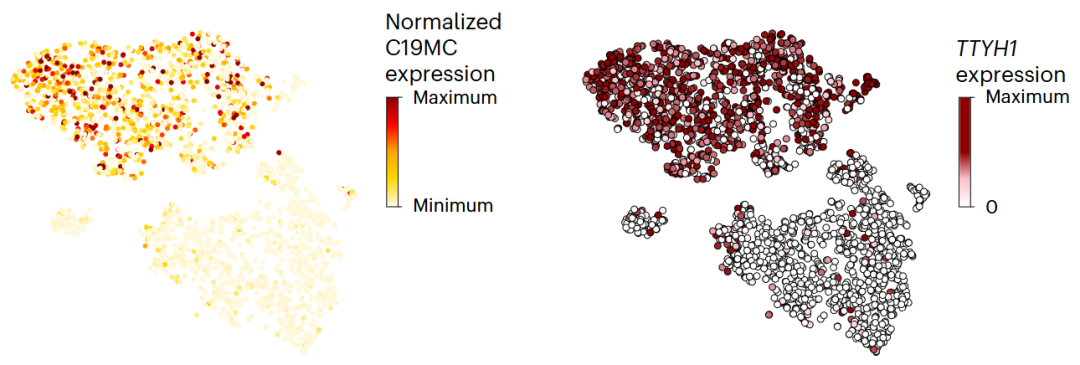
图2 ETMR细胞的t分布随机邻域嵌入( t-SNE)突出显示了 C19MC表达(左)和C19MC融合蛋白Ttyh1的相对表达(右)
- 微小RNA靶基因:应用加强型Argonaute 2 (AGO2) 蛋白结合位-免疫沉淀 (AGO2 eCLIP)技术,识别出了C19MC微小RNA的靶基因,包括调控神经发育的转录因子(如SOX4、SOX11、HES1等),这些靶基因在分化细胞中表达较高,揭示了单个C19MC成员在ETMR细胞中的广泛调控作用,而这些转录因子经常被靶向,显示了C19MC在关键发育过程调节中的重要性,这些过程包括抑制谱系承诺和分化的正调控因子,以及抑制干细胞和增殖的负调控因子。
- 干扰C19MC可减弱肿瘤细胞增殖:利用锁定核酸(Locked Nucleic Acid, LNA)反义寡核苷酸抑制C19MC微小RNA,图3,可显著抑制肿瘤细胞增殖,诱导凋亡,促进细胞向神经元样分化。
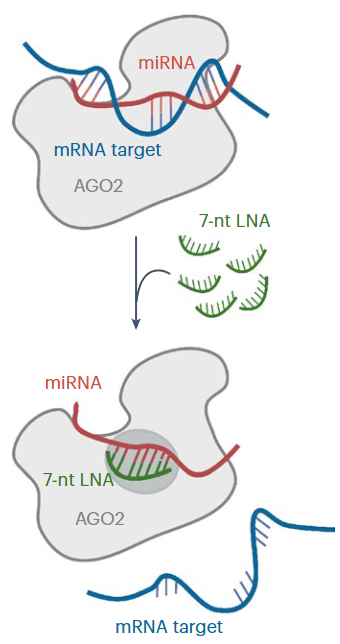
图3 LNA miRNA靶向机制示意图
- 信号通路分析:利用 CellPhoneDB 推断了受体和配体在ETMR细胞类型中的相互作用,发现了FGFR和Notch信号在肿瘤中高表达,由于 FGFR 和 Notch 通路在神经发育中起着核心作用,因此和脑癌形成有关。三种FGF受体(FGFR1、FGFR2和FGFR3)在神经干细胞中高表达,而其配体(FGF5、FGF7、FGF9)主要在分化程度更高的神经元样细胞中表达。FGFR和Notch受体和配体,在干细胞和分化细胞之间形成的信号交流网络。
- 药物验证:筛选和评估了多种FGFR和Notch抑制剂,如仑伐替尼、厄达替尼、英菲格拉替尼、尼达尼布 (lenvatinib, erdafitinib, infigratinib, nintedanib),在细胞模型中均表现出低纳摩尔浓度的高效抑制作用。临床上,一名 2岁男性患儿,右顶叶ETMR复发,左侧大脑镰旁区远处病变及颅外肺转移,在接受 3年多期化疗后,根据同情用药原则接受了厄达替尼治疗,后期加用了PARP抑制剂,他佐帕尼,治疗后肿瘤部分缓解,图4,显示了厄达替尼潜在的临床应用的前景。
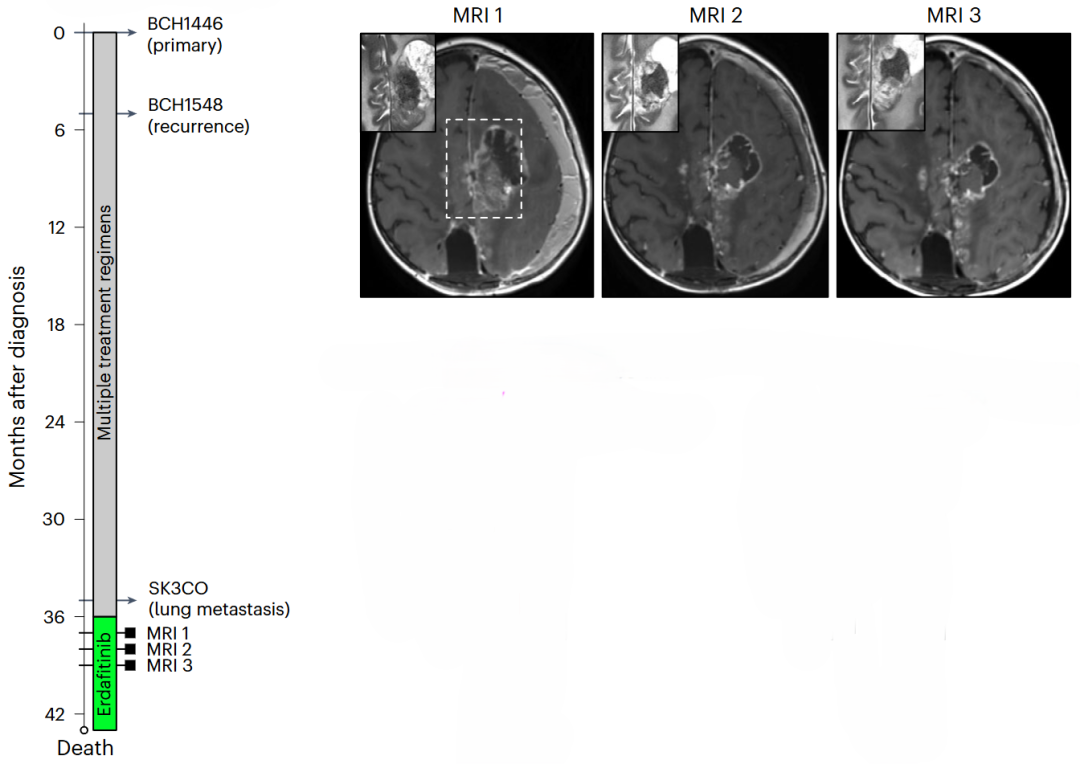
图4- MRI拍摄的图像:厄达替尼治疗 1.5 个月后(左);厄达替尼治疗 2.5 个月后(中);以及厄达替尼治疗 3.5 个月和他佐帕尼治疗 1 个月后
研究结论:
- 肿瘤发育模仿:ETMR的细胞层级和空间结构类似胎儿大脑的早期发育过程,主要由未分化的干细胞样细胞驱动,缺乏成熟神经元和胶质细胞。
- C19MC的作用:高表达的C19MC微小RNA簇在维持干细胞状态、阻碍分化中起到关键作用,其靶基因多为神经发育调控因子。抑制C19MC可逆转肿瘤细胞的未分化状态,具有潜在的治疗价值。
- 细胞间信号交流:FGFR和Notch信号在肿瘤细胞的不同亚群间起到维持和促进肿瘤生长的作用,靶向这些信号通路可能打破肿瘤细胞的合作网络。
- 临床前景:多种FGFR和Notch抑制剂在细胞模型中表现出良好的效果,且已有FDA批准的药物可供临床试验。实际临床中,一例患者在接受厄达替尼后获得部分缓解,表明抑制靶向信号通路的治疗前景。
这项研究表明,ETMR具有独特的细胞结构,类似于早期胎儿神经发生过程中发生的发育过程。这项研究进一步阐明了特定的 C19MC 成员以及 Notch 和 FGFR 等发育信号通路是如何驱动细胞自我更新和分化受损。期待未来对这些现象进一步的研究能够揭示其他靶点,为开发针对这类高度恶性儿童脑肿瘤的关键治疗策略带来希望。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#胚胎性肿瘤# #C19MC#
16 举报