华科李子福教授/杨祥良教授团队《Biomaterials》:靶向碳酸酐酶Ⅸ的纳米药物逆转肿瘤酸环境,清除肿瘤干细胞并克服免疫抑制
2025-06-20 BioMed科技 BioMed科技 发表于上海
该药物以CA9抑制为切入点,打破肿瘤内外pH梯度,通过“胞内酸化”增强阿霉素与铜离子的杀伤效应,同时通过“胞外碱化”恢复T细胞功能,诱导系统性抗肿瘤免疫。
肿瘤干细胞(Cancer Stem Cells, CSCs)和肿瘤酸性微环境被认为是导致实体瘤耐药、复发与免疫逃逸的核心难题。在实体瘤中,
肿瘤细胞即使处于有氧状态也依赖糖酵解产能,造成胞外乳酸堆积和质子外排,形成典型的酸性微环境。这一环境不仅支持肿瘤细胞的侵袭与转移,还严重抑制效应T细胞与树突状细胞的功能,降低免疫治疗的响应率。而肿瘤干细胞作为维系肿瘤异质性和干性的重要亚群,通常具备更强的抗氧化能力与代谢适应性,能够借助碳酸酐酶IX(CA9)等蛋白维持胞内碱性、胞外酸性,在酸性屏障保护下逃避多种治疗。
针对这一问题,华中科技大学生命科学与技术学院李子福教授、杨祥良教授团队在国际材料与生物医学期刊《Biomaterials》上发表了题为“Modulating Tumor Acidity with Hydroxyethyl Starch-Based Nanoparticles by Targeting CA9 to Eliminate Cancer Stem Cells and Overcome Immunosuppression”的工作,开发了一种靶向CA9的羟乙基淀粉纳米药物(CHHD-Cu NPs)。该药物以CA9抑制为切入点,打破肿瘤内外pH梯度,通过“胞内酸化”增强阿霉素与铜离子的杀伤效应,同时通过“胞外碱化”恢复T细胞功能,诱导系统性抗肿瘤免疫。
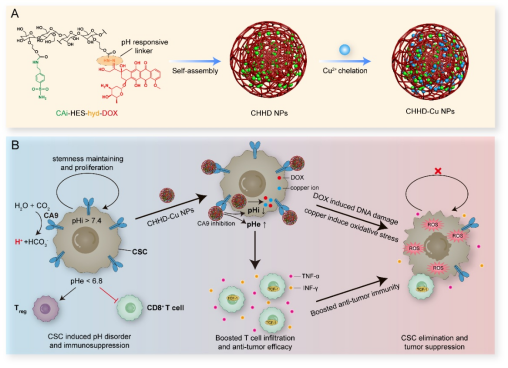
图1. CHHD-Cu NPs的制备路线与治疗策略机制图
研究团队设计并合成了一种基于羟乙基淀粉(HES)的智能纳米载体CHHD-Cu NPs,结构中引入了阿霉素(DOX)、CA9抑制剂(CAi)和铜离子(Cu²⁺)。该纳米粒子在酸性微环境中表现出良好的稳定性与释放特性。透射电镜和DLS表征结果显示其尺寸均一,粒径约140 nm。在模拟肿瘤环境(pH 5.0和高GSH)下,CHHD-Cu NPs可实现pH/GSH双响应性释放,同时激活Cu⁺参与的类Fenton反应生成羟基自由基,实现高效的ROS水平提升,为抗肿瘤反应提供物理基础。
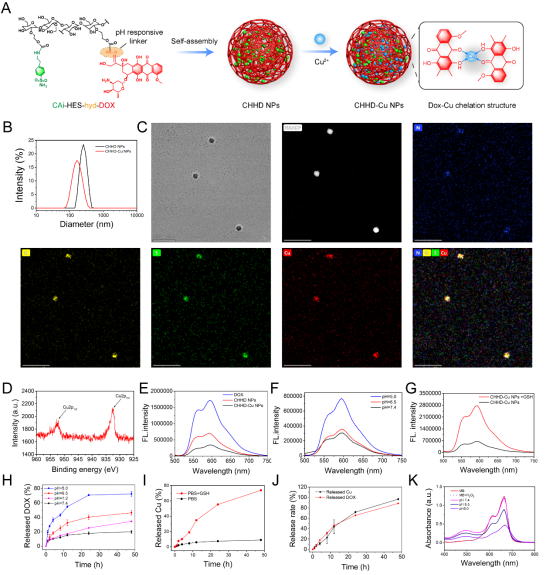
图2. pH/GSH双响应性CHHD-Cu NPs的构建与表征
CHHD-Cu NPs通过有效释放Cu2+与DOX并抑制CA9,诱导H22肿瘤细胞胞内酸化(pHi下降)及谷胱甘肽(GSH)耗竭,显著氧化应激水平。这一酸化过程促进DOX毒性作用和铜离子参与的氧化应激,从而增强肿瘤细胞杀伤效果。细胞活力检测显示,相较于非靶向纳米粒子,CHHD-Cu NPs具有更强的细胞毒性,IC50明显下降,凋亡水平显著上升,证实其在酸性微环境下具备优异的抗肿瘤能力。
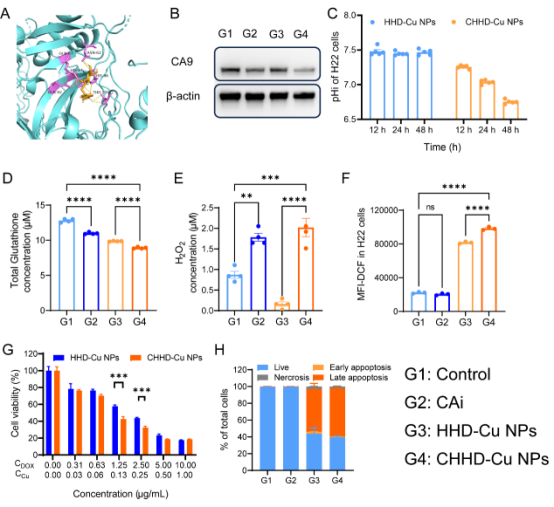
图3. CHHD-Cu NPs诱导肿瘤细胞酸化并增强毒性效应
为验证CHHD-Cu NPs作用机制依赖于CA9,研究对H22细胞进行CA9敲低实验。结果发现,CA9敲低细胞中CHHD-Cu NPs诱导的pHi、ROS、摄取效率等关键参数的变化均被显著削弱,细胞凋亡水平也明显下降。说明CHHD-Cu NPs通过CA9抑制打破胞内外pH梯度,并以此为基础实现选择性杀伤。CA9是实现“酸碱调控+化疗+氧化应激”三重机制协同效应的关键靶点。
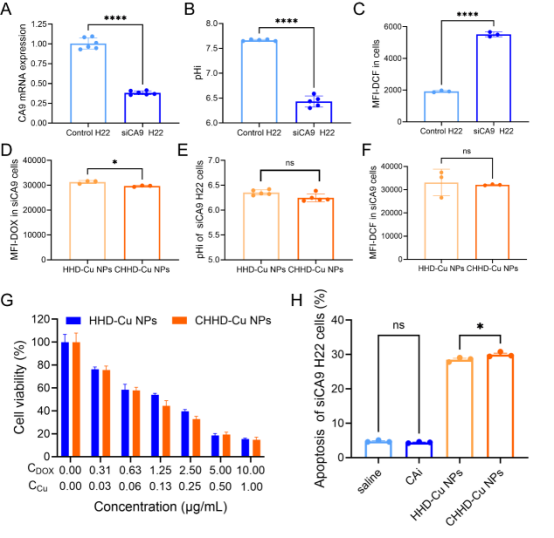
图4. CA9敲低削弱CHHD-Cu NPs在H22细胞中的靶向优势
在H22肿瘤干细胞模型中(基质胶培养),CHHD-Cu NPs通过抑制CA9降低pHi,提高ROS并降低总谷胱甘肽水平,显著降低CD13+CD133+细胞比例,破坏球状克隆形成能力,并阻滞细胞周期。共培养实验证实该策略可提升T细胞对CSCs的识别与黏附能力,明显增强T细胞介导的凋亡作用,表明其可协同免疫清除CSC群体,具有优异的干性抑制与免疫增强效果。
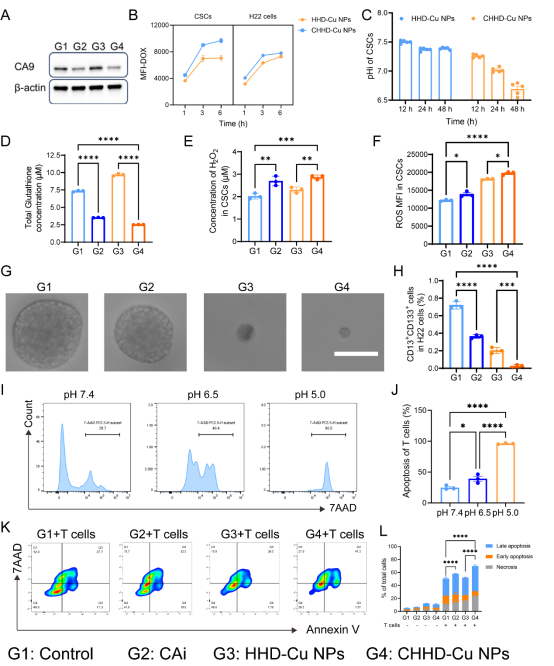
图5. CHHD-Cu NPs诱导CSCs酸化和氧化应激,削弱干性并增强T细胞杀伤
在小鼠H22皮下瘤模型中,CHHD-Cu NPs处理组肿瘤组织中CA9和多种干性标志物(CD24+CD44+、CD133+等)表达明显下降,表明其在体内也能抑制干性维持。同时,流式细胞术检测结果显示该策略可增强肿瘤组织中CD8+ T细胞浸润与IFN-γ、TNF-α分泌,抑制Tregs与Tim-3+PD-1+耗竭T细胞,显著重塑免疫微环境,提高抗肿瘤免疫反应。
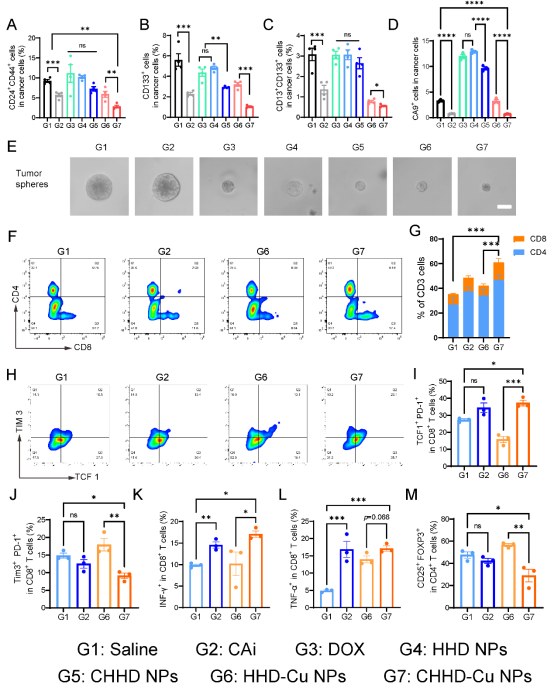
图6. CHHD-Cu NPs在体内抑制CA9表达并改善肿瘤免疫微环境
为评估CHHD-Cu NPs的整体抗肿瘤效果,研究团队在H22皮下肿瘤小鼠模型中开展了体内治疗实验。结果显示,CHHD-Cu NPs组肿瘤体积显著缩小,抑瘤效果优于自由药物和不含CAi的对照组。进一步分析发现,CHHD-Cu NPs组肿瘤组织中CA9表达水平显著降低(免疫组化及Western blot均证实),胞内谷胱甘肽含量下降至对照组的15%左右,同时过氧化氢水平上升,表明药物成功诱导氧化还原失衡。更重要的是,在癌症干细胞群体(CD133+)中,CHHD-Cu NPs处理显著提升ROS水平,提示其具备激活CSC氧化应激的能力。毒性分析显示,除DOX裸药组外,其他组体重稳定,血液学与主要器官无明显损伤,提示该药物在有效抑瘤的同时具备良好生物安全性。
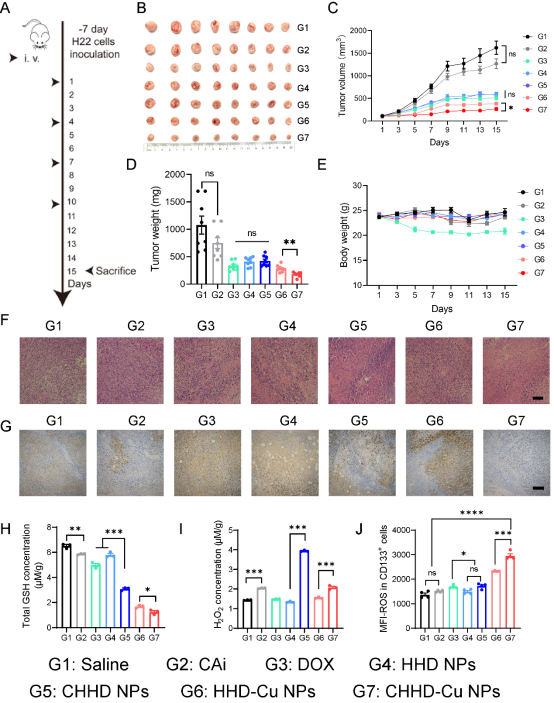
图7. CHHD-Cu NPs显著抑制小鼠H22皮下瘤生长
总结与展望:本研究围绕CA9在癌症干细胞与免疫抑制中的核心作用,设计开发了具有酸/GSH响应性的CHHD-Cu NPs纳米药物,实现了“胞内酸化+免疫重塑”的治疗策略。该策略通过靶向CA9诱导ROS爆发和干性清除,并提升T细胞活性与DC功能,体现出在耐药性强、免疫抑制重的实体瘤中强大的转化潜力,为免疫联合治疗提供了新思路。
华中科技大学生科院李子福教授:博士生导师、华中卓越特聘教授,入选国家高层次青年人才、湖北省海外高层次人才、华中科技大学学术前沿青年团队项目、Biomaterials Science 2022年Emerging Investigators,作为负责人领衔中央高校优秀青年团队培育项目,以核心骨干身份入选科技部重点领域创新团队(肿瘤纳米医药技术创新团队),研究方向为生物力纳米肿瘤学。担任国家药品注册审评专家咨询委员会专家、“湖北省生物无机化学与药物”重点实验室及“生物医用与防护材料湖北省工程研究中心”副主任,被选为中国抗癌协会纳米肿瘤学专业委员会委员、中国抗癌协会纳米肿瘤学青年委员会常委、中国药学会药剂学青年委员会委员、中国毒理学会纳米毒理学专业委员会委员、中国免疫学会肿瘤免疫及生物治疗专业委员会委员。在Nature Communications, Angewandte Chemie International Edition, Advanced Functional Materials, Advanced Science, Biomaterials, Research, Chemical Society Reviews, Accounts of Chemical Research等期刊发表 SCI 论文100余篇,他引4900余次,H因子40,申请中国发明专利30件(其中已授权25件),申请PCT国际专利5项、美国专利1项,参编英文专著2部,主持国家自然科学基金项目3项、参与科技部重点研发计划项目2项,研究工作获临床试验伦理批件2项。
课题组主页:
https://www.x-mol.com/groups/li_zifu
原文链接:
https://www.sciencedirect.com/unsupported_browser
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#肿瘤干细胞# #碳酸酐酶Ⅸ#
18 举报