Cancer Res:中山大学程帝等团队研究发现胰腺癌中癌症相关成纤维细胞通过构建高乳酸微环境驱动神经浸润
2025-06-28 iNature iNature 发表于上海
该研究成功分离出PNI相关癌症相关成纤维细胞(pCAF),发现相较于非PNI相关CAFs,pCAF具有显著增强的促神经浸润能力。
神经周围浸润(PNI)是胰腺癌的关键预后因素,与肿瘤侵袭性行为及不良临床结局密切相关。鉴于PNI明确的临床影响,深入解析其诱导表型的分子机制具有重要意义。
2025年6月16日,中山大学程帝,广东省人民医院陈汝福和Shangyou Zheng共同通讯在Cancer Research在线发表题为“Cancer-Associated Fibroblasts Foster a High-Lactate Microenvironment to Drive Perineural Invasion in Pancreatic Cancer”的研究论文。该研究成功分离出PNI相关癌症相关成纤维细胞(pCAF),发现相较于非PNI相关CAFs,pCAF具有显著增强的促神经浸润能力。
单细胞高通量测序与代谢组学数据显示,pCAF中糖酵解通路显著上调,形成富含乳酸促肿瘤进展的微环境。肿瘤细胞摄取pCAF来源的乳酸后,介导组蛋白H3K18位点发生乳酸化修饰。这种表观遗传调控可激活神经浸润相关基因(如L1CAM和SLIT1)的转录,从而驱动胰腺癌PNI进程。进一步研究发现pCAF代谢重编程特征表现为糖酵解酶GAPDH乙酰化水平升高,该修饰与其酶活性及糖酵解通量增加呈正相关。在基因工程小鼠模型中,靶向抑制GAPDH及乳酸化修饰可显著抑制神经浸润。临床数据分析显示,H3K18乳酸化水平与PNI严重程度及患者不良预后显著相关。本研究系统阐明了CAFs促进胰腺癌PNI的作用机制,揭示糖酵解重编程和乳酸化表观遗传调控可作为胰腺导管腺癌(PDAC)的潜在治疗靶点。

神经周围浸润(Perineural invasion, PNI)是胰腺癌的重要生物学特征,表现为肿瘤细胞侵入神经组织并促进其扩散和转移。PNI与疾病早期进展及术后复发密切相关,被公认为患者预后不良的独立因素。胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)的PNI发生率高达80%-100%,甚至在早期上皮内瘤变阶段即可观察到神经重塑现象。作者前期的随机对照试验证实,标准Whipple术联合改良腹膜后神经清扫可显著改善胰头癌患者的无病生存期(Disease-free survival, DFS),同时显著缓解术后背痛,凸显了靶向PNI治疗的重要性。肿瘤微环境(Tumor microenvironment, TME)重塑与PNI在上皮内瘤变阶段的同步发生,提示二者存在密切联系,亟需深入研究。
TME通过其复杂的细胞网络、信号分子和细胞外基质成分与癌细胞发生交互作用,在胰腺癌PNI过程中起关键调控作用。既往研究发现,PDAC微环境中基质细胞分泌的白血病抑制因子(Leukemia inhibitory factor, LIF)可诱导神经细胞迁移与分化,其表达水平与神经重塑及轴突发生呈正相关。作者最新研究证实,癌症相关成纤维细胞(Cancer-associated fibroblasts, CAFs)通过细胞外囊泡递送非编码RNA PNI相关转录本(PIAT)至癌细胞,调控YBX1依赖的m5C修饰从而促进PNI。Banh团队指出,在营养匮乏条件下,TME的代谢重塑(特别是外周轴突释放的丝氨酸)对维持PDAC生长和促进神经浸润至关重要。Auciello团队则揭示胰腺星状细胞衍生的溶血磷脂酰胆碱及其自分泌运动因子-溶血磷脂酸轴可通过增强癌细胞增殖迁移显著促进PDAC进展。然而,CAFs在胰腺癌PNI过程中的代谢调控机制尚未阐明。
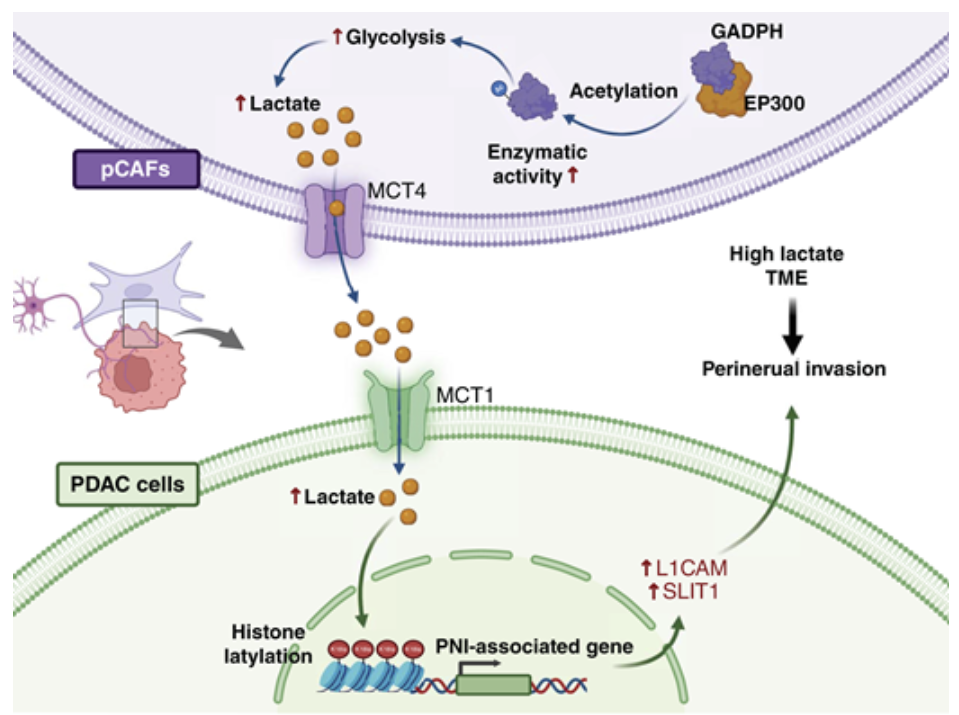
模式机理图(图片源自Cancer Research)
乳酸代谢是糖酵解激活后的关键生物学过程。肿瘤乳酸代谢微环境的重塑通过调控肿瘤细胞自噬、线粒体活性、免疫逃逸及表观遗传修饰促进肿瘤进展与转移。CAFs构建的糖酵解激活型高乳酸微环境可介导前列腺癌细胞中脂滴沉积及脂蛋白PLIN2的组蛋白乙酰化,进而促进肿瘤转移。某些代谢物具有双重作用:既是能量生成和生物质形成的必需物质,又能通过调控基因和蛋白质表达影响癌细胞在TME中的行为。组蛋白乳酸化作为高乳酸微环境的核心机制,已被证实对肿瘤代谢重编程、侵袭转移、耐药性及免疫逃逸具有重要调控作用。Wang团队在PDAC中揭示了组蛋白乳酸化对肿瘤转移的调控作用,为基于代谢-表观遗传-免疫轴进行预后预测、患者分层和靶向治疗提供了新思路。但CAFs如何重塑胰腺癌乳酸代谢微环境,并通过组蛋白乳酸化继发调控PNI的机制仍有待解析。
本研究旨在阐明CAFs促进PDAC发生PNI的分子机制。通过体内外实验模型,作者发现PNI阳性(PNI+)PDAC患者来源的CAFs能显著增强肿瘤细胞向神经的侵袭能力。机制上,PNI+ CAFs中糖酵解酶GAPDH的乙酰化水平升高可增强其酶活性,进而促进糖酵解和乳酸分泌。这导致肿瘤细胞组蛋白H3K18乳酸化水平升高,继而转录激活L1CAM和SLIT1,最终促进PNI。本研究揭示了CAFs来源的乳酸通过H3K18乳酸化(H3K18la)在TME中促进PNI的关键作用,并提出靶向乳酸代谢或H3K18la抑制胰腺癌PNI的新型治疗策略。
原文链接:
https://doi.org/10.1158/0008-5472.CAN-24-3173
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#胰腺癌# #神经周围浸润#
23 举报