Nature Genetics:化疗对正常血细胞长期影响:增加突变负荷和促进克隆结构早衰
昨天 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
研究发现化疗会增加正常血细胞突变负荷,致克隆结构早衰,突变特征与药物相关,为减轻不良反应提供方向。
细胞毒类制剂作为(如烷化剂、铂类化合物、抗代谢物、拓扑异构酶抑制剂等)化疗常用药物,其主要通过损伤DNA,杀伤肿瘤细胞。这类化疗药物在杀伤肿瘤细胞同时,也会对正常组织DNA造成损伤,对正常组织产生长期的影响,如增加继发肿瘤风险、导致不孕不育或部分器官功能的长期退化等后遗症。但目前对这些化疗后遗症的生物学机制认识有限,特别是化疗对正常组织的体内诱变效应,尚缺乏直接的实验证据。
近日,英国Wellcome Sanger研究所的 Emily Mitchell 和 My H. Pha 等研究人员在 Nature Genetics 上发表题为 The long-term effects of chemotherapy on normal blood cells 的文章,团队对23名接受过不同化疗方案的3-80岁患者血细胞进行全基因组测序,结果发现化疗会导致正常血细胞亚群发生克隆结构早衰,某些化疗药物会增加体细胞突变负荷,且这些突变特征与药物种类相关。研究揭示了细胞毒性药物对患者产生的长期生物学影响,也为减轻不良反应提供了研究方向。

研究对23名接受多种化疗方案的血液或实体肿瘤患者血细胞进行进行分选、体外培养和全基因组测序分析,将以前发表的9名无细胞毒类药物暴露的正常人全基因组数据作为对照。
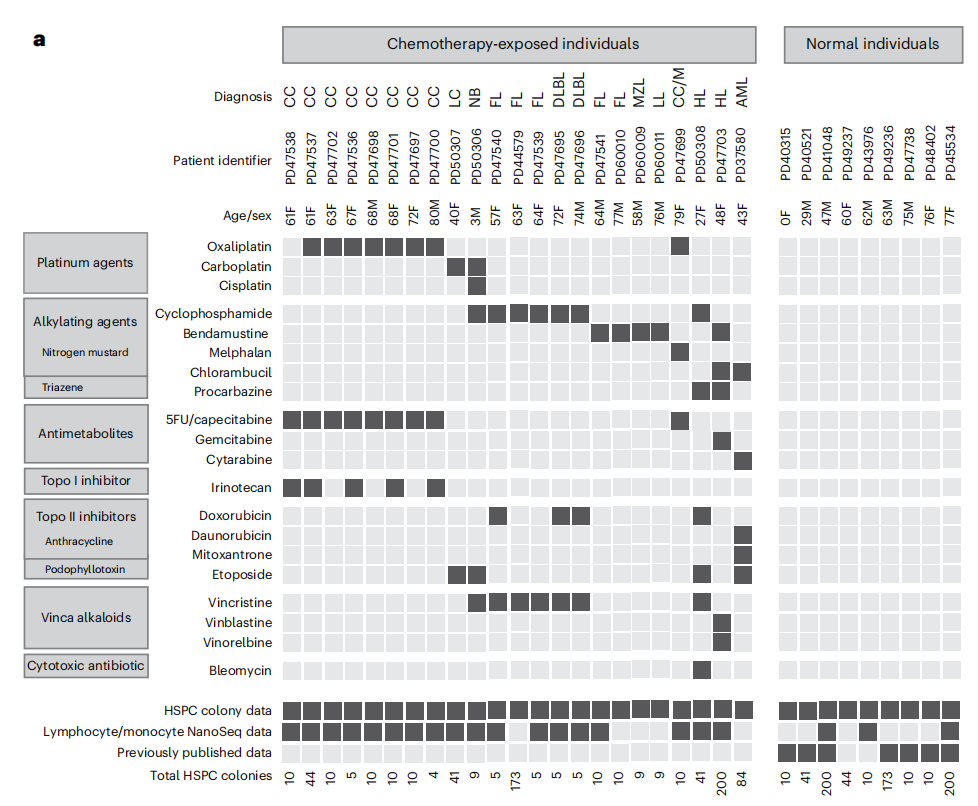
图1.样本捐赠者的详细人口学信息、接受化疗药物信息和样本信息。CC,结直肠癌;LC,肺癌;NB,神经母细胞瘤;FL,滤泡性淋巴瘤;DLBL,弥漫性大B细胞淋巴瘤;MZL,边缘区淋巴瘤;LL,淋巴浆细胞性淋巴瘤;M,多发性骨髓瘤;HL,霍奇金淋巴瘤;5FU,5-氟尿嘧啶;Topo,拓扑异构酶。
与化疗相关的体细胞突变特征
与同龄正常人预期值相比,接受化疗患者的人造血干细胞中体细胞(HSPC)单碱基替换突变(SBS)具有显著差异,其中4例样本中SBS增加超过1,000个(图2a),13例SBS增加200-600个之间(图2b),6例SBS无明显变化。
为进一步明确究竟是哪些化疗药物导致了突变负荷的升高,研究团队从接受化疗者与对照组SBS和插入缺失突变(Indel)中提取突变特征谱,评估每种特征谱对正常血细胞中体细胞突变的贡献程度。结果鉴定了12个SBS突变特征谱,其中有4个是在正常的人造血干细胞中体细胞和白细胞中存在的,分别为SBS1、SBS5、SBS7a和SBS9(图2c,左侧),另有8个SBS被认为只存在于接受化疗的患者中(图2c,右侧):SBSA特征和插入缺失突变特征IDA可能源于丙卡巴肼,SBSC特征与苯丁酸氮芥相关,SBSD特征与苯达莫司汀相关,SBSE特征与美法仑相关,SBSF特征与顺铂和卡铂相关,SBSG特征则与5-氟尿嘧啶或其前药卡培他滨相关,SBSB和SBSH特征的病因学关联相对模糊。
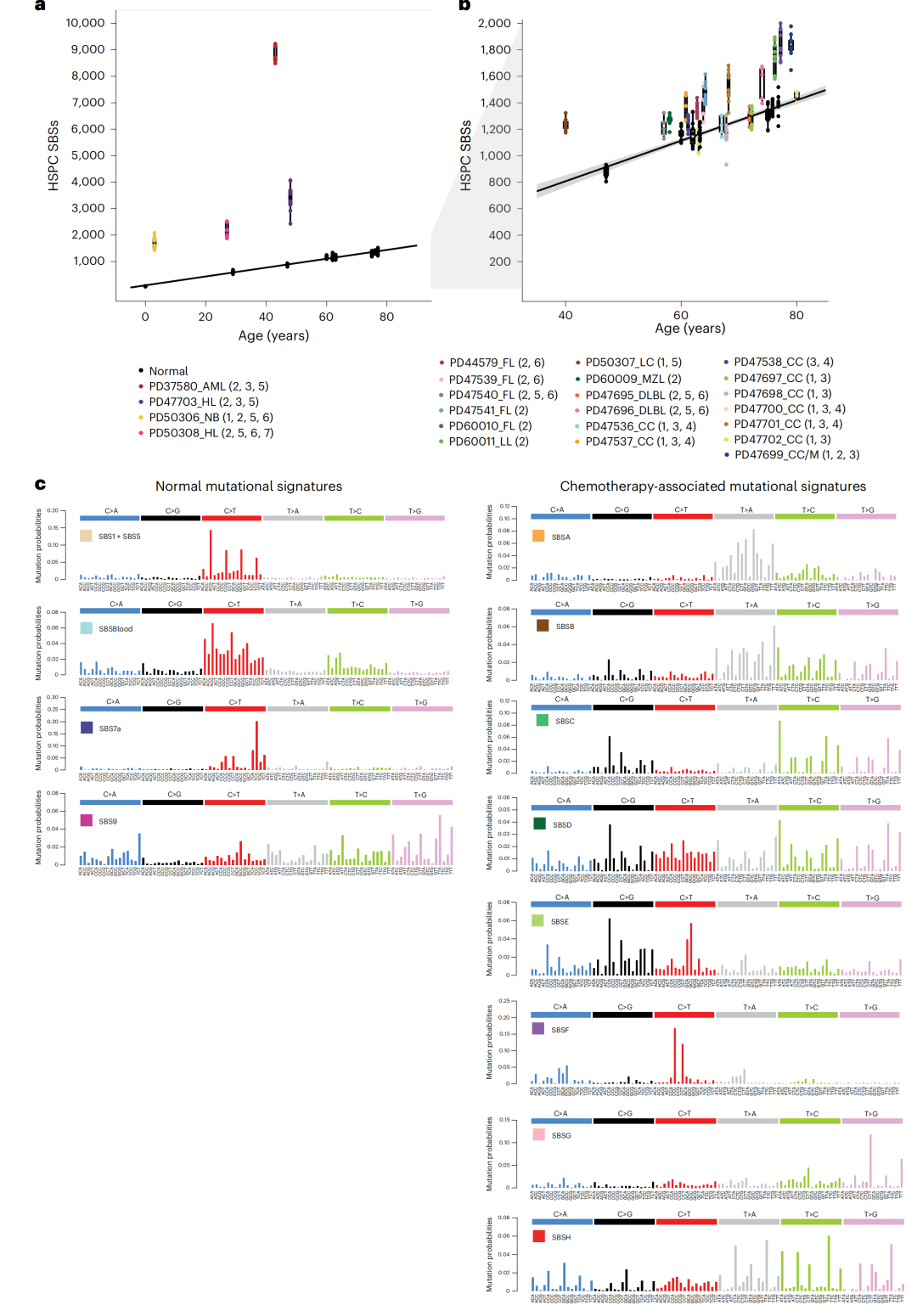
图2 正常血细胞与化疗暴露血细胞的突变负荷及突变特征。a和b,正常个体与SBS负荷最高的四位化疗暴露个体的单碱基替换(SBS)负荷分布。化疗方案:1-铂类药物;2-烷化剂;3-抗代谢药;4-拓扑异构酶I抑制剂;5-拓扑异构酶II抑制剂;6-长春花生物碱;7-细胞毒性抗生素;C,从正常与化疗暴露HSPC克隆全数据集及批量成熟血细胞亚群双链测序数据中提取的突变特征。
需要说明的是同类化疗药物导致正常血细胞突变负荷存在显著差异,如在烷化剂中,苯丁酸氮芥、苯达莫司汀和美法仑引起正常细胞突变负荷显著高于环磷酰胺。卡铂和顺铂引发的单碱基替换突变(SBSF)负荷远高于奥沙利铂,即便部分患者接受长期奥沙利铂治疗(最多22个周期),其SBSF突变负荷在所有病例中均低于5%。
不同细胞亚群对相同化疗方案诱导突变的反应也存在差异,单核细胞中SBS特征突变负荷模式与造血干细胞相似,而B细胞和T细胞对某些化疗药物则表现出差异。例如,在B细胞、幼稚T细胞和记忆T淋巴细胞中检测到由5-氟尿嘧啶/卡培他滨诱发的SBSG突变特征,但在HSPCs和单核细胞中未检测到(图3)。相反,铂类药物诱发的SBSF特征在HSPCs、单核细胞和B细胞中产生的突变负荷高于幼稚T细胞和记忆T细胞(图3)。由丙卡巴肼诱发的SBSA特征在各细胞类型中产生的突变负荷较为相似。因此,某些化疗药物会在不同细胞类型中引起差异化的突变负荷。

图3. 不同细胞亚型突变负荷与SBS突变特征谱。堆叠条形图展示了各SBS突变特征谱对细胞类型SBS突变负荷的绝对贡献(左侧),并与各特征谱的比例贡献(右侧)进行对比。
化疗对造血细胞克隆结构的影响
通过对比6名化疗暴露与同龄未暴露的HSPC系统发育树发现,长期或多次接受化疗的患者(如PD37580和PD47703)出现克隆结构早衰现象,表现为多个携带DNA损伤反应基因(如PPM1D、TP53、CHEK2)驱动突变的克隆显著扩增(图5),正常情况下,这种克隆扩增通常在70岁以上健康人群中才会出现,且多涉及DNMT3A和TET2等基因。PD37580患者在接受化疗前就存在PPM1D突变,而对PD47703患者间隔1年的两个血样结果对比发现,接受化疗后(环磷酰胺、多柔比星和长春新碱),携带PPM1D突变的克隆增加了50%,这些结果提示化疗可能是主要通过选择压力促进克隆结构早衰。另外,在两名年轻且治疗时间距采样不超过两年成人患者(29岁的PD50308和40岁的PD50307)中,并未观察到造血干细胞与祖细胞群体存在克隆结构早衰的结构特征,提示HSPC克隆结构早衰可能需要多次/长期化疗暴露或化疗后经过数十年时间才能被检测到。
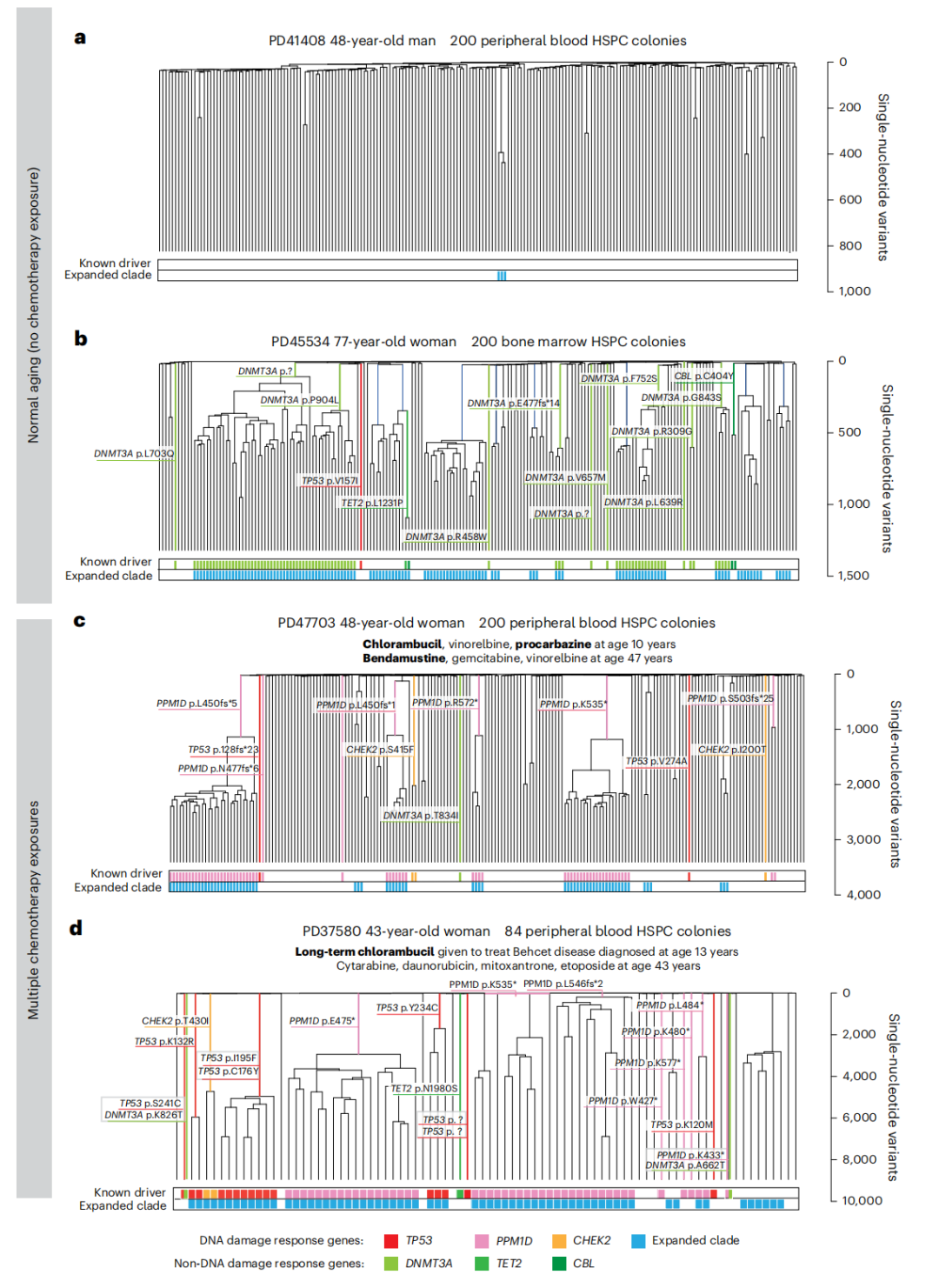
图5. 两名正常未暴露者与两名化疗暴露成年个体的造血干细胞祖细胞(HSPC)系统发育树。a、b为两名正常未暴露供体的系统发育树:分别为一位年轻成人(a)和一位年长成人(b)。c、d为两名接受化疗治疗的年轻成人个体系统发育树,二者均经历多次化疗暴露。
总之,某些化疗方案会增加正常细胞的突变负荷,化疗药物引发的额外突变负荷具有独特的突变特征,这类特征在同类化疗药物中具有共性,在不同血细胞类型间存在差异,且不同化疗药物引发的细胞类型间差异模式也各不相同。另外,某些化疗药物促进正常细胞克隆结构早衰,表现为携带肿瘤基因驱动突变克隆扩增(正常老化特征)。因此,对于曾接受化疗的患者,了解正常细胞突变谱和克隆结构改变也有助于评估其对标准治疗方案的适用性,并在适当情况下探索替代治疗方案。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#化疗# #突变负荷#
0 举报
增加继发肿瘤风险、导致不孕不育或部分器官功能的长期退化等后遗症。
0 举报