J Hepatol:复旦大学孙云帆等团队发现肝细胞癌中SGK1缺失通过促进对T细胞介导免疫的抵抗,支持转移性定植
13小时前 iNature iNature 发表于上海
该研究利用体内CRISPR文库筛选,在免疫系统完整及T细胞缺失的小鼠HCC转移模型中,鉴定出在转移定植期间对肿瘤免疫逃逸至关重要的基因,并通过多种实验手段探讨其内在机制。
肝细胞癌(HCC)中肿瘤细胞的免疫逃逸是有效靶向转移的主要障碍,但转移种植过程中促进免疫逃逸的具体分子机制尚未完全阐明。
2025年7月,复旦大学孙云帆,David H. Peng和上海科技大学仓勇,张力烨共同通讯在Journal of Hepatology 在线发表题为“Loss of SGK1 supports metastatic colonization in hepatocellular carcinoma by promoting resistance to T cell-mediated immunity”的研究论文。该研究利用体内CRISPR文库筛选,在免疫系统完整及T细胞缺失的小鼠HCC转移模型中,鉴定出在转移定植期间对肿瘤免疫逃逸至关重要的基因,并通过多种实验手段探讨其内在机制。筛选结果显示,Sgk1是T细胞免疫监视下抑制转移定植的重要基因。
Sgk1缺失的肿瘤细胞在存在CD8+ T细胞的情况下表现出显著增强的转移能力,表明Sgk1在调控免疫逃逸中的关键作用。临床分析亦证实,HCC患者循环肿瘤细胞及转移灶中SGK1表达显著低于原发肿瘤,且低表达与T细胞功能受损及不良临床预后相关。机制研究发现,肿瘤细胞中Sgk1失活削弱CD8+ T细胞介导的、依赖RIPK1的程序性坏死(necroptosis),这一细胞死亡途径对于细胞毒性T细胞限制肿瘤转移至关重要。Sgk1缺失使肿瘤细胞能够逃避T细胞诱导的细胞毒性,从而促进转移定植。此外,Sgk1缺失转移细胞的增殖导致肿瘤微环境向末端T细胞耗竭转变,进一步促进持续的免疫逃逸。综上,SGK1是调控肝细胞癌转移生长中免疫介导控制的关键因子。转移灶中SGK1表达可作为免疫检查点抑制剂疗效的预测生物标志物,为克服转移性HCC的免疫耐受提供新的治疗策略。

转移仍是癌症的常见特征,也是大多数癌症相关死亡的主要原因。尽管已知原发肿瘤每天向血液循环释放成千上万的肿瘤细胞,但仅有少数细胞能够存活并形成转移灶,这表明肿瘤细胞向远端部位迁移和定植是转移过程中的关键瓶颈。成功的转移定植必须克服来自异质且具有敌意的微环境的限制,尤其是免疫监视。扩散的肿瘤细胞(DTCs)可能被宿主免疫细胞识别并清除,主要是CD8+ T细胞和自然杀伤细胞。然而,与原发肿瘤生长过程中的免疫编辑相比,关于转移种植及增殖过程中肿瘤细胞与局部免疫细胞相互作用的研究相对较少。
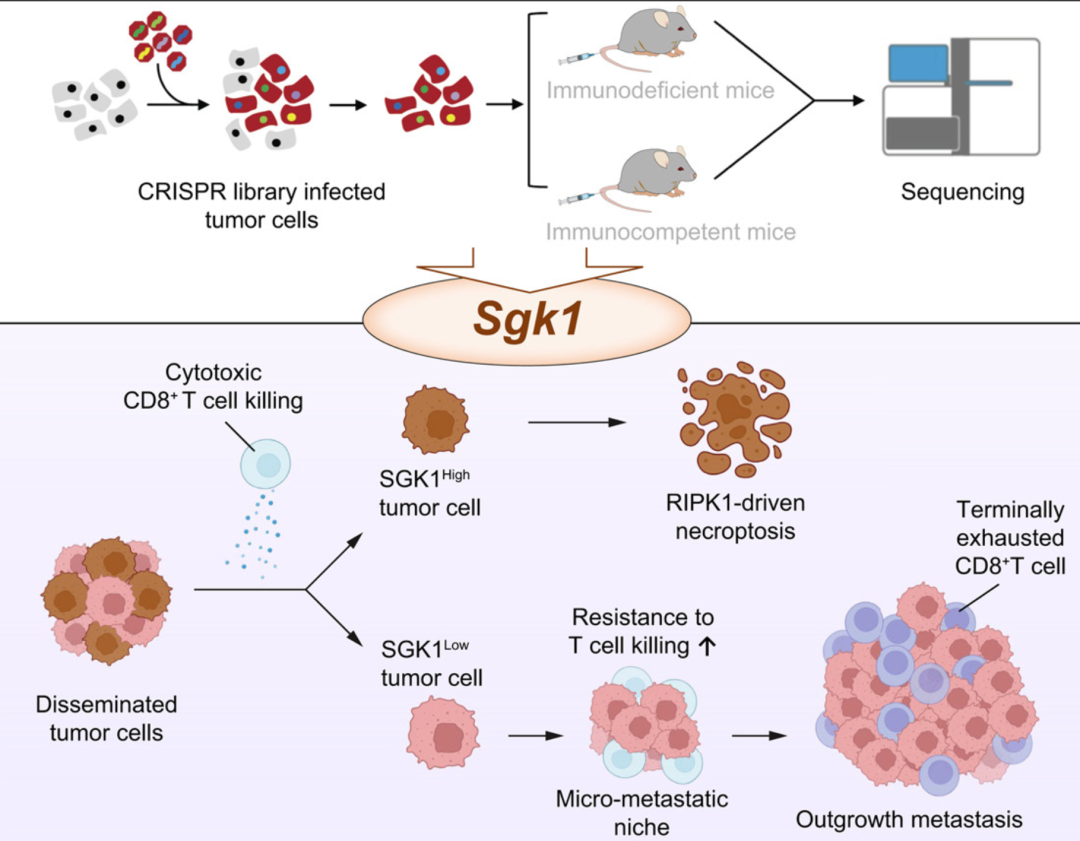
模式机理图(图片源自Journal of Hepatology)
该研究构建了一个体内CRISPR/Cas9筛选系统,利用包含人类癌症中常见突变基因的定制单导RNA(sgRNA)文库,发现了通过逃避T细胞免疫促进肿瘤转移定植的功能缺失突变。作者鉴定出血清/糖皮质激素调节激酶1(Sgk1)在肝细胞癌(HCC)细胞从小鼠肺部被免疫清除过程中必不可少,并验证了SGK1表达降低与患者生存率下降的相关性。SGK1失活抑制了受体相互作用蛋白激酶1(RIPK1)介导的程序性坏死(necroptosis),使肿瘤细胞对CD8+ T细胞的攻击抵抗力增强。缺失Sgk1的微转移灶表现出对免疫检查点抑制剂(ICIs)的耐受,而在转移早期给予ICIs可有效逆转Sgk1缺失DTCs所塑造的抑制性且终末耗竭的免疫微环境。此外,转移灶中的SGK1表达有望作为晚期HCC患者免疫检查点抑制剂疗效的预测标志物。
原文链接:
https://www.journal-of-hepatology.eu/article/S0168-8278(25)00064-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#肝细胞癌# #SGK1缺失#
4 举报