帕金森病异动症:病理机制与治疗策略
2025-02-20 神经科学论坛 神经科学论坛 发表于陕西省
帕金森病患者长期用左旋多巴约 50% 5 年内现异动症。其机制涉及多因素,临床有多种分型和生物标志物。治疗有药物、基因细胞及神经调控等,未来需跨学科实现精准个体化治疗。
论坛导读:帕金森病(Parkinson’s Disease, PD)患者长期接受左旋多巴(Levodopa)治疗后,约50%在5年内出现异动症(Levodopa-Induced Dyskinesia, LID),表现为不自主的舞蹈样或肌张力障碍样动作。近年来,随着神经科学和分子生物学的进步,LID的病理机制研究取得重要突破,新型治疗策略亦逐步从实验室走向临床。
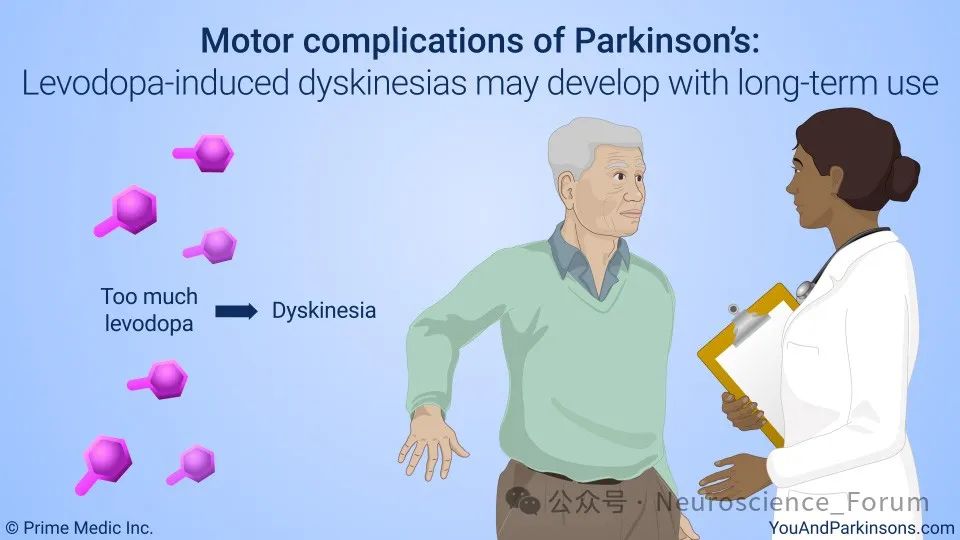
帕金森病是全球第二大神经退行性疾病,其主要病理特征为黑质多巴胺能神经元变性。左旋多巴作为PD治疗的“金标准”,虽能显著改善运动症状,但其长期使用引发的异动症严重影响患者生活质量。异动症(Levodopa-Induced Dyskinesia, LID)是长期服用左旋多巴治疗所导致的临床后果。其症状学包括了舞蹈、投掷症和肌张力障碍的特征,有时是这些运动障碍的联合。在接受左旋多巴治疗的患者中,多达三分之一的人在治疗3年或之后会出现异动症,当然也有在使用左旋多巴10年或以上者,也可能不出现异动症。异动症的严重程度各不相同,有时轻微到患者甚至没有察觉。更严重的形式可能会使人丧失运动能力,并限制其可以使用的左旋多巴的量。
LID的发病机制涉及多巴胺代谢异常、谷氨酸能信号亢进、突触可塑性改变及遗传易感性等多因素交互作用。近年来,针对上述环节的干预手段(如新型受体调节剂、基因疗法及神经调控技术)展现出巨大潜力。
LID的病理机制新认知
多巴胺代谢失衡与脉冲式刺激
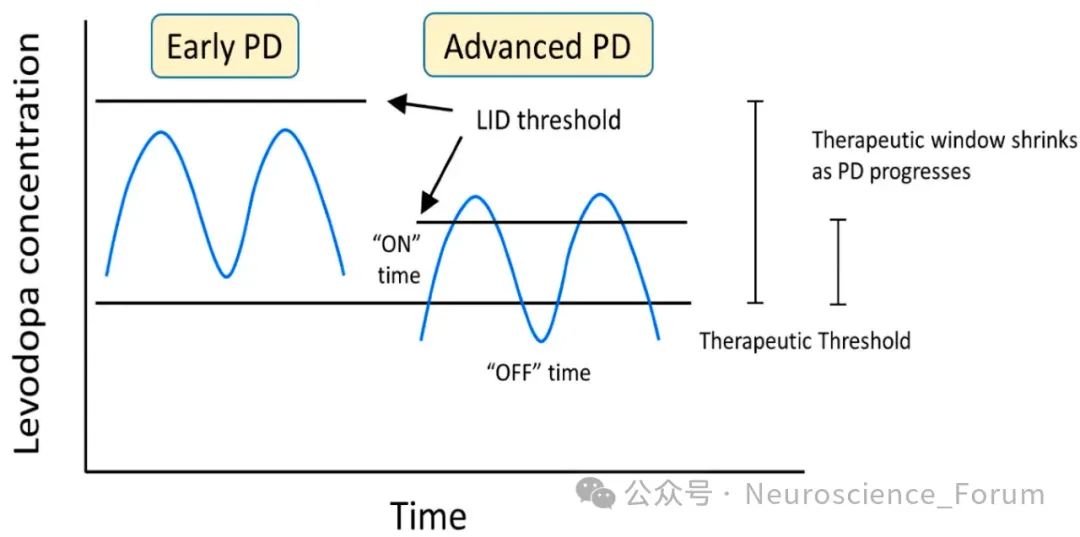
左旋多巴的半衰期短(1-2小时)导致间歇性给药引发纹状体多巴胺浓度剧烈波动。研究表明,持续多巴胺能刺激(Continuous Dopaminergic Stimulation, CDS)可通过皮下输注或长效制剂减少LID风险,而脉冲式刺激则激活纹状体D1受体下游cAMP/PKA/DARPP-32通路,诱导突触可塑性异常。
谷氨酸能系统过度激活
纹状体中型多棘神经元(MSNs)的NMDA受体(NMDAR)和代谢型谷氨酸受体(mGluR5)在LID中起关键作用。临床前研究发现,mGluR5拮抗剂(如Mavoglurant)可显著减少异动症发生,但需平衡潜在的认知副作用(Beaumont et al., 2021)。
非多巴胺能通路的作用
-
5-羟色胺系统:5-HT1A/1B受体激动剂(如Eltoprazine)通过抑制多巴胺溢出减轻LID,II期临床试验显示其安全性良好。
-
腺苷A2A受体:拮抗剂Istradefylline已被批准用于PD治疗,其与左旋多巴联用可减少异动症波动。
-
炎症与胶质细胞激活:小胶质细胞释放的TNF-α和IL-1β通过NF-κB通路加剧纹状体神经元兴奋性,抗炎治疗或成新靶点。
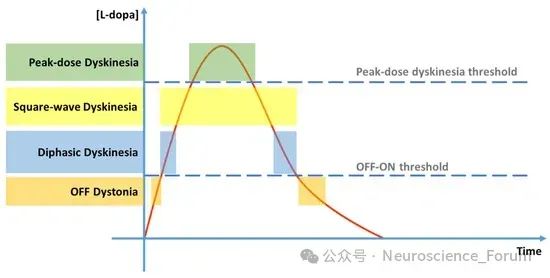
LID的临床分型与生物标志物
临床表型分类
-
剂峰异动症(Peak-dose Dyskinesia):最常见类型,与左旋多巴血药浓度峰值相关。
-
双相异动症(Diphasic Dyskinesia):出现在药物浓度上升或下降期,提示多巴胺受体敏感性差异。
-
肌张力障碍型异动症:多见于“关”期,可能与胆碱能系统失调有关。
生物标志物研究进展
-
影像学标志物:PET显像显示纹状体D1受体过度激活与LID严重度正相关。
-
体液标志物:血浆中miR-181a和miR-30b表达水平可预测LID风险。
-
电生理标志物:皮质-纹状体θ波同步化增强与异动症发作相关。
治疗策略的创新与挑战
药物干预
-
多巴胺能药物优化:微泵持续输注左旋多巴/卡比多巴凝胶(Duodopa®)或长效D2/D3受体激动剂(如Pardoprunox)。
-
谷氨酸受体调节剂:NMDAR亚基GluN2B选择性拮抗剂(如Radiprodil)进入III期临床试验。
-
腺苷A2A受体拮抗剂:联合用药降低左旋多巴剂量依赖性异动症。
基因与细胞疗法
-
AAV介导的基因治疗:向纹状体递送谷氨酸脱羧酶(GAD)基因,促进GABA合成以抑制过度兴奋。
-
诱导多能干细胞(iPSC)移植:分化为多巴胺能神经元并实现稳定递质释放,减少脉冲刺激。
神经调控技术
-
深部脑刺激(DBS):丘脑底核(STN)刺激联合药物调整可使LID严重度降低60%(Schuepbach et al., 2023)。
-
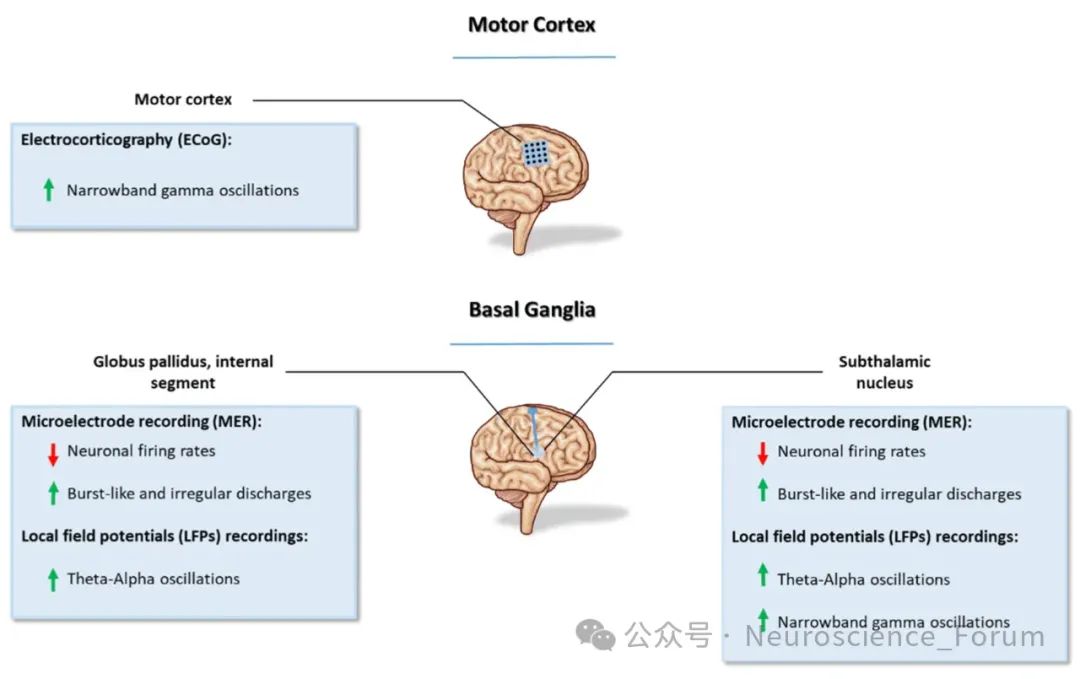
闭环自适应DBS:实时监测局部场电位(LFP)β波振荡,动态调整刺激参数以抑制异动症。
未来研究方向
个体化治疗:基于基因组学(如DRD3 rs6280多态性)和代谢组学标志物分层治疗。
表观遗传调控:靶向DNA甲基化或组蛋白修饰逆转异常突触可塑性。
人工智能辅助管理:利用机器学习预测LID发作并优化给药方案。
结论
LID的病理机制研究已从单一多巴胺能理论转向多系统交互网络视角,新型靶向药物和神经调控技术为临床管理提供了更多选择。未来需通过跨学科合作推动转化医学研究,最终实现PD治疗的精准化和个体化。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言



















#帕金森病# #异动症#
33 举报