Mol Cancer:中南大学赵璐晴/毛弈韬合作阐述RNA甲基化修饰与肿瘤免疫新进展
2024-07-25 iNature iNature 发表于上海
该文章中讨论了几种RNA甲基化的机制和功能,全面概述了它们在肿瘤微环境和免疫细胞中的生物学作用和潜在机制。
RNA甲基化是一种普遍存在的转录后修饰,已引起研究界的广泛关注。它通过调节RNA剪接、翻译、运输和稳定性来对多种生物功能进行调控。值得注意的是,研究已经阐明了RNA甲基化对肿瘤免疫的重大影响。RNA甲基化的主要类型包括N6-甲基腺苷(m6A)、5-甲基胞嘧啶(m5C)、N1-甲基腺苷(m1A)、N7-甲基鸟苷(m7G)和3-甲基胞苷(m3C)。有力的证据强调了RNA甲基化参与调节肿瘤微环境(TME)。通过“写入器”、“擦除器”和“读取器”影响RNA翻译和稳定性,RNA甲基化对免疫细胞和免疫因子的失调产生影响。因此,RNA甲基化在调节肿瘤免疫和介导各种生物学行为(包括增殖、侵袭、转移等)中起着关键作用。
2024年6月20日,中南大学赵璐晴及毛弈韬共同通讯在Molecular cancer 在线发表题为“The role of RNA methylation in tumor immunity and its potential in immunotherapy”的综述文章,该文章中讨论了几种RNA甲基化的机制和功能,全面概述了它们在肿瘤微环境和免疫细胞中的生物学作用和潜在机制。
通过探索这些RNA修饰如何介导肿瘤免疫逃避,还研究了它们在免疫治疗中的潜在应用。这篇综述旨在提供新的见解和策略,以确定RNA甲基化中的新靶点并提高癌症免疫治疗的疗效。

RNA修饰通过对RNA碱基和核糖的化学变化对基因表达产生重大影响。迄今为止,研究人员已经在原核生物和真核生物的各种RNA类别中发现了170多种化学修饰。其中,RNA甲基化占所有RNA修饰的60%以上,在转录后基因调控中起着关键作用。RNA甲基化的主要形式包括N1-甲基腺苷(m1A)、N6-甲基腺苷(m6A)、5-甲基胞嘧啶(m5C)、N7-甲基鸟苷(m7G)和3-甲基胞苷(m3C),突显了其在塑造复杂的基因调控格局中的广泛存在和重要性。
RNA甲基化由三种蛋白质介导:“写入者”,催化甲基的添加;“读取者”,识别这些修饰;RNA甲基化包括两个蛋白,即负责清除RNA的“橡皮擦”,每个蛋白都通过独特的机制发挥作用(图1)。这些蛋白调节多种RNA类型和信号通路,包括mRNA、tRNA、IncRNA、sRNA、siRNA、snRNA、snoRNA等。RNA甲基化是一个动态且可逆的过程,它调节剪接、翻译、运输和RNA稳定性等关键的生物学过程。大量研究表明,RNA甲基化在多种癌症的发展和进展中至关重要,包括乳腺癌、肺癌、结直肠癌(CRC)、肝细胞癌(HCC)、胃癌(GC)、食管癌(EC)、前列腺癌(PCa)、膀胱癌、卵巢癌、急性髓系白血病(AML)、胰腺癌等,突显了其在恶性肿瘤中的关键作用。
近年来,大量研究强调了RNA甲基化与各种免疫生物学过程之间的密切关联,特别是在肿瘤免疫的背景下。此外,调节蛋白的异常表达与致癌活性和增强的转移特性有关。RNA甲基化还在维持体内平衡和肿瘤微环境(TME)的代谢重编程中起着至关重要的作用,影响免疫细胞的功能。TME由复杂的多细胞基质组成,包括免疫细胞、基质细胞、细胞外基质、血管和其他可溶性因子。
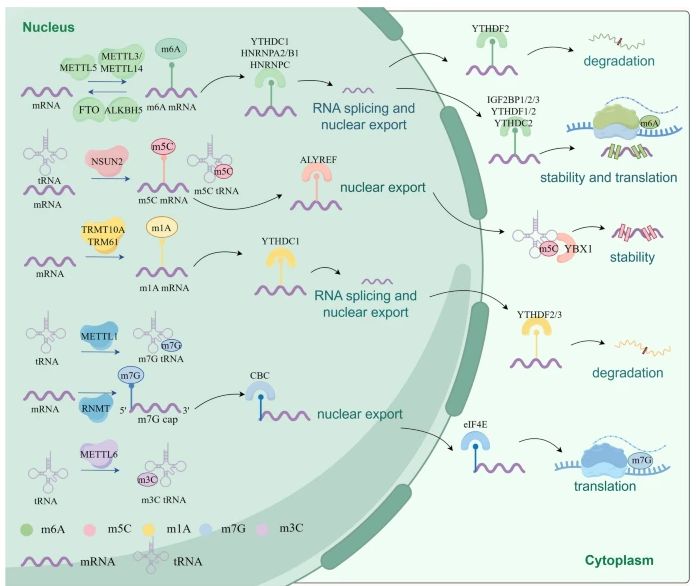
RNA甲基化的机制和受RNA甲基化调控的RNA命运(图源自Molecular cancer )
RNA甲基化通过影响致癌和转移能力、破坏TME和谐和损害免疫细胞功能,有助于肿瘤免疫逃避。例如,已知m6A编写器METTL3可维持高水平的糖酵解并诱导HCC中的代谢重编程。这种酶还影响巨噬细胞极化、树突状细胞活化、效应T细胞分化和增殖以及免疫检查点的表达。这些相互作用突出了RNA甲基化如何将TME和免疫细胞与肿瘤免疫逃避机制联系起来。目前,研究人员正在探索针对METTL3和其他RNA甲基化调节剂的潜在抑制剂,希望这些化合物可用于免疫疗法。
TME的成分表现出抗肿瘤或促肿瘤特性,并在肿瘤的起始、进展、侵袭和转移中发挥关键作用。RNA甲基化影响免疫细胞和TME内其他细胞成分的生物学过程。研究表明,针对这些调节蛋白可以显著促进癌症免疫治疗。免疫疗法旨在通过调节宿主免疫系统的免疫细胞来增强抗肿瘤免疫反应,从而帮助消除肿瘤细胞。关注TME内的免疫浸润已成为一种有前途的方法,可以决定性地改善癌症患者的临床结果。
RNA甲基化显著影响细胞代谢,在TME和免疫细胞中起调节作用,对肿瘤免疫至关重要。重要的是,它参与了各种人类疾病的发展和进展,包括AML、CRC、GC、胶质母细胞瘤(GBM)、肾细胞癌(RCC)、HCC等。本文将全面探讨RNA甲基化在肿瘤免疫中的作用及其在免疫治疗中的潜在应用。该讨论旨在为癌症诊断、治疗和预后的创新靶点的开发提供新的见解和策略。
参考消息:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02041-8
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肿瘤免疫# #RNA甲基化#
112 举报