J Hematol Oncol:首个人体试验揭示BTX A51在复发难治性骨髓增生异常综合征及急性髓系白血病中的潜力
2025-07-24 吾乃喵大人 MedSci原创 发表于上海
本研究是首次在人类中验证BTX A51这一联合CK1α及CDK7/9抑制剂的安全性和初步疗效的临床试验。
研究亮点
- 创新口服小分子BTX A51联合抑制CK1α及CDK7/9,能激活p53和抑制MCL1,促使白血病细胞凋亡。
- 31例复发/难治性AML及高危MDS患者接受BTX A51治疗,安全性良好,推荐2期剂量为21mg,显著激活p53并抑制MCL1表达。
- 在携带RUNX1突变患者中,BTX A51治疗显示更高的疗效,CRi率达30%,体外研究验证了其对RUNX1突变细胞的高效抑制及与阿扎胞苷、维奈克拉斯的协同作用。
近日,Journal of Hematology & Oncology杂志发表了关于BTX A51首个人体剂量递增I期临床研究结果。BTX A51是一种创新的口服多靶点抑制剂,能够联合抑制酪蛋白激酶CK1α及细胞周期蛋白依赖性激酶CDK7和CDK9,激活肿瘤抑制蛋白p53,抑制抗凋亡蛋白MCL1的表达,达到诱导白血病细胞凋亡的目的。这一研究针对复发/难治性急性髓系白血病(AML)及高危骨髓增生异常综合征(MDS)患者,测定BTX A51的安全性、药代动力学(PK)、药效动力学(PD)及初步抗瘤活性,为后续临床开发及联合治疗策略奠定了基础。
AML和高危MDS为遗传异质性极高的造血系统恶性肿瘤,临床预后极差。尽管前线治疗可实现形态学缓解,但约50%的AML患者仍会复发,二线治疗选择有限,2年生存率不足30%。对于携带IDH、FLT3等特异性突变者尚有靶向药物,而更多患者无特异性靶点,面临极其有限的治疗选项。高危MDS患者经甲基化治疗失败后中位生存仅5.6个月,进一步加剧了治疗难度。
在白血病细胞逃避免疫监测和治疗的机制中,抑制凋亡途径是重要因子。BCL-2家族成员特别是MCL1的过度表达,以及p53失活是主要的耐药机制。现有的BCL-2抑制剂如维奈克拉斯虽提升疗效,但耐药问题突出,往往与MCL1上调及p53功能缺失相关。p53在AML中多为功能性野生型但受MDM2/MDMX负调控,靶向这些负调控因子已成为研究热点。
BTX A51通过抑制CK1α,阻断p53的负调控,激活p53并下调MDM2表达;同时作为CDK7/9抑制剂,阻止转录起始及RNA聚合酶II延伸,抑制关键促癌基因如MYC、MCL1转录,实现对白血病干细胞的双重打击。多基因模型的动物实验表明BTX A51具备显著抗AML活性,具备快速“快速打击”机制,为临床应用提供理论依据。
本研究为一项多中心、开放标签、首个人体I期剂量递增临床试验。共纳入31例复发/难治性AML及高危MDS患者,年龄中位数75岁,绝大多数患者(97%)接受过含维奈克拉斯的治疗。BTX A51口服给药,剂量范围1-42mg,采用5天/周或3天/周不同时长给药方案,循环为28天。利用BOIN设计确定最大耐受剂量(MTD)及推荐II期剂量(RP2D)。研究评估安全性、耐受性、药代动力学和药效动力学指标,关键监测p53激活的生物标志物MIC-1及骨髓中p53、MCL1和RNA Pol II磷酸化水平的变化。并结合临床疗效指标(CR、CRi)及相关基因突变状况,尤重视RUNX1突变人群的应答情况。
体外及体外共培养系统合作进行了AML细胞系及患者原代细胞对BTX A51敏感性的评估及与维奈克拉斯、阿扎胞苷组合的协同作用分析。
研究结果
患者基线及治疗情况摘要
- 共31名患者(28例AML,3例高危MDS)
- 中位年龄75岁(22-84),55%男性
- 先前治疗:97%既往接受维奈克拉斯和甲基化抑制剂
- 41%首次诱导治疗失败,43%有多线治疗史
剂量方案涵盖1mg单独5天/周,至高剂量42mg 3天/周,含21mg 3天/周连续4周方案。中位治疗时间24天。
安全性分析
- 2例患者出现剂量限制性肝毒性(AST/ALT升高及肝衰),症状均于停药后缓解。
- 无治疗相关死亡。
- 42mg组停用,21mg 3天/周 4周为推荐II期剂量(RP2D)。
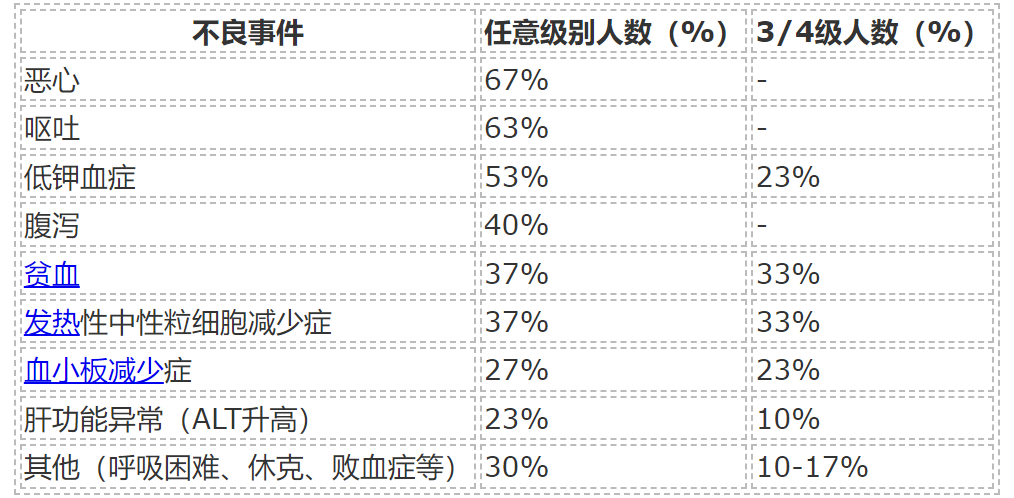
药代动力学与药效动力学
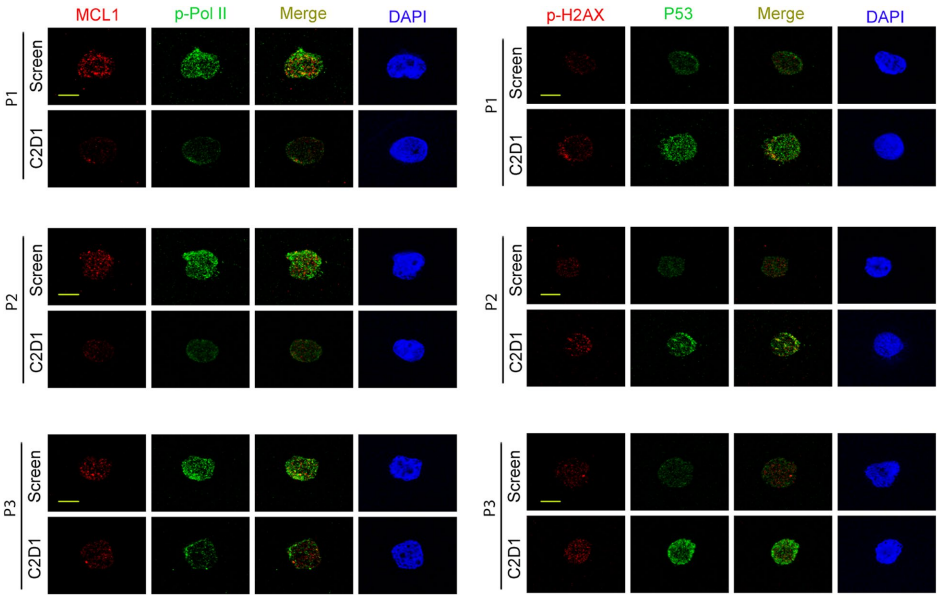
BTX A51快速吸收,4.5-6小时达峰,28小时半衰期,实现稳态血药浓度。MIC-1标志物检测显示治疗后p53显著激活。骨髓CD34+细胞免疫组化显示治疗后MCL1表达下降,RNA Pol II磷酸化减少,p53增高,DNA损伤标志物H2AX磷酸化增强。
临床疗效
- 3例患者(10%)达成CRi。剂量分别为11mg(1例)、21mg(2例)。
- CRi患者均携带RUNX1基因突变。
- RUNX1突变患者在11mg及以上剂量群中CR/CRi率达到30%。
- 大多数患者周边血白血病细胞在治疗第1周期显著下降(85%患者)。
- 5名患者骨髓肉芽细胞降低≥50%,全部为RUNX1突变患者。
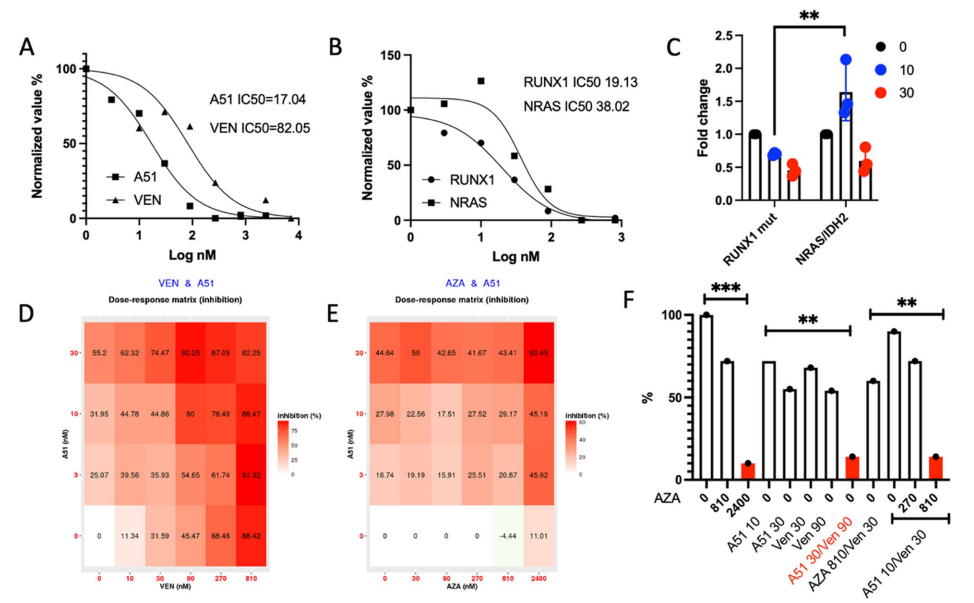
体外及体外共培养研究
- 在AML细胞系中,BTX A51抑制RNA Pol II CTD Ser2/Ser5磷酸化,降低MYC、MDM2和MCL1表达,激活p53及DNA损伤响应,诱导凋亡。
- RUNX1突变OCI-AML5细胞表现出p53介导的明显凋亡效应。
- 患者原代RUNX1突变AML CD34+细胞对BTX A51敏感性高于维奈克拉斯(IC50分别为17nM vs 82nM)。
- 与维奈克拉斯和阿扎胞苷组合显著协同抑制白血病细胞增殖,提示组合策略潜力。
总结
本研究是首次在人类中验证BTX A51这一联合CK1α及CDK7/9抑制剂的安全性和初步疗效的临床试验。该药通过双重机制:激活p53肿瘤抑制功能与阻断癌基因关键转录,显示出独特的抗白血病潜力。安全方面,BTX A51总体耐受良好,肝毒性可控,未见严重肿瘤溶解综合征。疗效层面,尽管总体反应率有限(10% CRi),但在RUNX1突变患者中获得了显著且有生物学基础的高应答率(30%),为该亚群提供了新治疗希望。鉴于RUNX1突变常伴预后不良,缺乏靶向治疗,BTX A51或成为重要新候选药物。
此外,BTX A51抑制MCL1及激活p53的作用机制,对于克服维奈克拉斯耐药尤为关键,也为后续联合阿扎胞苷、维奈克拉斯等方案提供科学依据。体外协同实验进一步支持组合策略展开临床验证。
综合而言,BTX A51既补充了AML/MDS治疗的新机制,也打开了基于基因特征精准治疗的方向,尤其针对RUNX1突变患者意义重大。研究结果激发了后续II期剂量及联合治疗方案设计,将提升复发难治白血病的疗效。
原始出处
Ball BJ, Xiao W, Borthakur G, et al. Phase I first-in-human dose escalation study of the oral casein kinase 1α and cyclin dependent kinase 7/9 inhibitor BTX A51 in advanced MDS and AML. J Hematol Oncol. 2025;18:73. https://doi.org/10.1186/s13045-025-01724-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#急性髓系白血病# #骨髓增生异常综合征#
15 举报