南华大学魏华/喻翠云/王俊团队AHM:自适应II型ICD铑配合物纳米平台用于成像导航的癌症免疫治疗
12小时前 BioMed科技 BioMed科技 发表于上海
研究开发出自适应铑(I)配合物纳米平台,可靶向内质网诱导 II 型 ICD,实现近红外成像导航免疫治疗,肿瘤抑制率达 91.2%。
研究背景
免疫原性细胞死亡(ICD)通过释放肿瘤相关抗原和损伤相关分子模式(DAMPs)来激活肿瘤特异性免疫反应,增强细胞毒性T淋巴细胞向肿瘤组织的浸润,最终将免疫抑制性“冷”肿瘤转变为具有活性反应的“热”肿瘤。ICD诱导剂根据间接或直接诱导内质网应激的作用机制分为I型和II型。相比于I型ICD诱导剂,II型ICD诱导剂通过选择性靶向能力直接触发内质网应激。值得关注的是,II型ICD诱导剂释放的DAMPs总体水平高于I型诱导剂,诱导的内质网应激作用更为显著。过去十年间,金属基ICD诱导剂(包括铂、钌、铱、金、锰和铜配合物)由于其独特的抗肿瘤免疫特性引起了广泛关注。然而,上述大多数金属ICD诱导剂都是光敏剂,需要克服激发光源的组织穿透深度受限问题。开发无需外源刺激的内质网应激诱导剂能够有效激发深部肿瘤组织的免疫反应。此外,肿瘤免疫治疗的另一个临床转化瓶颈在于缺乏实时监测技术。因此,影像导航的肿瘤免疫治疗备受期待,但鲜有报道。综上所述,开发一种具有增强免疫调节和影像导航特性的“一体化”金属基II型ICD诱导剂仍是一项重大挑战。

近日,南华大学药学院魏华教授、王俊副教授与湖南省中医药研究院喻翠云教授团队合作开发了一种亲金属相互作用驱动的自适应铑(I)配合物纳米平台(图1),该体系不仅可用于近红外(NIR)成像导航的癌症免疫治疗,而且作为铑(I)基ICD诱导剂的首次报道。具体而言,该体系利用癌细胞膜伪装的同源靶向能力实现肿瘤部位富集,增强活体肿瘤近红外磷光成像。随后,癌细胞通过内吞作用摄取该纳米颗粒,释放出抗肿瘤的铑(I)配合物单体。该单体可直接靶向内质网,诱导更有效的II型ICD效应,促进树突状细胞成熟和细胞毒性T淋巴细胞浸润,最终实现长效抗肿瘤免疫反应。值得注意的是,这种自适应功能开关特性极大地支持了该体系的近红外磷光成像和癌症免疫治疗效果,展现出显著的肿瘤抑制效果,肿瘤抑制率高达91.2%。本研究开发了一种简便而稳健的方法,制备具有可视化特性的“一体化”金属基ICD诱导剂,用于监测免疫治疗。相关工作以“A Self-Adaptive Rhodium(I) Complex-Based Nanoplatform with Type II Immunogenic Cell Death for Near-Infrared Phosphorescence Imaging and Cancer Immunotherapy”为题发表在《Advanced Healthcare Materials》上。向往、何穗穗为共同第一作者,王俊副教授、喻翠云教授、魏华教授为共同通讯作者。
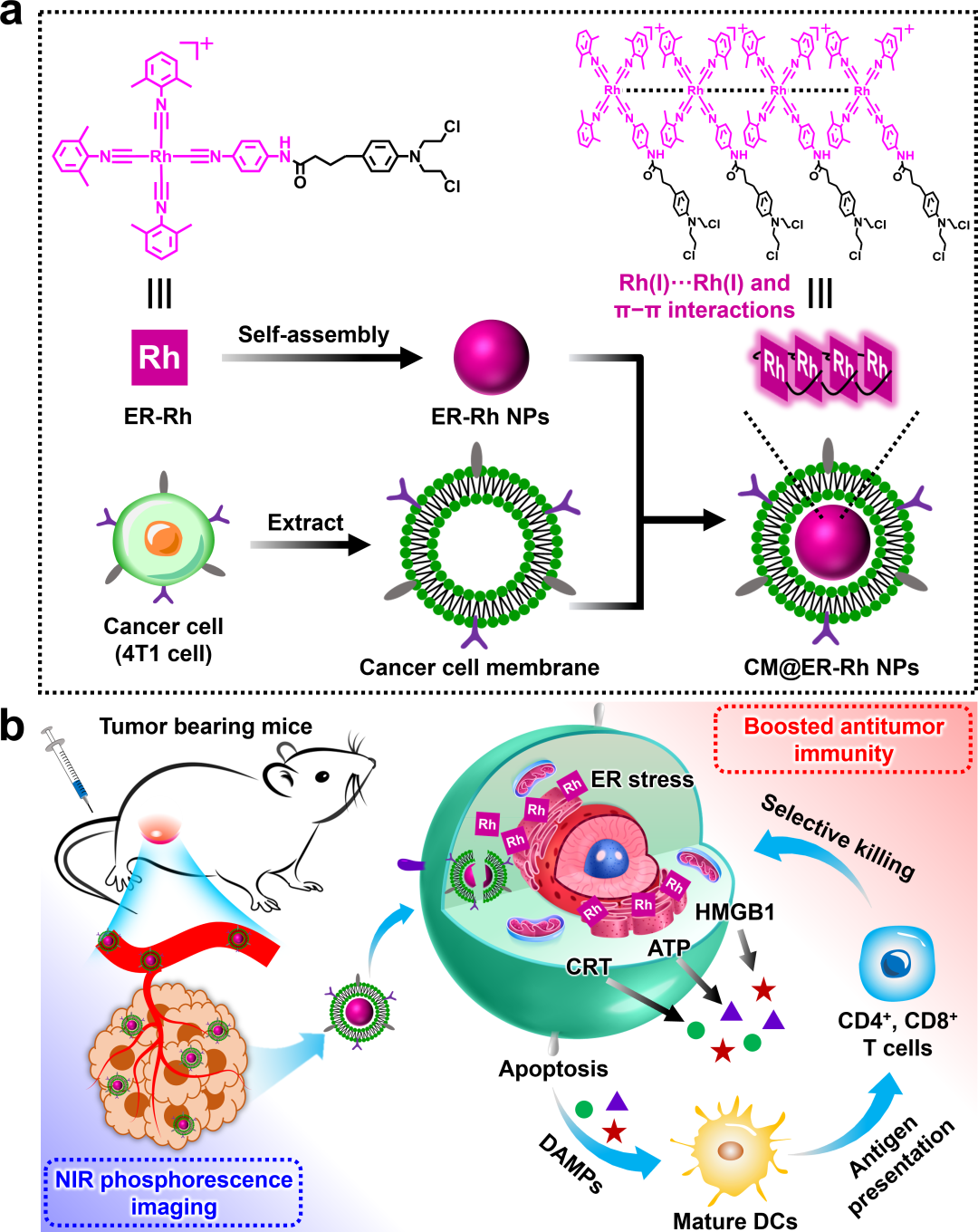
图1.(a)CM@ER-Rh NPs的制备过程及其用于增强近红外磷光成像和癌症免疫治疗示意图(b)。
本研究成功合成N,N-双(2-氯乙基)-氮烷衍生物修饰的四(芳基异氰)铑(I)配合物(ER-Rh),该铑(I)配合物依靠其独特的亲金属相互作用,即Rh(I)···Rh(I)相互作用,在水中可自发形成聚集体,并激活显著的近红外磷光发射(图2a-c)。进一步利用4T1细胞膜包裹ER-Rh NPs制备CM@ER-Rh NPs(图2d-h)。值得注意的是,与ER-Rh NPs在 1019 nm处的发射相比,CM@ER-Rh NPs在1038 nm表现出强烈的第二近红外(NIR-II)磷光发射(图2i)。使用积分球的绝对方法测定了ER-Rh NPs和CM@ER-Rh NPs的发射量子产率(Ф)分别为4.82%和4.35%。
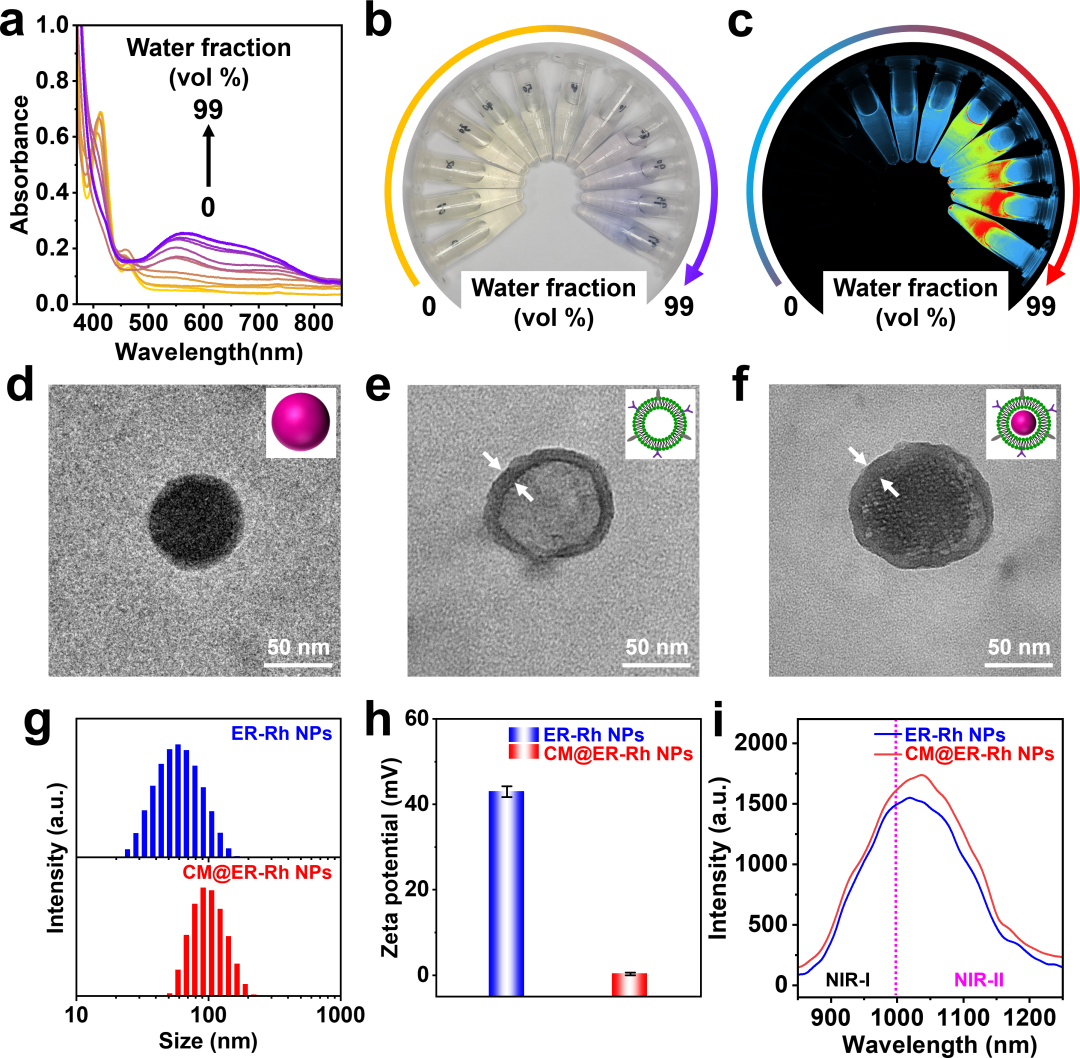
图2. CM@ER-Rh NPs的材料表征:(a)紫外-可见吸收光谱及其对应的(b,c)图片和近红外发光图像,(d-f)TEM图像,(g)尺寸分布,(h)zeta 电位变化和(i)发射光谱
MTT实验结果表明ER-Rh NPs和CM@ER-Rh NPs对MDA-MB-231、BEL-7404、Hela和4T1细胞的半数抑制浓度(IC50)在6.13-16.75 μM之间,均低于顺铂(13.21-31.13 μM)(图3a)。ICP-MS结果表明CM@ER-Rh NPs可通过癌细胞膜的同源靶向效应的增强在癌细胞中的内化,从而促进更多ER-Rh单体的释放。进一步基于内质网特异性靶向作用,实现高效局部积累(图3b,c)。利用DCFH-DA来研究细胞内ROS水平,ER-Rh NPs和CM@ER-Rh NPs均表现出明亮的绿色荧光,而顺铂处理组仅观察到微弱的荧光(图3d),表明内质网靶向的ER-Rh能够有效地诱导原位ROS生成。蛋白质印迹分析证实,CM@ER-Rh NPs处理组的CHOP和p-eIF2α表达水平最高(图3e,f),这表明内质网定位和同源靶向能力的协同作用导致了最强的内质网应激。
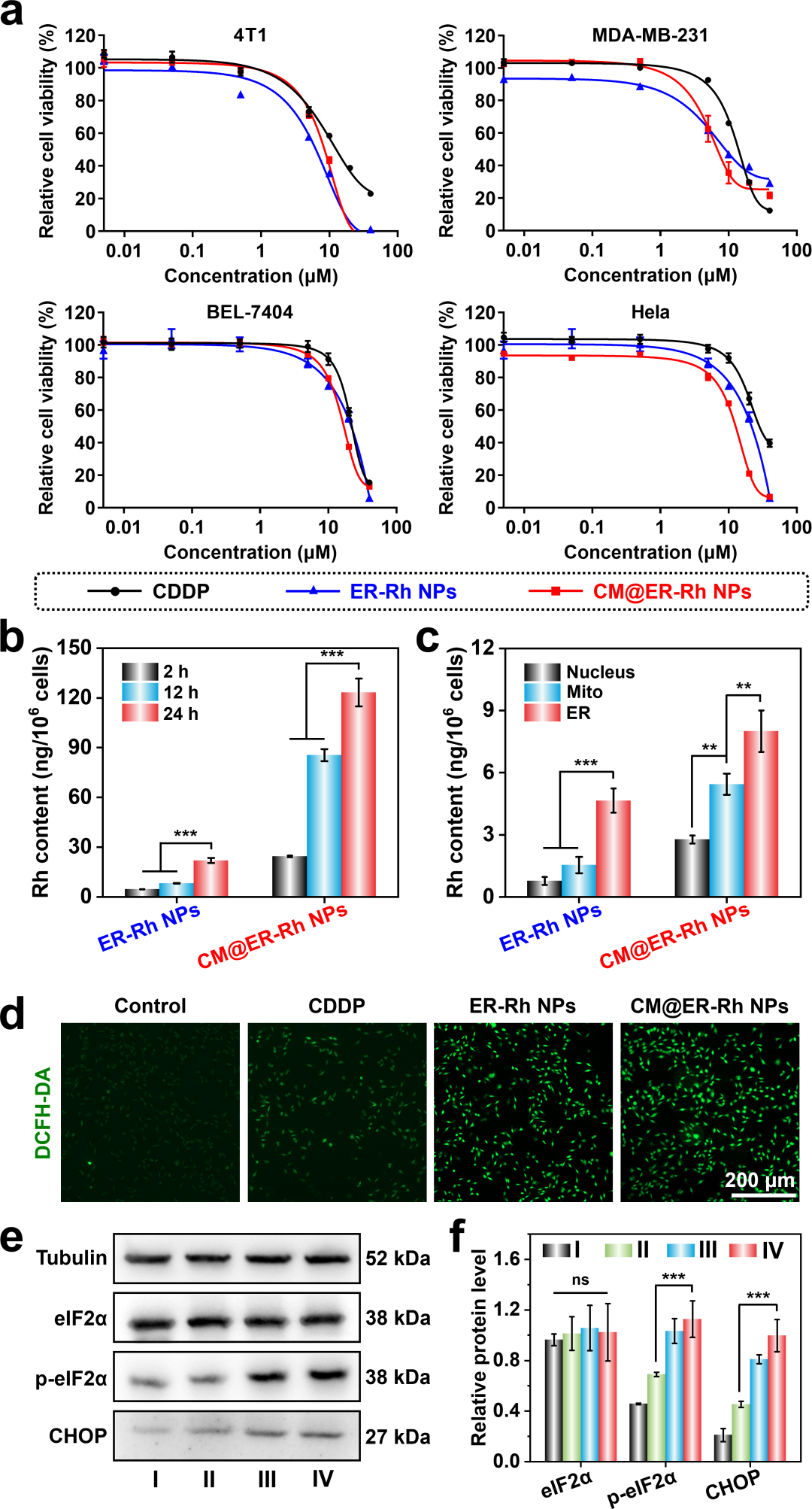
图3. 细胞摄取和体外抗癌活性
通过监测CRT暴露、HMGB1和ATP释放,评估了作为II型ICD诱导剂的靶向内质网的Rh(I)基纳米颗粒的体外ICD效应。结果表明,由CM@ER-Rh NPs引发的增强的ICD效应,这归因于其对内质网定位和同源靶向的协同作用(图4a-f)。随后,进行了体外DC成熟实验以评估不同处理方式对ICD效应的影响。从C57BL/6J小鼠中提取骨髓来源的树突状细胞(BMDCs),然后将其与经过不同处理的4T1细胞上清液共同孵育(图4e)。正如预期,CM@ER-Rh NPs处理组的DC成熟率从对照组的15.0 ± 0.8%显著增加到33.0 ± 1.0%(图4g,h)。这些发现证实了级联靶向的CM@ER-Rh NPs能够在低浓度(5 μM)下有效触发ICD以促进DC成熟,这为增强抗肿瘤免疫激活奠定了坚实的基础,从而确立了其作为出色免疫激活剂的潜力。
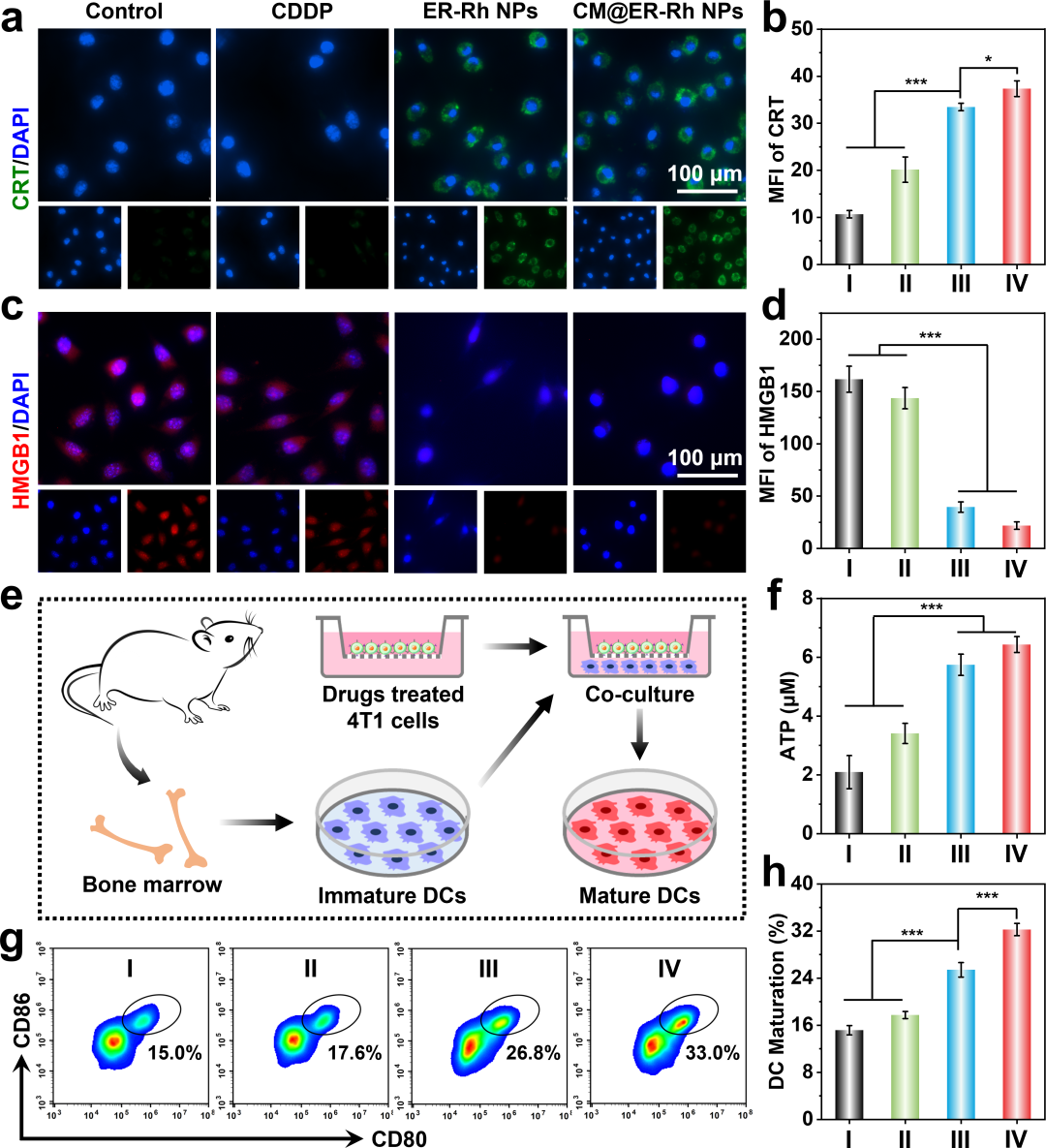
图4. 体外ICD诱导和DC成熟
受这些基于铑(I)的纳米粒子出色的近红外磷光特性和高效诱导的内源性化学发光的鼓舞,进一步研究了它们在体内磷光成像和免疫治疗方面的潜力。结果表明,ER-Rh NPs和 CM@ER-Rh NPs在注射后24小时在肿瘤部位均表现出最大发光信号,且CM@ER-Rh NPs处理组的信号强度比 ER-Rh NPs高1.69倍,表明通过涂覆肿瘤细胞膜显著增强了肿瘤积累(图5a,c)。在确认了CM@ER-Rh NPs具有出色的肿瘤靶向性和体内近红外磷光成像能力之后,进一步研究了其在移植了4T1细胞的BALB/c小鼠中的抗肿瘤效果。PBS处理的小鼠肿瘤体积持续显著增大,而其他不同处理组的小鼠则表现出不同程度的肿瘤生长抑制。值得注意的是,CM@ER-Rh NPs处理组表现出显著的抑制效果,肿瘤抑制率(TIR)为91.2%,显著高于顺铂处理组抑制效果(TIR为39.8%)(图5d,e)。
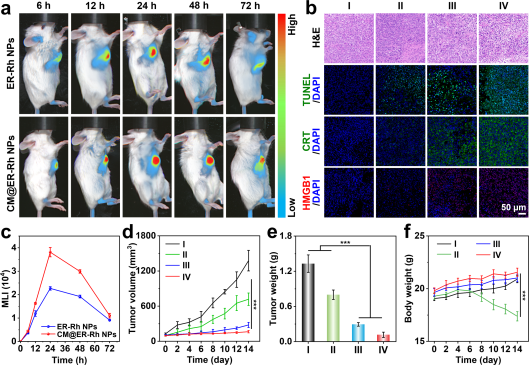
图5. 活体近红外磷光成像及抗肿瘤疗效
为阐明CM@ER-Rh NPs诱导的抗肿瘤免疫反应机制,首先进行了免疫荧光染色,以分析肿瘤组织中CRT和HMGB1的表达情况。CM@ER-Rh NPs处理组的CRT暴露水平和HMGB1 释放量最高(图5b),表明体内显著诱导了ICD效应,这与之前的体外ICD结果一致。此外,CM@ER-Rh NPs显著增加了成熟DC的比例(图6a-c)、CD8+ T和CD4+ T细胞的比例(图6b,d,e)。为了进一步确认CM@ER-Rh NPs是否能调节肿瘤免疫微环境中肿瘤相关巨噬细胞(TAMs)的极化,评估了肿瘤组织中M1巨噬细胞和 M2 巨噬细胞的存在情况。结果表明,CM@ER-Rh NPs处理组的M1/M2巨噬细胞的比例比PBS处理组高出1.93倍(图6f)。上述结果表明,CM@ER-Rh NPs有效地诱导了ICD效应,促进了DC成熟,调节了TAMs极化,并引发了强烈的抗肿瘤免疫反应。
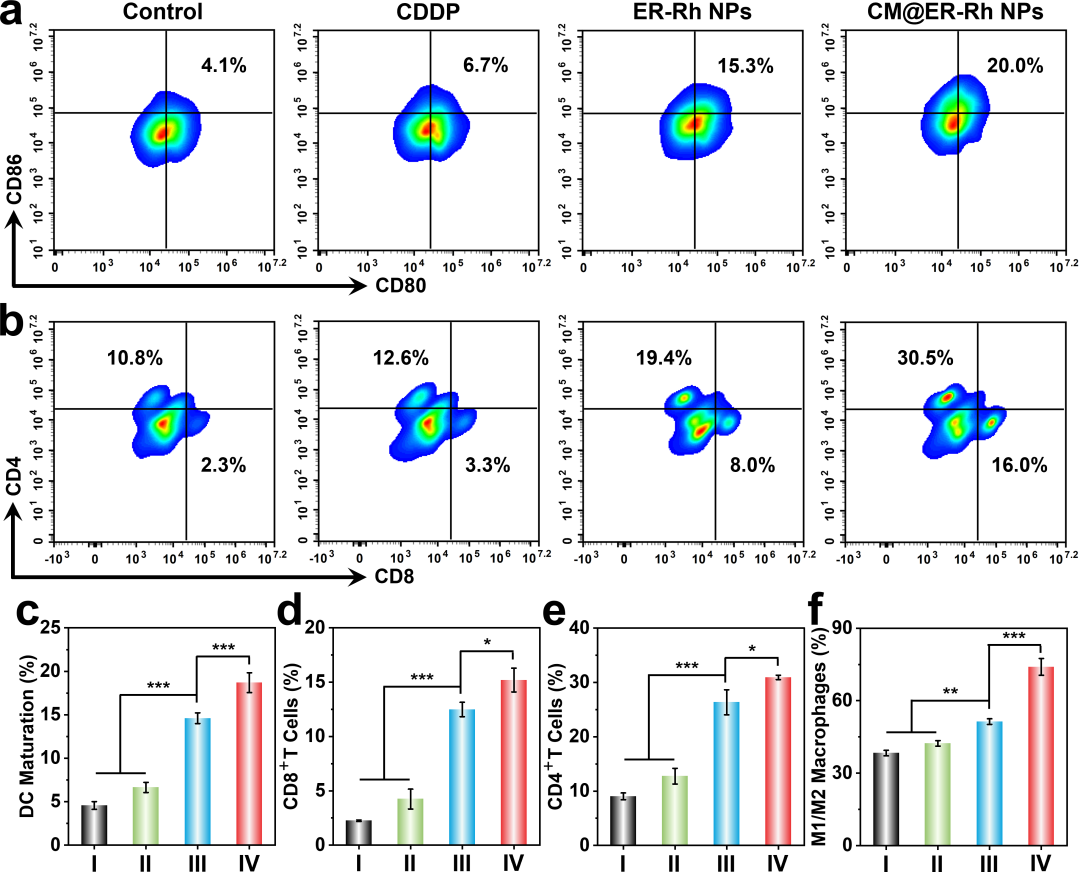
图6. 体内抗肿瘤免疫反应
为了评估免疫记忆在生成长期抗肿瘤免疫方面的效力,使用雌性BALB/c小鼠进行了疫苗接种实验(图7a),这种小鼠已被广泛认为是评估药物诱导ICD能力的金标准。如图7b-d所示,PBS和顺铂处理组由于4T1细胞的恶性增殖而表现出肿瘤加速生长。令人欣喜的是,CM@ER-Rh NPs处理组表现出显著的肿瘤抑制效果,其平均肿瘤体积比PBS处理组小9.2倍。值得注意的是,在CM@ER-Rh NPs和ER-Rh NPs处理组中,每组五只小鼠中有一只在第14天仍无肿瘤(图7f-i),这证实了经ER-Rh NPs或CM@ER-Rh NPs处理的ICD细胞能够作为有效的肿瘤疫苗,激发特异性抗肿瘤免疫反应,并形成持久的免疫记忆,以抵御肿瘤的复发和生长。在整个研究期间,所有小鼠的体重均保持稳定(图7e)。因此,CM@ER-Rh NPs不仅增强了对肿瘤细胞的直接杀伤能力,还有效地诱导了ICD效应,从而引发了强大的全身性抗肿瘤免疫激活。
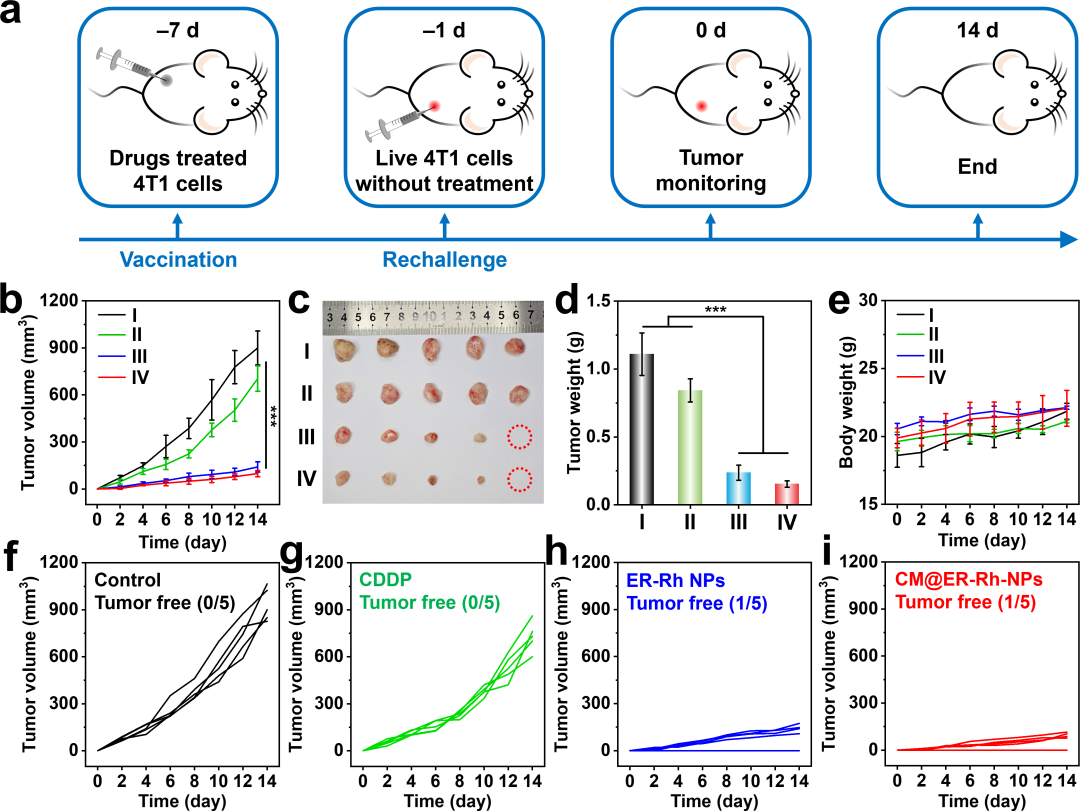
图7. 体内抗癌疫苗接种效果
文章结论与讨论,(未来)启发与展望
本研究首次成功构建了一种自适应的CM@ER-Rh NPs纳米平台,用于近红外磷光成像引导的癌症免疫治疗,这是首个铑(I)基ICD诱导剂的实例,其由分子定义明确的四(芳基异氰)铑(I)配合物构建而成。具体而言,CM@ER-Rh NPs利用由癌细胞膜伪装的同源靶向能力实现了高肿瘤富集,并基于Rh(I)···Rh(I)相互作用促进了体内近红外磷光成像性能。随后,肿瘤细胞通过内吞作用摄取该铑(I)基纳米平台,释放出抗肿瘤的铑(I)配合物单体,该单体可直接靶向内质网并诱导更有效的II型ICD效应,从而促进树突状细胞成熟和细胞毒性T淋巴细胞浸润,最终实现长效抗肿瘤免疫。这种创新的纳米平台不仅为设计高效金属基ICD药物提供了有价值的见解,还为明确定义的“一体化”诊疗纳米药物的临床应用引入了新的可能。
作者简介:
本文的通讯作者为南华大学药学院魏华教授、王俊副教授和湖南省中医药研究院喻翠云教授,南华大学向往和何穗穗为论文第一作者。
魏华,南华大学药学院教授,博士生导师,国家特聘青年专家,湖南省芙蓉学者特聘教授,主要从事面向肿瘤异质性的纳米递送系统的构筑和评价,主持国家自然科学基金项目、湖南省重点研发计划项目等课题。中国抗癌协会第二届肿瘤微环境专业委员会常务委员、中国生物材料学会生物医用高分子材料分会荣誉委员、ACS Biomaterials Science & Engineering期刊编委(2019-)、Fellow of International Association of Advanced Materials(FIAAM)(2020-)和美国斯坦福大学发布的“全球前2%顶尖科学家”。
喻翠云,教授,博士生导师。主持国家科技部重点研发计划项目课题、国家自然科学基金、湖南省重点研发计划项目、湖南省自然科学基金杰出青年基金等课题。先后荣获“全国三八红旗手”、“湖南省三八红旗手”、“湖南省最美科技工作者”和湖南省委组织部优秀中青年专家等荣誉。
王俊,副教授,硕士生导师。主要研究方向为超分子纳米诊疗及生物传感等方面的研究。主持国家自然科学基金青年项目、中国博士后面上资助、湖南省科技创新计划项目/省优秀博士后创新人才等课题。
原文链接:
https://doi.org/10.1002/adhm.202501871
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











前往app查看评论内容
3 0 举报