浙大医学院肖鹏/曹倩/温珍珍J Exp Clin Cancer Res:HDACi重塑巨噬细胞介导的肿瘤免疫微环境新机制
2025-03-07 BioMed科技 BioMed科技 发表于陕西省
该研究揭示了HDACi重塑巨噬细胞介导的肿瘤免疫微环境新机制。
近期,浙江大学医学院邵逸夫医院的肖鹏、曹倩、温珍珍合作在中科院一区杂志J Exp Clin Cancer Res上发表论文,揭示了HDACi重塑巨噬细胞介导的肿瘤免疫微环境新机制。徐旭涛为本文的第一作者,王茜茜、郭科为本文的共同第一作者;肖鹏为本文的通讯作者,曹倩、温珍珍为本文的共同通讯作者。

图1. 文章封面。
【文章背景】
近年来随着靶向治疗和免疫治疗策略的开发,有效地改善了一部分患者的生存期,然而它们在许多患者的治疗中仍面临耐药性和低应答率的问题。
组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors,HDACi)可通过提高染色质特定区域组蛋白乙酰化,从而诱导肿瘤细胞凋亡,成为一类已在临床上应用的靶向药物。然而,HDACi对实体瘤的低敏感性,且因机制不明,尚无合理的用药策略,极大限制其在临床上的广泛使用,成为领域内亟待解决的科学问题。
【文章内容】
在本研究中,作者首先发现巨噬细胞的浸润抑制了HDACi的疗效,而清除巨噬细胞后HDACi的抗肿瘤效果得到了明显提升(图1)。
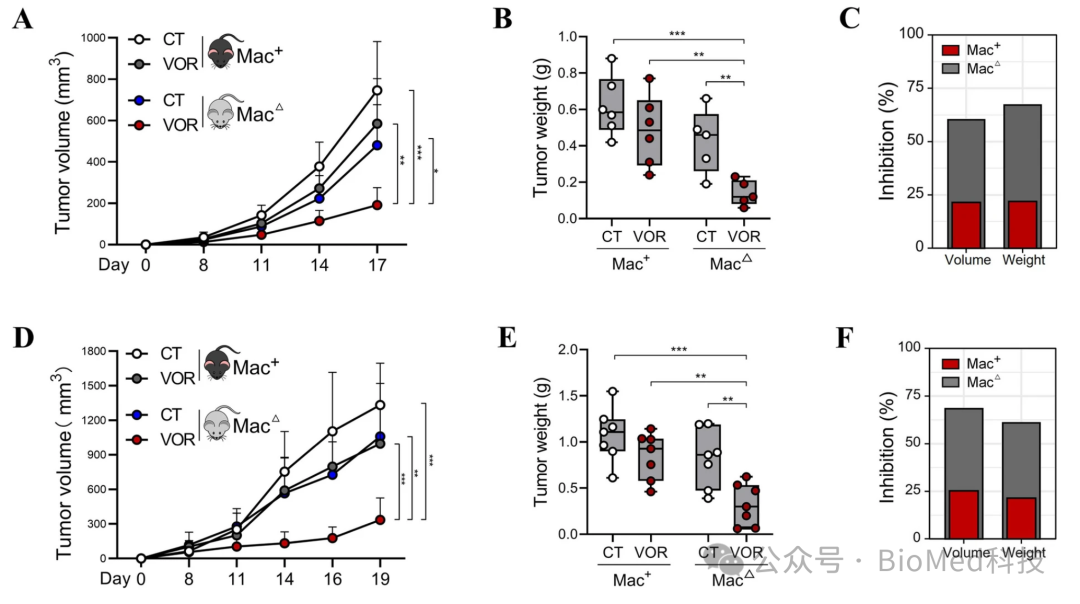
图1.
对其原因进行探究发现,HDACi干预导致肿瘤细胞CD47表达上升,与巨噬细胞表面SIRPα结合后抑制巨噬细胞对肿瘤细胞的吞噬性清除,因此限制了HDACi的疗效。而将CD47单抗与HDACi联用则能够逆转HDACi在肿瘤微环境中对巨噬细胞吞噬功能的抑制,打破HDACi耐药。另一方面,HDACi引起的肿瘤细胞CD47上调能够向巨噬细胞传递反向信号,从而增强其M2极化,抑制抗肿瘤免疫。将CD47单抗与HDACi联用则能够抑制M2极化(图2)。
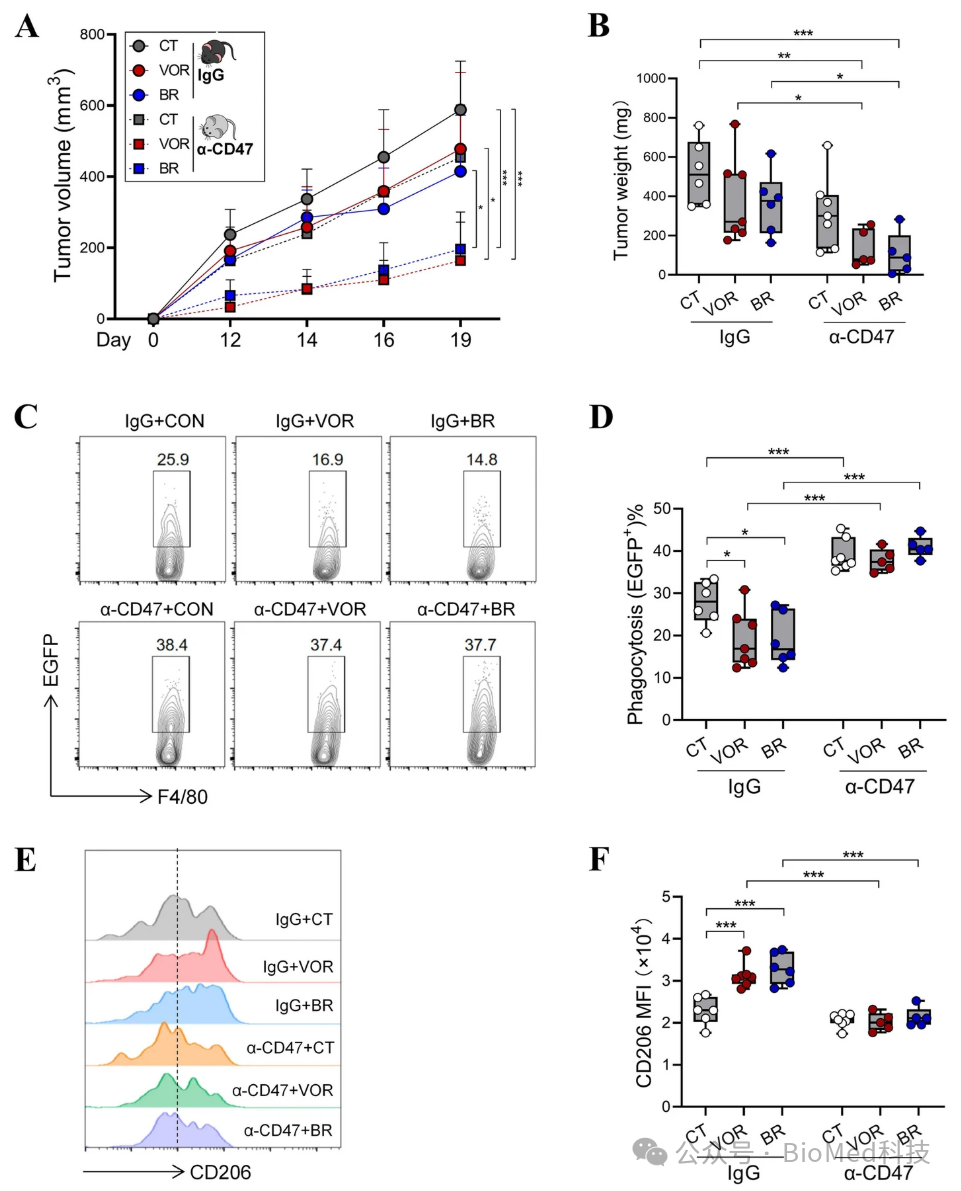
图2.
在分子机制层面,HDACi通过抑制CD47启动子区HDAC1-Sp1复合体的形成,增强这一区域H3组蛋白乙酰化水平和染色质开放程度,从而上调CD47表达(图3)。
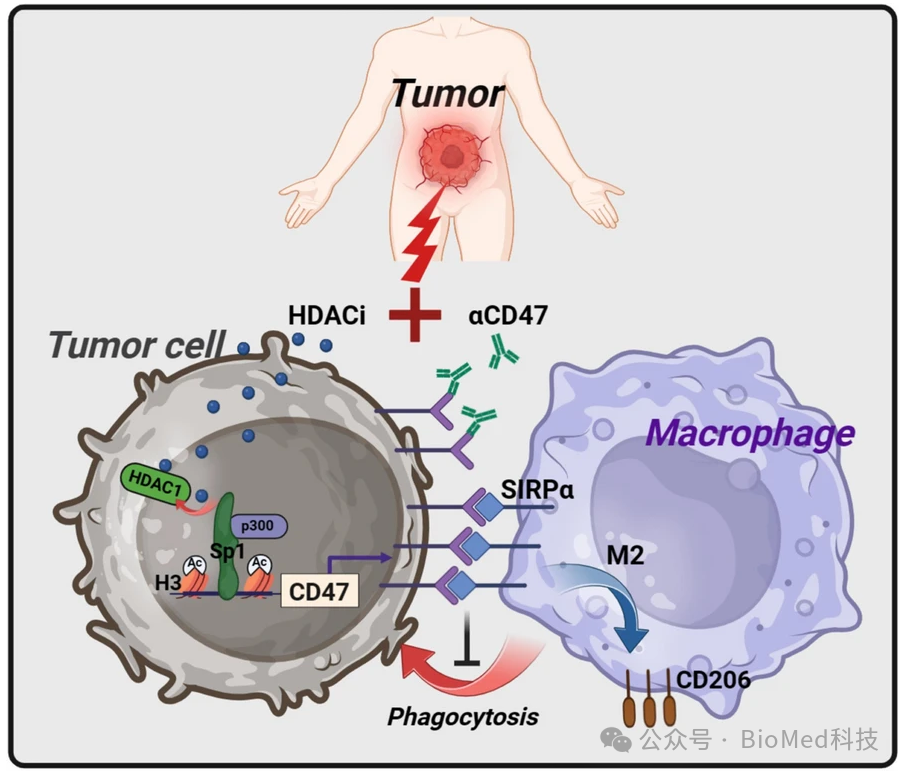
图3.
原文链接:
https://jeccr.biomedcentral.com/articles/10.1186/s13046-025-03335-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言




















#肿瘤免疫微环境# #组蛋白去乙酰化酶抑制剂#
25 举报