UGN-102膀胱灌注治疗低级别中等风险非肌层浸润性膀胱癌,1年CR率为82.3%
2024-06-15 MedSci原创 MedSci原创 发表于加利福尼亚
UroGen Pharma宣布其3期试验ENVISION的最新积极数据。分析显示,接受该公司在研疗法UGN-102治疗三个月后达到完全缓解(CR)的低级别中等风险非肌层浸润性膀胱癌(LG-IR-NMI
UroGen Pharma宣布其3期试验ENVISION的最新积极数据。分析显示,接受该公司在研疗法UGN-102治疗三个月后达到完全缓解(CR)的低级别中等风险非肌层浸润性膀胱癌(LG-IR-NMIBC)患者,在一年后无癌症进展的概率约为82.3%。UroGen已在今年1月开始向美国FDA滚动提交新药申请(NDA)。公司预计在2024年第三季度完成提交,FDA最早可能在2025年第一季度公布审评结果。根据新闻稿,UGN-102有望成为首个获FDA批准用于LG-IR-NMIBC患者的非手术治疗方案。

膀胱癌是一种常见的癌症。在全球范围内,每年大概有43万人被诊断出患有该疾病。NMIBC患者的癌细胞位于膀胱内或已长入膀胱内腔,但尚未扩散至肌肉或其他组织中。NMIBC占所有膀胱癌患者的比例为75-85%。NMIBC的管理指南建议将经尿道膀胱肿瘤切除术(TURBT)作为这类患者群体的标准治疗。然而多达70%的NMIBC患者在手术后经历至少一次复发,而LG-IR-NMIBC患者复发的可能性更高,并可能需要重复进行TURBT手术。目前美国FDA尚未批准任何药物用于LG-IR-NMIBC的主要治疗。
UGN-102膀胱灌注液是一种创新的丝裂霉素(mitomycin)药物。该疗法利用UroGen专有的RTGel技术,这种基于水凝胶的持续释放制剂可使膀胱组织能够更长时间地暴露于丝裂霉素之下,从而通过非手术手段治疗肿瘤。UGN-102可借由受过培训的医疗专业人员在门诊环境中通过标准导尿管给药。
3期临床试验ATLAS和ENVISION的顶线数据取得了积极结果。这些试验研究了UGN-102(丝裂霉素)在低级别、中等风险的非肌肉侵袭性膀胱癌(LG-IR-NMIBC)患者中的膀胱内溶液治疗。
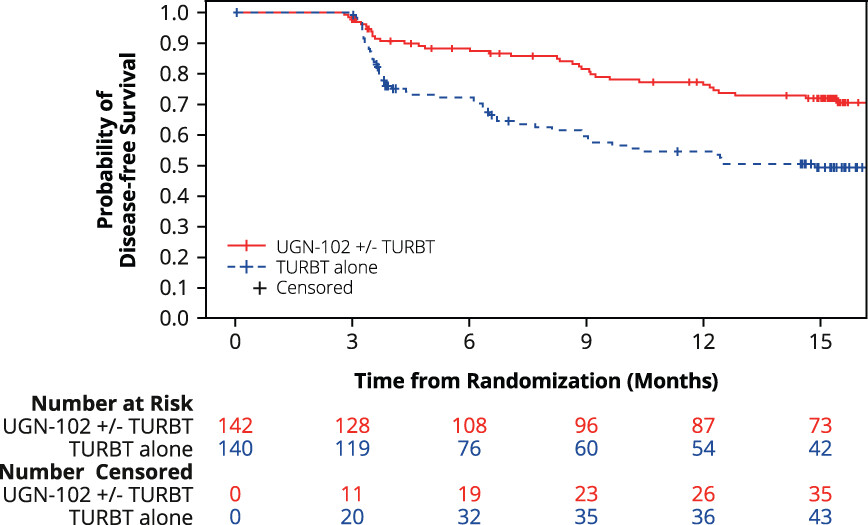
在ATLAS试验中,UGN-102达到了无病生存的主要终点,使复发、进展或死亡的风险降低了55%。对于仅接受UGN-102治疗的患者,三个月的完全缓解率为64.8%,而仅接受TURBT治疗的患者三个月的完全缓解率为63.6%。
ENVISION试验达到了其主要终点,显示接受UGN-102治疗的患者在初次治疗后三个月的完全缓解率为79.2%。预计2024年将提供更多评估ENVISION次要终点的持续缓解时间的数据,并向美国食品药品监督管理局(FDA)提交新药申请(假设获得更多积极结果)。
UGN-102 ATLAS和ENVISION顶线数据审查
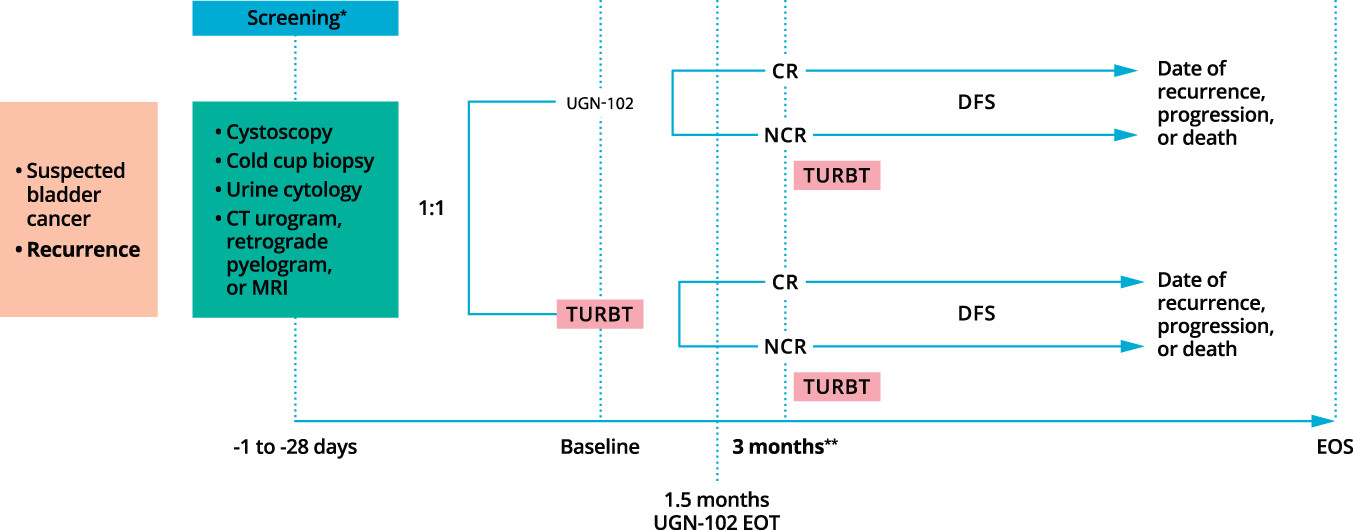
ENVISION试验是一项单臂、多中心的3期研究,旨在评估UGN-102膀胱内灌注液作为主要化学消融疗法,在LG-IR-NMIBC患者中的疗效和安全性,共有约240名患者入组。受试者接受每周一次UGN-102灌注共6次。主要终点为首次灌注后三个月的CR率,关键次要终点则评估达到CR患者随时间推移的疗效持续性。
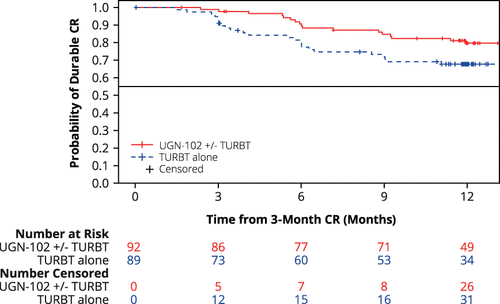
先前公布的试验结果显示,该试验达到主要终点,接受UGN-102治疗患者在首次灌注后三个月的CR率为79.6%(95% CI:73.9-84.5)。这次所公布通过Kaplan-Meier分析(n=108)的12个月缓解持续时间(DOR)数据显示,达到CR的患者中有82.3%(95% CI:75.9-87.1)在首次灌注UGN-102后持续缓解12个月。此外,在第15个月(n=43)和18个月(n=9)的DOR估计值均为80.9%(95% CI:73.9-86.2)。
ENVISION试验的安全性结果与之前的试验类似。最常见的治疗伴发不良事件(TEAE)包括排尿困难、血尿、尿路感染、尿频、疲劳和尿潴留。TEAE通常为轻度至中度。
在2023年7月时所公布另一项名为ATLAS的3期临床试验的数据显示,UGN-102达到了无病生存期的主要终点,使复发、疾病进展或死亡的风险降低了55%。在仅接受UGN-102的患者中,3个月时的CR率为64.8%,而仅接受TURBT的患者在3个月时的CR率为63.6%。
“UGN-102在多项临床试验中展示了强大且一致的治疗效果,提供了一个有力的前景,表明它有潜力成为一个变革性产品,并将治疗标准从反复手术转变为微创的非手术选项,适用于LG-IR-NMIBC患者。” UroGen的总裁兼首席执行官Liz Barrett表示,“如果获批,我们预计UGN-102将成为UroGen的一个重要增长驱动力,作为首个非手术治疗选项,每年约有82,000名美国新患者受到这种疾病的困扰。我们正在按计划实现此前对JELMYTO的指导,现在我们正站在膀胱癌护理新时代的门槛上,这令人非常兴奋。”
在两项试验中,UGN-102(一种设计用于延长膀胱组织暴露于丝裂霉素的持续释放水凝胶配方)总体上耐受良好,其副作用情况与此前的临床试验类似。
“尽管TURBT是膀胱癌的标准治疗方法,但LG-IR-NMIBC的复发性质意味着患者将进行多次手术,这对老年患者群体来说存在风险。”莫里斯敦医疗中心/大西洋健康系统泌尿生殖外科肿瘤学主任Sandip Prasad医学博士表示,“基于这些令人信服的数据,我乐观地认为,如果UGN-102获批,它可能会改变这些缺乏非手术选项来管理这种高度复发疾病负担的患者的治疗模式。”
3期ATLAS临床试验(ENVISION的前身)评估了UGN-102单独或与TURBT联合使用与单独使用TURBT在282名LG-IR-NMIBC患者中的疗效、持久性和安全性。
近年来针对NMIBC所开发的多项疗法皆有着积极进展。今年4月,美国FDA批准ImmunityBio旗下Altor BioScience所开发的白细胞介素-15(IL-15)超级激动剂Anktiva(nogapendekin alfa inbakicept)与卡介苗(BCG)联合使用,用于治疗对BCG无应答且伴有原位癌(CIS)的NMIBC成年患者。行业媒体Evaluate在今年初将这款疗法列为今年有望获批的10款潜在重磅疗法之一。该疗法的2/3期临床试验结果显示,患者的CR率为62%(95%CI:51,73)。此外,58%达成CR患者的DOR≥12个月,40%达成CR患者的DOR≥24个月。
今年5月,CG Oncology公司宣布其在研溶瘤病毒疗法cretostimogene,在治疗对卡介苗无应答的高风险(HR)NMIBC患者的3期临床试验中,75.2%(79/105)的患者达到CR,且29名患者维持CR超过12个月。这款疗法已经被美国FDA授予突破性疗法认定和快速通道资格。同月,强生(Johnson & Johnson)公布其在研膀胱内靶向释放疗法TAR-210用于治疗NMIBC患者的1期试验积极结果。在队列1组中21名HR-NMIBC患者中,12个月无复发生存率为90%。在队列3组中,31例患者可进行疗效评估,CR率为90%。
参考资料:
[1] UroGen Announces Unprecedented 82.3% Duration ofResponse at 12 Months in the ENVISION Trial Investigating UGN-102 asPotentially the First FDA-Approved Non-Surgical Treatment for LG-IR-NMIBC.Retrieved June 13, 2024 from https://investors.urogen.com/news-releases/news-release-details/urogen-announces-unprecedented-823-duration-response-12-months
[2] UroGen touts long duration of response for its bladder cancerchemotherapy gel. Retrieved June 13, 2024 from https://endpts.com/urogen-touts-long-duration-of-response-for-its-bladder-cancer-chemotherapy-gel/
[3] UGN-102, in Development as the Potential First Non-Surgical Therapyfor LG-IR-NMIBC, Met Primary Endpoints in Both Phase 3 ATLAS and ENVISIONClinical Trials. Retrieved July 27, 2023, from https://investors.urogen.com/news-releases/news-release-details/ugn-102-development-potential-first-non-surgical-therapy-lg-ir
Treatment of Low-grade Intermediate-risk Nonmuscle-invasive Bladder Cancer With UGN-102 Transurethral Resection of Bladder Tumor Compared to Transurethral Resection of Bladder Tumor Monotherapy: A Randomized, Controlled, Phase 3 Trial (ATLAS).J Urol. 2023 Oct;210(4):619-629
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#非肌层浸润性膀胱癌#
109 举报