Molecular Therapy: Nucleic Acids:FluoroDetect 双荧光系统突破核酸药物检测瓶颈,实现RNA干扰与反义寡核苷酸的实时动态监测与多平台分析
2025-07-22 熊佳仪 MedSci原创 发表于上海
研发了一种成本效益高、灵敏且可实时监测的双荧光报告系统——FluoroDetect,用于评估siRNA和反义寡核苷酸(ASO)介导的基因沉默效果。该系统支持快速靶点位点替换,兼容短期瞬时转染与长期稳定
近年来,基于核酸的疗法如小干扰RNA(siRNA)和反义寡核苷酸(ASO)在靶向肿瘤及罕见病治疗中展现巨大潜力,但其临床转化和开发仍深受功能性评价与递送效率检测技术的制约。针对这一瓶颈,研究人员开发了一种名为“FluoroDetect”的双荧光基因报告实验系统,此系统融合了红色荧光蛋白mCherry作为报告信号,绿色荧光蛋白eGFP作为内参信号,已完成对HSat3非编码RNA、热休克因子1(HSF1)及表皮生长因子受体(EGFR)等多个靶点的模型验证。FluoroDetect不仅实现了对细胞内核酸药物的时间动态监测,还支持多平台读出,满足药物筛选、功能验证及递送机制研究的多样需求。

自1998年RNA干扰(RNAi)机制被揭示以来,siRNA迅速成为基因调控及靶向治疗领域的关键技术。FDA自2018年批准首个siRNA药物Onpattro™起,全球已累计逾30种核酸类药物获批,逾千个研发项目驱动单基因病、感染及癌症治疗前沿。虽前景广阔,siRNA/ASO药物开发仍面临功能检测周期长、成本高及动态过程难以捕捉等障碍。传统蛋白质印迹(Western blot)、免疫荧光或荧光素酶报告系统往往依赖昂贵底物、终点测定方式,难以实现实时、连续监测,且操作繁琐、误差率高。尤其是在核酸药物递送评价环节,现有技术无法快速、精准地反映细胞内药物活性与效率,阻碍药物设计和优化。因此,建立一个经济、高通量且能区分不同siRNA单链及ASO功能的实时检测平台,成为极为迫切的需求。
RNAi主要通过双链siRNA引导RNA诱导沉默复合物(RISC)发挥功能,而ASO及gapmer通过形成RNA/DNA杂交引导RNA酶H裂解靶RNA或阻断转录翻译。两者均通过识别特异性互补序列实现靶向,可设计并插入到报告基因的5’或3’非翻译区进行活性反映。此前文献已报道单荧光信号检测的siRNA功能评价体系,但普遍缺乏对正、反义链区分能力及多功能的实时监测支持。
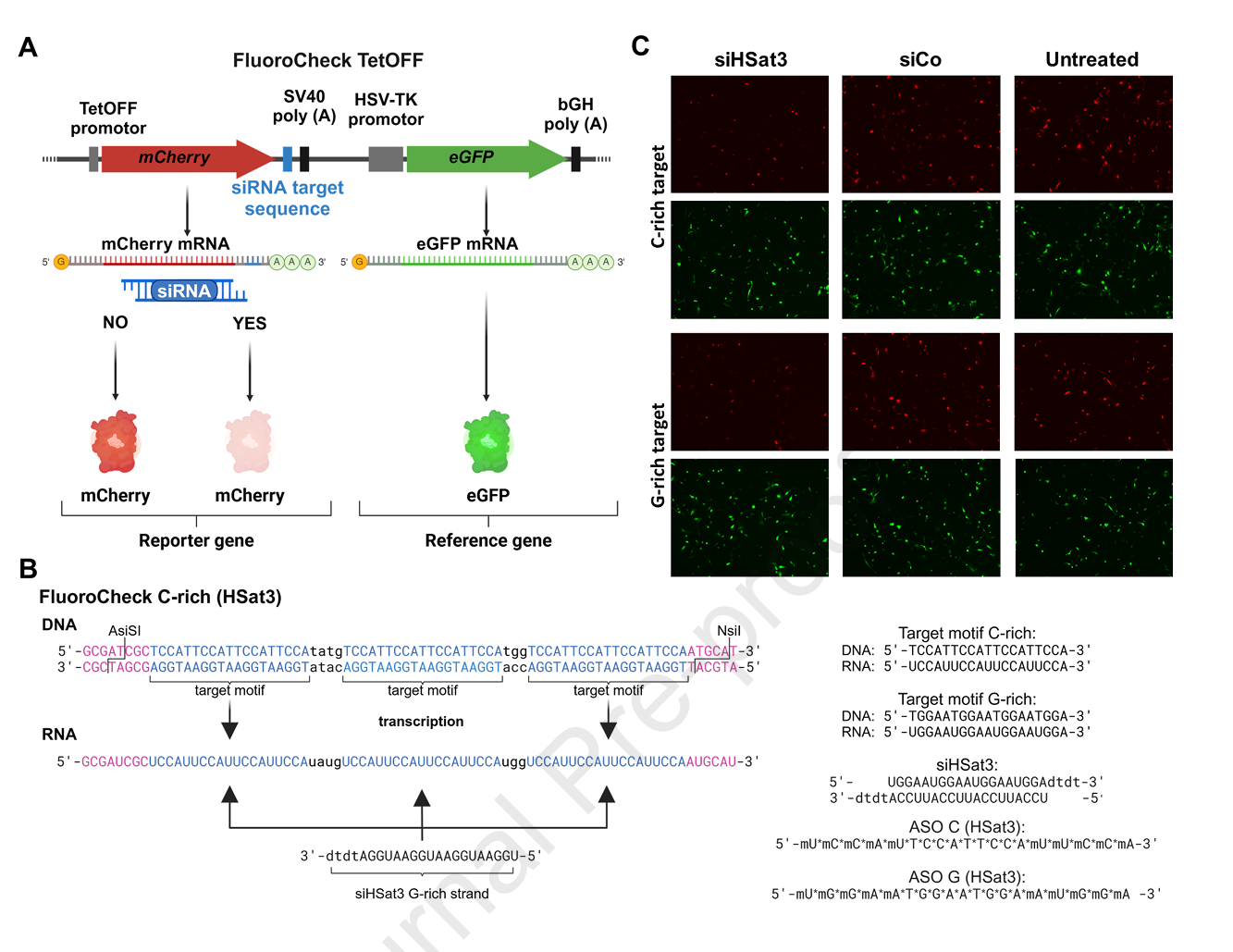
虽本研究侧重于技术平台构建与应用,不重点展开实验方法,但整体采用了In-Fusion克隆高效构建报告载体,将HSat3非编码RNA序列靶点嵌入mCherry基因3’UTR,配合TET-OFF启动子实现可控表达。此外,通过瞬时转染及慢病毒转导建立稳定荧光报告细胞系。siRNA及ASO化学修饰后经转染进入细胞,利用荧光显微、酶标仪及流式细胞术多通道检测红色报告信号与绿色内参比值,精确反映核酸药物介导的靶RNA沉默效果。
研究结果
1、荧光报告系统设计与验证
FluoroDetect设计了同时表达mCherry(红色报告荧光)与eGFP(绿色参考荧光)的双报告基因,其中mCherry的3’UTR插入了三个连续siRNA/ASO靶序列,且两端设置AsiSI和NsiI限制酶位点,便于快速替换靶序列。以HSat3 C-富集序列为例,实验显示特异siRNA处理48小时后红色信号显著降低,而绿色信号稳定无显著变化,体现内参可靠性及特异沉默效果。类似结果同样在G-富集序列、HSF1及EGFR靶点模型中获得,表明系统具有优良的适应性和特异性。
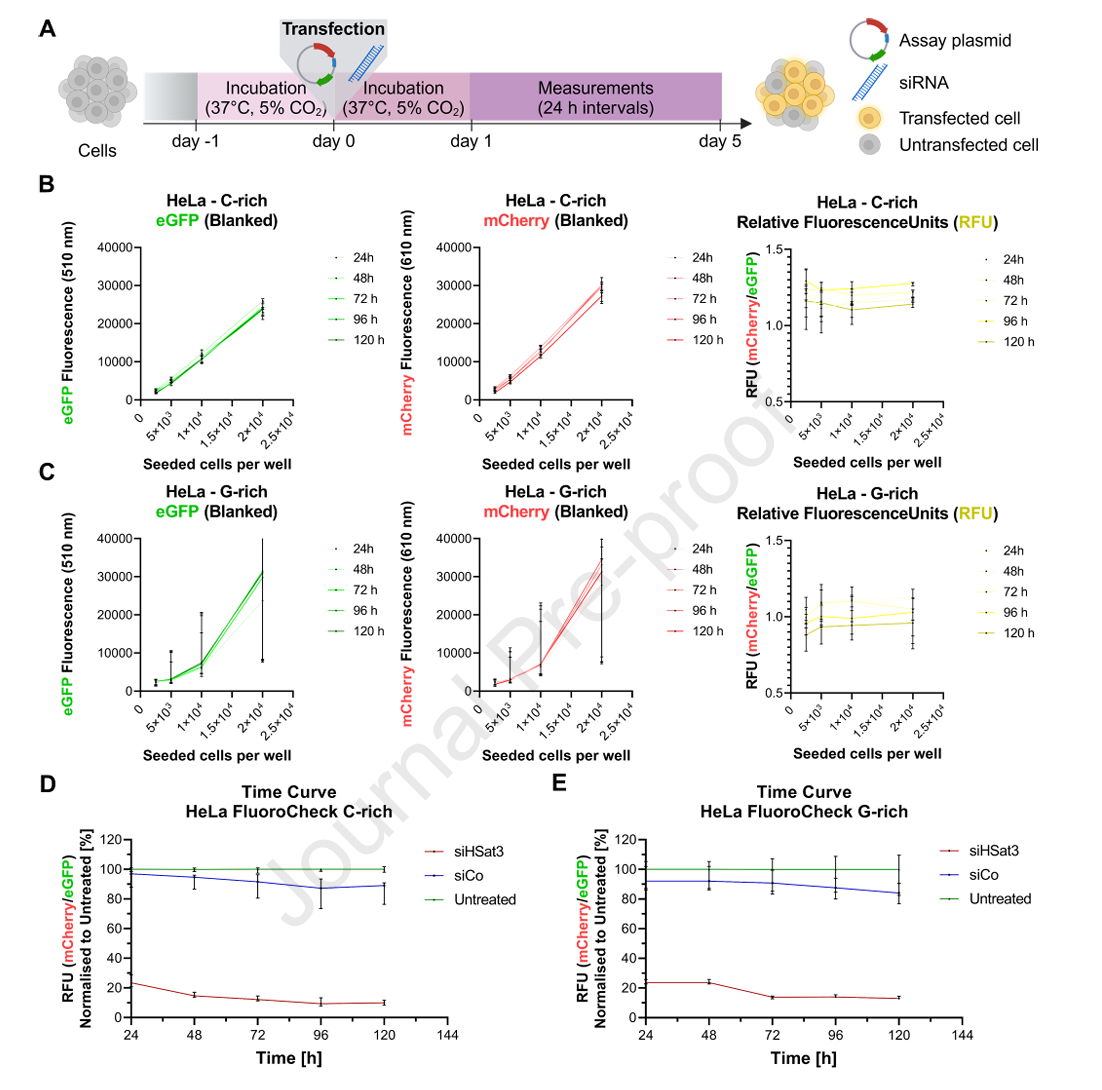
2、荧光信号的多平台实时定量能力
在不同肿瘤细胞系(HeLa、SW480、SW620)中,荧光强度随细胞数成线性比例,适宜细胞密度为1-2万/孔,以保证检测信号的稳定性及灵敏度。经siRNA/ASO转染,报告基因信号在人群中于72小时达到最强沉默峰值,且沉默效果可持续到5天以上,适合长时间动态监测。内参eGFP信号维持不变,为数据校准提供标准。
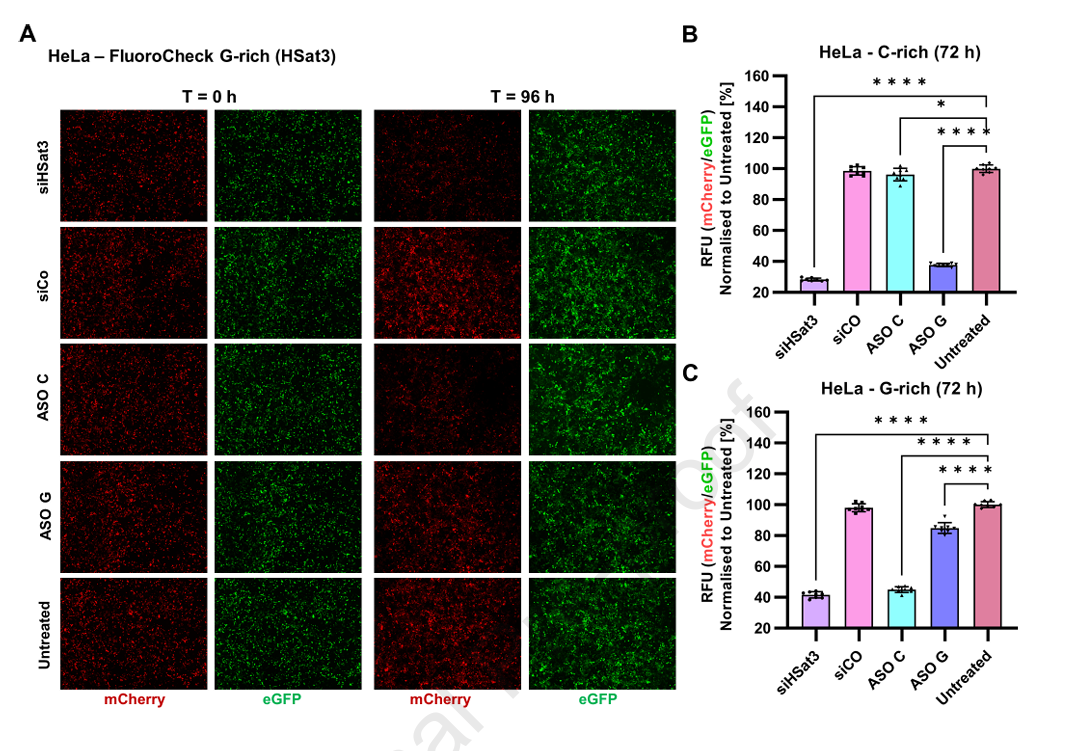
3、单链识别能力与ASO检测
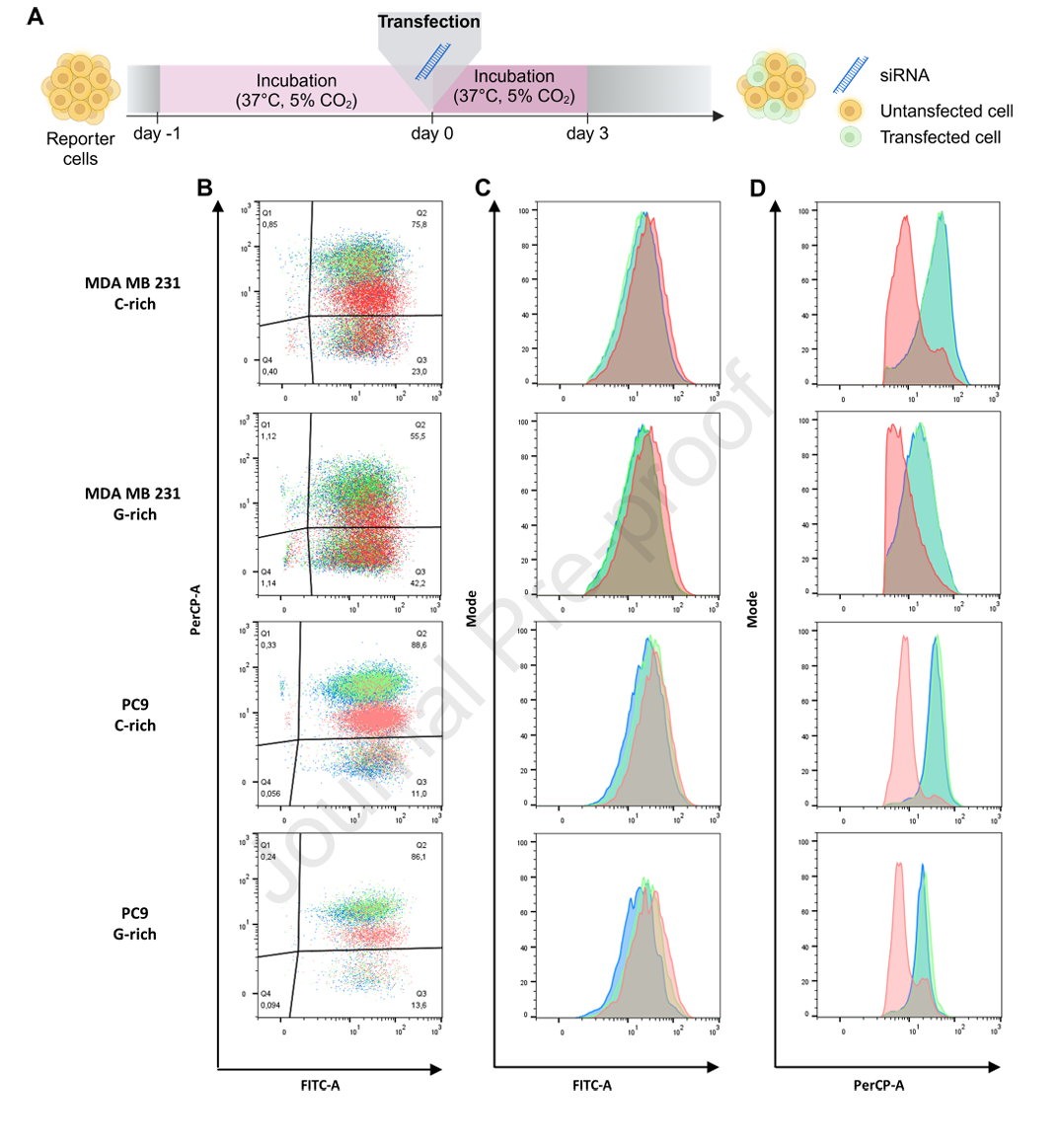
鉴于siRNA为双链结构,本平台成功区分了正义链与反义链的沉默活性。设计分别对应正链和反链的单链ASO(化学修饰后的gapmer),在G-富集报告模型中,仅与匹配靶序列的ASO能有效降低红色信号,非匹配ASO无效。此结果表明FluoroDetect不仅支持siRNA RISC依赖的沉默,还能用于ASO招募RNA酶H介导的沉默机制评估,极大拓宽了核酸药物筛查的范畴。
4、检测下限与定量界限的评估
通过对ASO的梯度浓度转染实验,制作了报告信号强度与核酸剂量的标准曲线。
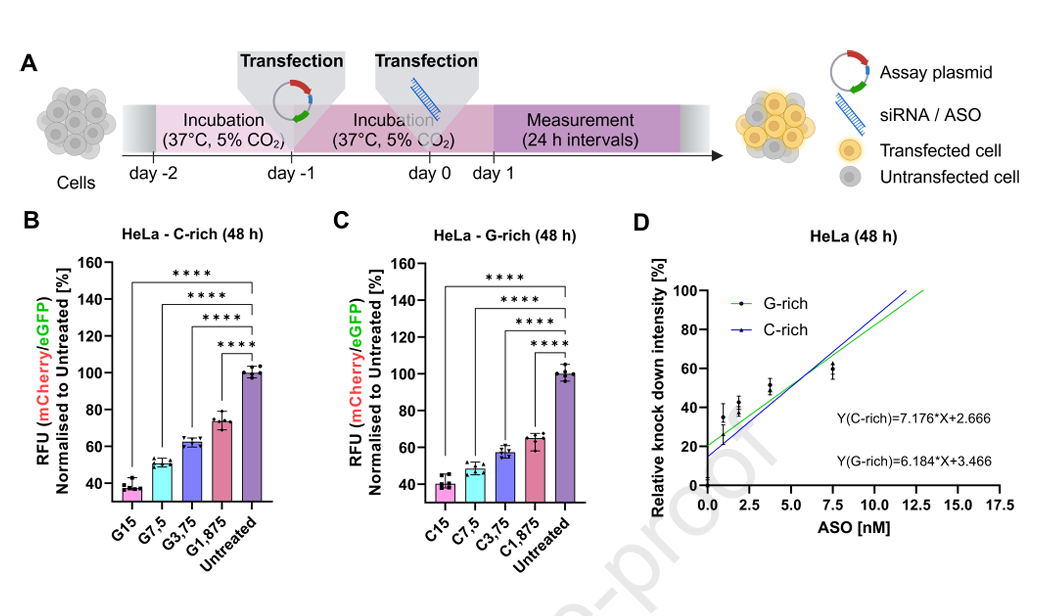
计算得出该系统的检测限(LOD)及定量限(LOQ)在不同细胞系间表现良好,C-富集序列的检测限中位数约为1.23 nmol/L,G-富集约1.85 nmol/L,定量限分别为3.7 nmol/L和5.6 nmol/L,能满足多种药物筛选和递送效率检测需求。
5、稳定细胞系构建及流式细胞术分析
采用慢病毒系统将报告基因构建入多种细胞系(HeLa、MDA MB 231、PC9、SW480),成功获得稳定表达的FluoroDetect细胞系。长期时间曲线显示siRNA介导的沉默效果持久(最长达14天),ASO介导的沉默则显现更快起效但持续时间稍短。
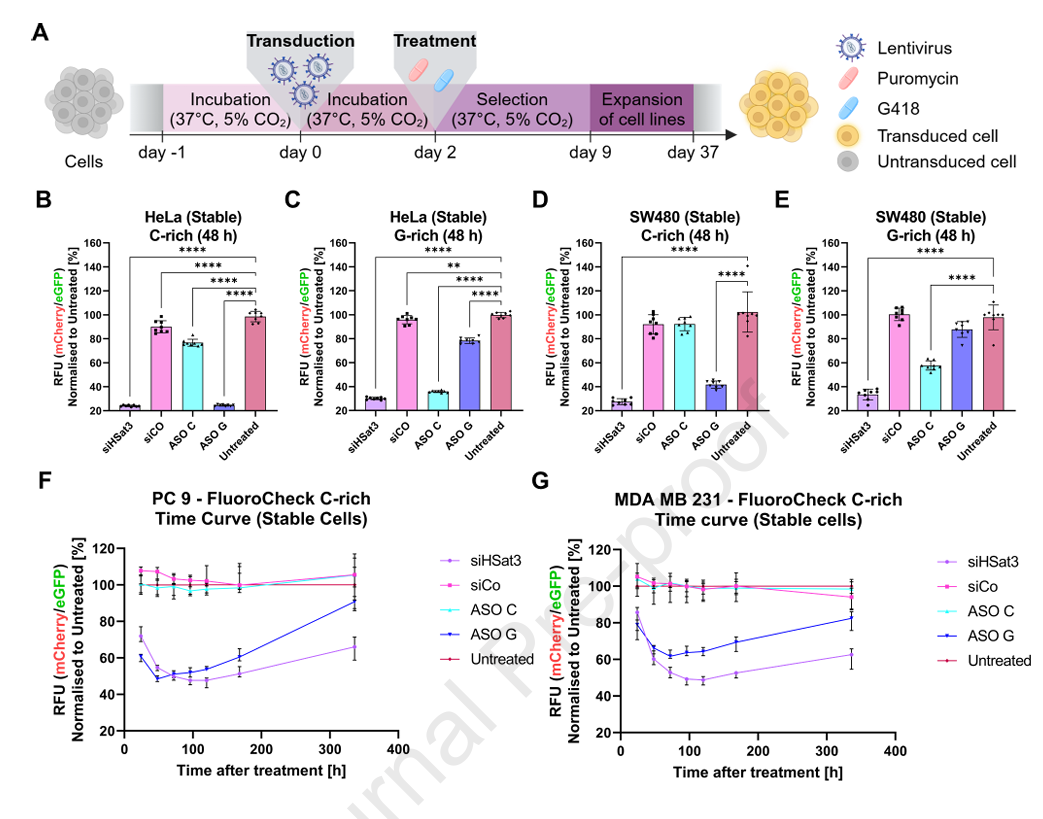
流式细胞定位分析稳定细胞群体中红色信号有效下调,绿色信号相对恒定,验证了系统的高特异性和可分类能力,适合高通量药物筛选与细胞异质性研究。
研究价值与意义
FluoroDetect系统以其双荧光设计突破了传统单信号检测的局限,不仅实现了经济且灵敏的核酸药物功能评价,也支持单链RNA药物的特异识别。在药物研发中,实时、动态捕捉siRNA与ASO介导的基因沉默进程对于药效验证、递送系统优化及毒性评估具有极大价值。相比传统蛋白质检测和终点式报告,FluoroDetect无需破坏细胞,支持活细胞实时观察,兼具通量高、成本低、易操作等优势。同时,稳定表达的细胞模型与多元读出技术(显微、酶标、流式)能够满足不同实验需求,为分子药理学、癌症生物学及转化医学研究提供强大工具。此外,该平台的快速克隆调整机制便于针对多种新靶点快速构建定制检测体系,提升RNA药物管线研发效率。
未来,结合体内成像技术和更深波段荧光蛋白的引入,有望拓展FluoroDetect至体内药物分布和药效动力学的分析,加速NA药物临床转化进程。
原始出处:
Heß F, Odenthal M, Wasserburger-Zichel E, Grimm C, Schweiger MR. Development of a dual fluorescence-based reporter assay for real time determination of siRNA and antisense oligo nucleotide mediated knock down. Molecular Therapy - Nucleic Acids. 2025. https://doi.org/10.1016/j.omtn.2025.102631

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#反义寡核苷酸# #siRNA#
6 举报