BRAF突变乳头状甲状腺癌预后更佳?大样本揭示:互斥性RET融合才是侵袭复发主因
10小时前 苏州绘真医学 苏州绘真医学 发表于上海
本研究旨在分析BRAF突变、RET融合与PTC侵袭性表型之间的关系,希望为BRAF和RET的基因型-表型关联提供新证据和潜在见解,并为BRAF突变相关的争议提供参考。
BRAF突变和RET融合分别是乳头状甲状腺癌(PTC)中最常见的点突变和基因重排。但BRAF突变对PTC表型、复发的影响及其与RET融合的关系尚未明确。因此,本研究旨在分析BRAF突变、RET融合与PTC侵袭性表型之间的关联。本研究为单中心、真实世界回顾性研究,纳入2018年7月至2021年10月期间在中山大学肿瘤防治中心接受初始手术治疗并进行基因检测的777例PTC患者。
BRAF突变阴性患者中,包括T、N分期较晚、淋巴结外侵犯(ENE)及复发在内的侵袭性表型发生率显著高于BRAF突变阳性患者。Kaplan-Meier生存分析显示,BRAF野生型患者的无复发生存期(RFS)更短。与RET融合阴性患者相比,RET融合阳性患者的侵袭性表型发生率更高,RFS可能更短。此外,BRAF突变阴性患者的RET融合发生率显著高于BRAF突变阳性患者。按RET状态分层的亚组分析显示,BRAF野生型与突变型队列在临床变量上无显著差异。在RET分层亚组中,BRAF突变阴性与阳性组的RFS率无显著差异。
PTC中BRAF突变与RET融合存在类似互斥的关系。RET融合与PTC侵袭性表型的关联更为密切。但该结论仍需更大样本量的研究进一步验证。
-
BRAF阴性患者比BRAF阳性患者具有更晚的T/N分期、更高的ENE和复发率以及更短的RFS;
-
RET融合与更大的肿瘤体积、更晚的分期、LNM及更差的RFS相关,其对侵袭性的影响超过BRAF;
-
RET融合在BRAF野生型患者中更常见,两者存在类似互斥的关系;
-
按RET状态分层后,BRAF突变的预后价值消失,提示RET融合是影响预后的主要因素。
研究背景
乳头状甲状腺癌(PTC)是甲状腺癌(TC)中最常见的病理类型,约占所有甲状腺癌病例的95%。由于恶性程度较低、进展缓慢且预后良好,PTC通常具有较高的治愈率。然而,部分病例会出现甲状腺外侵犯(ETE)、淋巴结外侵犯(ENE)、TNM分期较晚等高危病理特征,这些特征可能影响治疗效果、导致转移和复发,最终降低患者的长期预后和生活质量。
随着对PTC发生和进展机制的深入了解,研究发现基因变异与肿瘤生物学行为及疾病复发密切相关。在原发性PTC中,BRAF突变和RET融合分别是最常见的点突变和基因融合。已有研究表明,BRAF突变的PTC患者可能具有更强的侵袭性生物学行为和更高的复发风险,但这一结论尚未被学术界广泛认可。此外,部分研究指出,BRAF野生型与突变型肿瘤之间无显著差异,且基因型与表型的关联可能并非普遍存在,而与患者年龄相关。RET融合在儿童和青少年患者中尤为常见,除甲状腺癌和肺癌外,还可见于多种实体瘤,目前正成为极具潜力的“泛瘤种”靶向治疗生物标志物。与BRAF突变相比,关于RET融合在PTC中的研究结论更为一致——RET融合阳性的PTC患者更常出现分期较晚、广泛淋巴结肿大、生物学行为更差及肿瘤复发等情况。此外,既往研究认为PTC中BRAF突变与RET融合存在类似互斥关系,无重叠。但这一观点已逐渐改变,因为在部分具有特定临床病理特征的病例中,已观察到BRAF和RET双重变异同时存在。因此,BRAF突变与RET融合是否存在类似互斥关系(若存在,其影响如何体现)仍不明确,需进一步研究明确两者关系及可能的作用。
本研究旨在分析BRAF突变、RET融合与PTC侵袭性表型之间的关系,希望为BRAF和RET的基因型-表型关联提供新证据和潜在见解,并为BRAF突变相关的争议提供参考。
研究结果
基线特征与基因变异信息:
在777例PTC患者队列中,男性229例(29.47%),女性548例(70.53%)。体重指数(BMI)方面,66.92%的患者体重正常,24.20%超重,8.88%体重过轻。该队列中大多数患者的PTC处于T1期(78.76%),并已转移至中央区(N1a;33.98%)或侧颈区(N1b;27.03%),转移淋巴结数量中位数为1个(四分位数范围:0–5个)。114例患者(14.67%)检测到ETE,31例患者(6.69%)检测到ENE。本研究具体检测内容包括:BRAF 的 V600E 突变、RET 的 RET/PTC1-3 重排,以及 TERT 的 C228 和 C250 启动子突变。基因检测显示,最常见的突变是BRAF突变,占73.36%(n=570),其次是RET融合(7.21%;n=56)和TERT突变(1.93%;n=15)。在RET融合阳性患者中,44例存在RET/PTC1重排,12例存在RET/PTC3重排。在TERT启动子突变病例中,13例为C228T突变,2例为C250T突变。6例患者同时存在BRAF和RET共变异,12例同时存在BRAF和TERT共变异,无患者存在RET和TERT共变异。中位随访时间为39.33个月(四分位数范围:34.20–51.93)。随访期间,30例患者出现疾病复发,无死亡病例。
BRAF突变型PTC具有更惰性的肿瘤生物学行为和更好的预后:
与BRAF突变阳性患者相比,BRAF突变阴性患者表现出更晚期的T分期(p=0.001)和N分期(p<0.0001)(表1)。BRAF突变阴性组中,肿瘤大小>2cm(20.29% vs. 9.65%,p=0.0001)和转移淋巴结数量≥4个(33.82% vs. 25.61%,p=0.0303)的患者比例显著更高。此外,BRAF突变型肿瘤复发(2.63% vs. 7.25%,p=0.0061)和ENE(4.21% vs. 13.53%,p<0.0001)的可能性更低。Kaplan-Meier生存分析显示,BRAF突变型患者的RFS优于BRAF野生型患者(图1A,p=0.0033)。在年龄、性别、BMI或ETE方面未观察到显著差异。
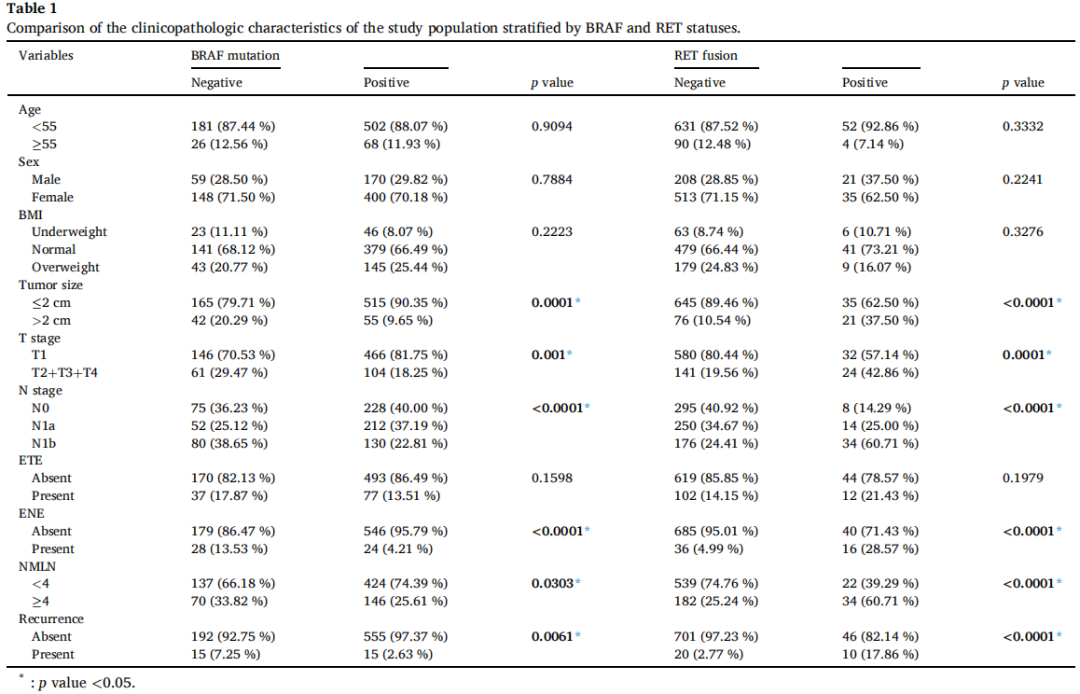
表1
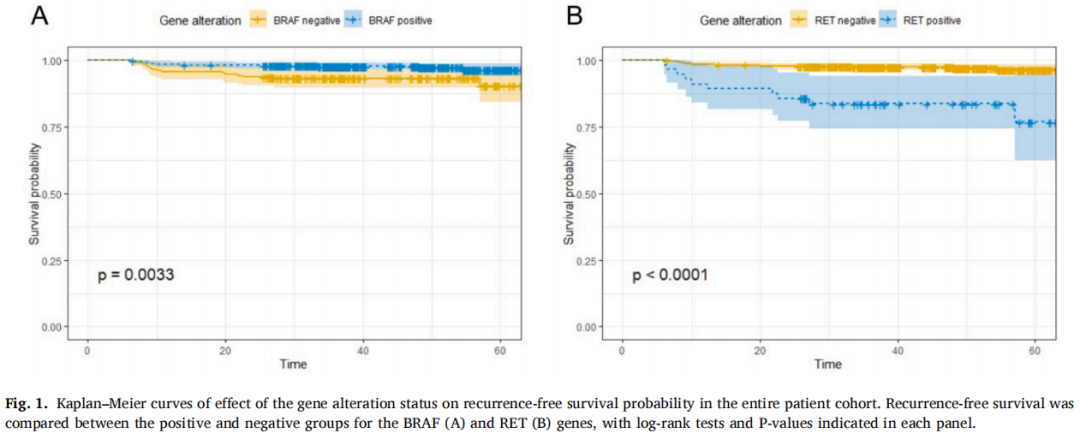
图1
存在RET融合的PTC可能表现出更强的侵袭性表型和更高的复发概率:
与RET融合阴性患者相比,RET融合阳性患者中肿瘤大小>2cm(37.50% vs. 10.54%,p<0.0001)、转移淋巴结数量≥4个(60.71% vs. 25.24%,p<0.0001)和ENE(28.57% vs. 4.99%,p<0.0001)的比例显著更高(表1)。同时,RET融合阳性患者的疾病分期更晚,表现为T分期(p=0.0001)和N分期(p<0.0001)更高。此外,RET融合阳性队列中复发更常见。其余变量无统计学显著差异。后续生存分析显示,RET融合阳性患者的RFS劣于RET融合阴性患者(图1B,p<0.0001)。
RET融合与BRAF突变的互斥性:BRAF突变阴性队列中RET融合频率显著更高
为直观展示患者中BRAF、RET和TERT变异的分布,基于本中心数据和TCGA数据库生成基因突变谱。研究者发现BRAF和RET变异的重叠极少,提示BRAF和RET共变异罕见(图2)。为探究BRAF与RET的关联,按BRAF突变状态分层,对变异频率进行卡方分析。根据研究者的数据,BRAF突变患者的RET融合频率显著低于无BRAF突变患者(1.05% vs. 24.15%,p<0.0001),而TERT突变频率无统计学显著差异(1.45% vs. 2.11%,p=0.7698)。使用TCGA数据进一步验证,证实BRAF突变与RET融合之间存在类似趋势。具体而言,153例BRAF野生型患者中有23例存在RET融合,而246例BRAF突变型患者中无1例存在RET融合(15.00% vs. 0.00%,p<0.001)(表2)。
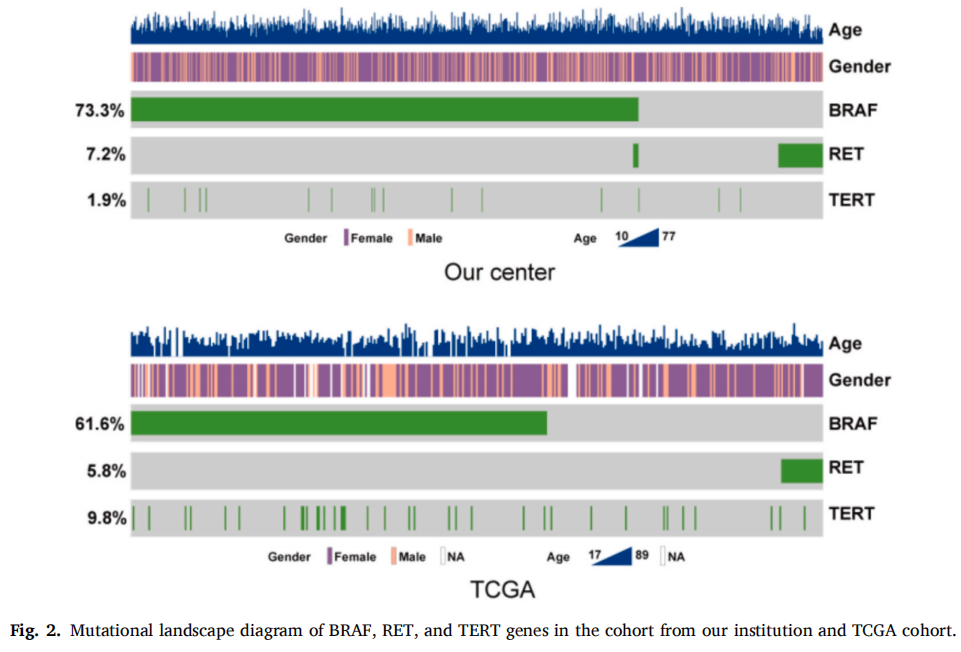
图2
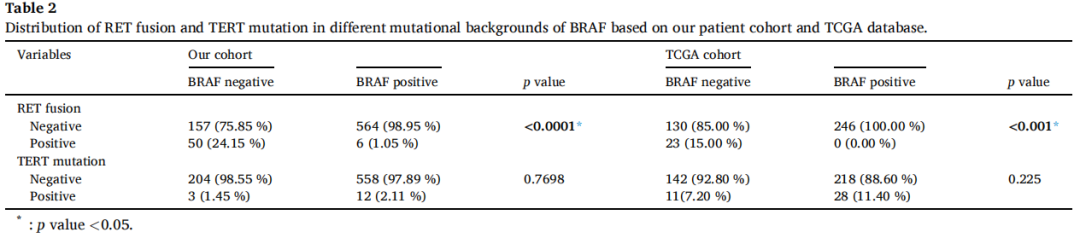
表2
校正RET融合后,BRAF突变与侵袭性表型及复发无关联:
为排除RET融合的影响,研究者按RET变异状态分层,对存在和不存在BRAF突变的患者进行卡方分析。分层后,在RET融合阴性队列中,比较BRAF突变状态时,肿瘤大小、ENE)转移淋巴结数量、T分期、N分期和复发的统计学显著性均消失(表3)。同样,在RET融合阳性队列中,除N分期(p<0.001)外,BRAF突变型与BRAF野生型患者的其他统计学显著变量均无差异。后续生存分析显示,无论RET融合状态如何,BRAF突变患者与无突变患者的RFS相似(图3;p=0.89,p=0.37)。
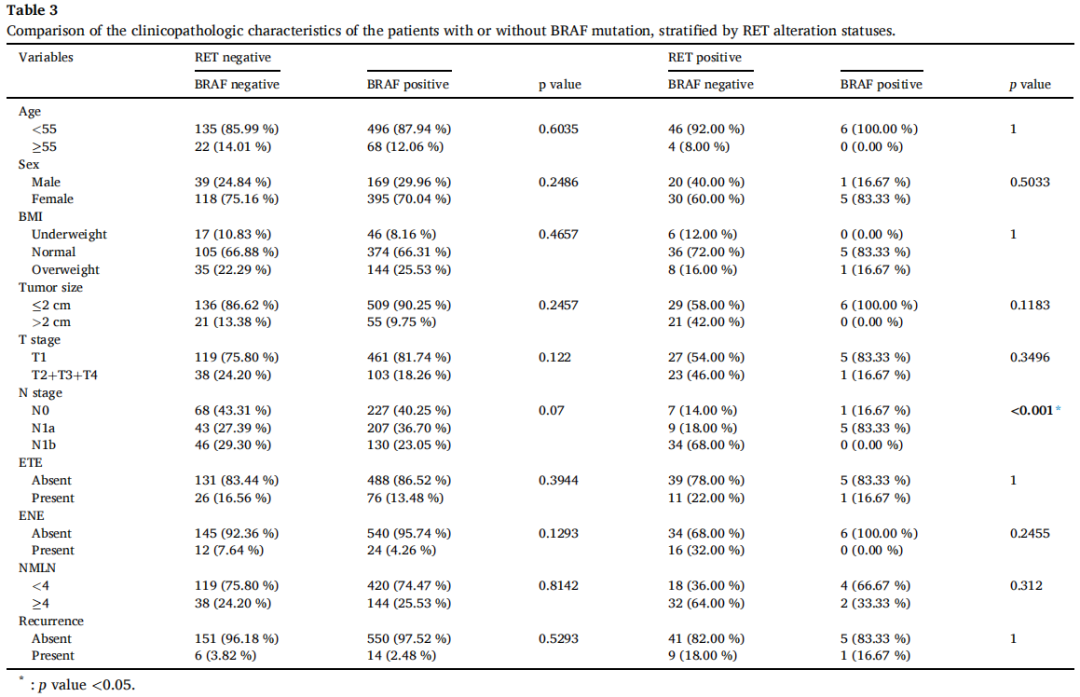
表3
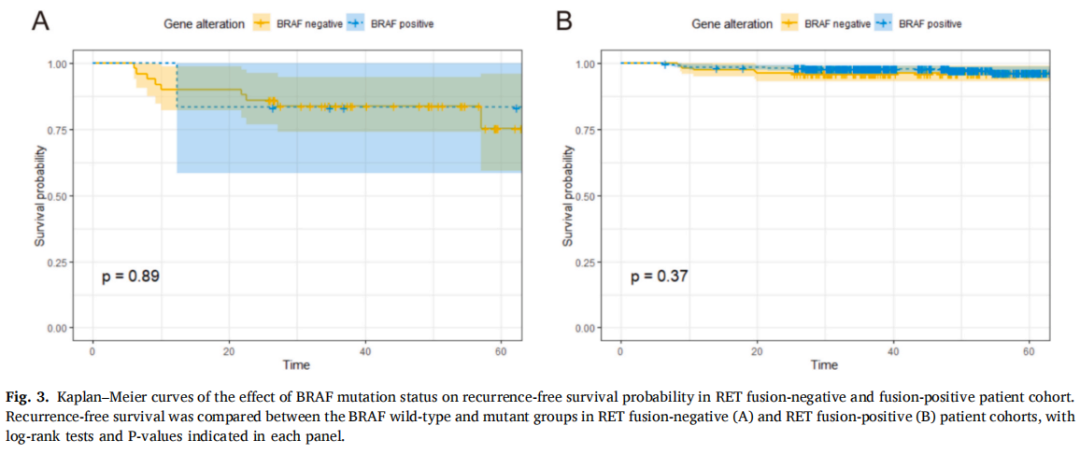
图3
采用单因素和多因素Cox回归分析评估基因变异对预后的影响:
单因素分析显示,包括RET融合(HR=6.70,p<0.001)在内的大多数变量是预后不良的风险因素,而BRAF突变是防止复发的保护因素(HR=0.36,p=0.005)。随后,将p<0.05的变量纳入多因素分析。然而,BRAF突变未保持统计学显著性,而RET融合仍是显著的不良预后指标(HR=2.86,p=0.044)。此外,ETE(HR=4.88,p=0.002)和转移淋巴结数量(HR=8.52,p=0.001)在单因素和多因素Cox分析中均被证实为独立预后因素(表4)。
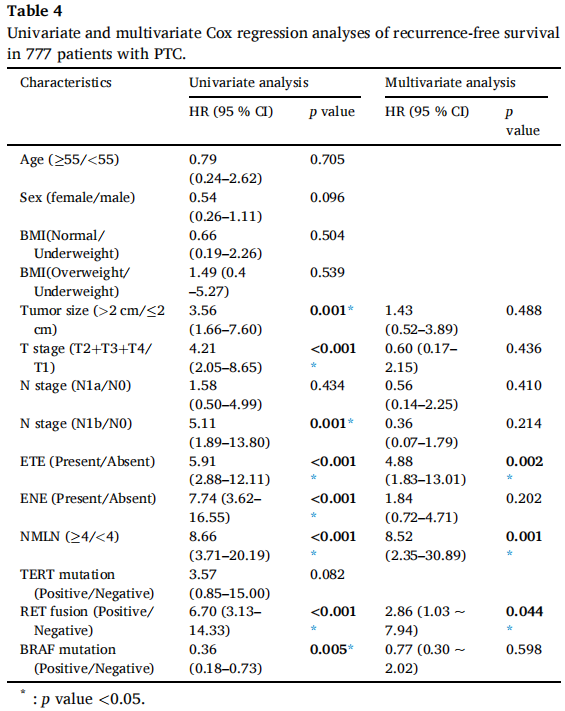
表4
讨 论
BRAF V600E突变是PTC中最常见的基因变异,近几十年来已得到广泛研究。既往研究表明,存在BRAF突变的肿瘤常与侵袭性生长、ETE、较大肿瘤体积、晚期癌症分期及复发相关。此外,荟萃分析也证实了这些发现。然而,一些问题(包括不同研究中BRAF突变率的差异、复发定义的不一致以及其他混杂变量的校正)阻碍了这些结论的广泛接受。本研究中,BRAF野生型肿瘤比BRAF突变型肿瘤表现出更强的侵袭性和更高的复发率。Hang等也观察到类似结果,但该研究未进一步深入探究。鉴于这些尚未报道的结果,研究者从基因变异及相互作用的角度进一步分析,以阐明这一特殊现象。
本研究数据与TCGA数据库的结果均显示,RET融合在BRAF突变阴性组中显著更常见。这种双重验证一致支持BRAF与RET之间存在类似互斥的关系。既往研究指出,RET融合阳性患者具有更强的肿瘤生物学侵袭性和更高的肿瘤复发率,这与本研究结果一致。因此,合理推测BRAF状态对RET融合频率的影响,在一定程度上导致了表型差异。为此,研究者排除了RET融合的影响,以更好地阐明BRAF突变阴性与阳性个体之间的内在差异。在按RET分层的亚组分析中,先前观察到的临床病理特征(除N分期外)和RFS曲线的统计学显著性均消失。这提示,可能是RET融合而非BRAF突变,主要导致了最初观察到的特殊现象。单因素分析中BRAF的保护作用是表面现象,可能是由RET的显著影响驱动的。在最终的多因素分析中,BRAF突变的显著性消失,提示BRAF突变可能并非复发的不良因素。作为已明确的独立预后因素,RET融合对复发的影响在单因素和多因素分析中均得到再次证实。
关于BRAF,另一种观点认为其突变与不良结局之间无明确关联。Gouveia等开展了当时美国规模最大的研究,纳入了全面的临床和病理特征。在他们的研究中,BRAF突变与多灶性、淋巴血管癌栓、ENE、中央区淋巴结转移、晚期分期及远处转移均无统计学关联。此外,后续多项回顾性研究也验证了这些发现。根据本研究,当前争议的一个可能解释是未考虑RET融合的影响。鉴于RET融合与表型的强关联性及其与BRAF的类似互斥效应,未来研究分析BRAF时,排除RET融合的混杂影响至关重要。此外,RET融合作为预测侵袭性和改善成人患者管理的可干预指标,其重要性日益凸显。共识还建议,对于存在致病性或意义未明的胚系RET变异的患者,应在检测后由临床遗传学家提供咨询。
BRAF和RET是MAPK信号通路的关键组成部分,这些基因的变异会导致该通路的持续激活,进而促进PTC的发生和进展。最初的研究认为,BRAF突变和RET融合不会同时发生,因为任一变异均足以诱导PTC的肿瘤发生。然而,后续多项研究发现,双重基因变异在PTC中虽罕见但可能存在。与BRAF和TERT突变共存类似,同时存在BRAF突变和RET融合的PTC可能代表一种独特的临床实体,在复发性PTC中更常见,且恶性程度更高。与复发性PTC相比,原发性PTC中BRAF+RET双重变异的发生率较低,在本研究队列中仅为0.77%,另一项研究为1.01%,这提示需要在未接受治疗的群体中进一步研究。值得注意的是,Guerra等提出,BRAF点突变与RET融合的共存在PTC中较常见,但他们的患者队列专门选自火山地区,且纳入和排除标准不明确。此外,居住在活火山附近及暴露于火山相关化学物质可能影响PTC的诱变。因此,结合本研究结果与既往研究,BRAF和RET的关系可描述为“类似互斥”且极少共存,表现为不同基因背景下变异频率的显著差异。
BRAF突变和RET融合被认为是PTC发生的早期驱动变异。对于BRAF突变阳性患者,BRAF是主要的肿瘤驱动基因;对于BRAF突变阴性患者,基因融合(主要是RET融合)和RAS突变被视为重要的肿瘤驱动事件,尽管这些变异的发生率显著低于BRAF突变。本研究样本量相对较大,因此BRAF突变阴性组中存在驱动变异的病例数相应较多。但当样本量有限时,BRAF突变阴性病例中的驱动变异可能因发生率过低而无法体现其对表型和预后的影响,这可能导致最终比较中出现偏倚,进而造成研究结果的差异。TERT启动子突变被认为是高危临床病理特征的明确指标,且常与其他基因变异共存。当TERT突变与BRAF或RET变异同时存在时,患者的肿瘤通常恶性程度更高,预后更差。在本研究队列中,12例患者存在BRAF和TERT共突变,但这并未影响BRAF野生型与突变型肿瘤在侵袭性表型和疾病复发方面的比较结果。此外,本队列中未观察到RET和TERT同时变异的病例。
目前,BRAF突变的预后价值仍不明确。BRAF突变被纳入2015年ATA复发风险分层,但该状态不会改变个体的风险分组。因此,有观点认为,仅基于BRAF突变状态采取更积极的治疗措施需谨慎考虑。尽管如此,BRAF在PTC病理检查中的诊断价值仍至关重要。自Xing等首次提出细针穿刺(FNA)联合BRAF检测的方法以来,该方法已得到广泛研究并在临床实践中广泛应用。先前两项大样本荟萃分析显示,BRAF V600E检测的特异性高达100%,敏感性为40%-60%。此外,鉴于PTC中存在多种驱动基因,将BRAF突变与甲状腺癌相关突变panel组合检测可显著提高其诊断价值。随着两种新型高选择性RET抑制剂(塞普替尼和普拉替尼)的获批,分子靶向治疗已成为RET融合阳性患者的另一种有效治疗策略。鉴于其良好的肿瘤退缩效果和较低的不良反应风险,目前已有机会在晚期侵袭性甲状腺癌儿童患者中探索新辅助靶向治疗,可能作为术前方案甚至手术替代方案。在131I难治性融合阳性PTC的儿童患者中,靶向融合治疗可能恢复碘摄取能力并诱导显著的肿瘤退缩。这些发现进一步凸显了分子检测的重要性,并提示RET融合可能作为特定患者群体靶向治疗的潜在生物标志物。此外,根据当前指南和共识,对于PTC儿童和青少年患者,应由经验丰富的团队进行手术,且131I治疗的时机应谨慎考虑。
本研究存在一些局限性。主要局限性在于其单中心、回顾性设计,依赖病历提取数据,不可避免地存在选择偏倚。其次,由于单中心患者来源和样本量有限,需要更大的数据集进一步验证本研究发现。第三,由于本中心常规基因检测实施时间较晚,整体随访时间不长,且未按PTC组织学亚型进行亚组分析。第四,除特定人群外,RET融合的总体发生率较低,导致RET融合阳性亚组分析的样本量较小,这可能导致部分比较和分析的统计学效力不足。
总之,RET融合在BRAF突变阴性队列中显著更常见,且其对肿瘤行为的影响似乎超过BRAF突变。校正RET融合后,BRAF与肿瘤复发及侵袭性无关联。本研究进一步证实了BRAF与RET之间的互斥关系,并为阐明当前围绕BRAF突变的争议提供了新证据。对于未来的BRAF相关研究,需明确RET融合状态,并考虑不同队列间的变异频率差异。
参考文献:
Hu A, Wen X, Tian J, et al. RET fusion rather than BRAF mutation confers a higher risk of aggressiveness and recurrence in papillary thyroid carcinoma. Oral Oncol. 2025;167:107464. doi:10.1016/j.oraloncology.2025.107464

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#甲状腺癌# #RET融合#
3 举报