Diabetes Care:急性起病、缓进型与暴发型,日本1型糖尿病三种亚型β细胞衰退模式及其预测因素
2025-07-05 MedSci原创 MedSci原创 发表于上海
本研究基于日本三种临床亚型的1型糖尿病患者,首次通过大规模、多中心、14年长周期随访系统揭示了β细胞功能不可逆损失的多样进展轨迹及其遗传和临床预测模型。
1型糖尿病是一种因自身免疫介导胰岛β细胞破坏,导致胰岛素绝对缺乏的代谢性疾病。临床上,1型糖尿病可分为自身免疫型(伴有胰岛自身抗体)与特发性型(无抗体者)。据报道,欧美患者中,部分患者即便病程延长数十年仍检测到微弱胰岛素分泌;而日本患者因β细胞储备脆弱,往往于发病数年内快速走向胰岛功能衰竭。除此之外,日本特有的缓慢进展型和暴发型1型糖尿病亦广泛流行,这两型疾病的β细胞衰退轨迹及影响因素尚不明确。
此前研究提示,HLA区域基因与1型糖尿病的发病风险密切相关,但其对β细胞功能进展速率的影响未被系统阐明。鉴于不同亚型之间及亚型内部患者间存在显著异质性,深入研究其异质性机制与预测指标,既对优化疾病监测具有重要意义,也为精准干预与治疗奠定基础。
近日,日本学者Shinsuke Noso等人基于多中心的前瞻性纵向队列研究——日本1型糖尿病数据库研究(TIDE-J),通过追踪患者的C肽水平及相关临床基因型数据,系统分析了β细胞功能衰退至不可检测水平的时间及其影响因素。这项研究是首次从基因及临床角度阐释了日本1型糖尿病患者疾病进展的异质性及个体化管理的科学依据,研究结果发表在权威期刊Diabetes Care上。

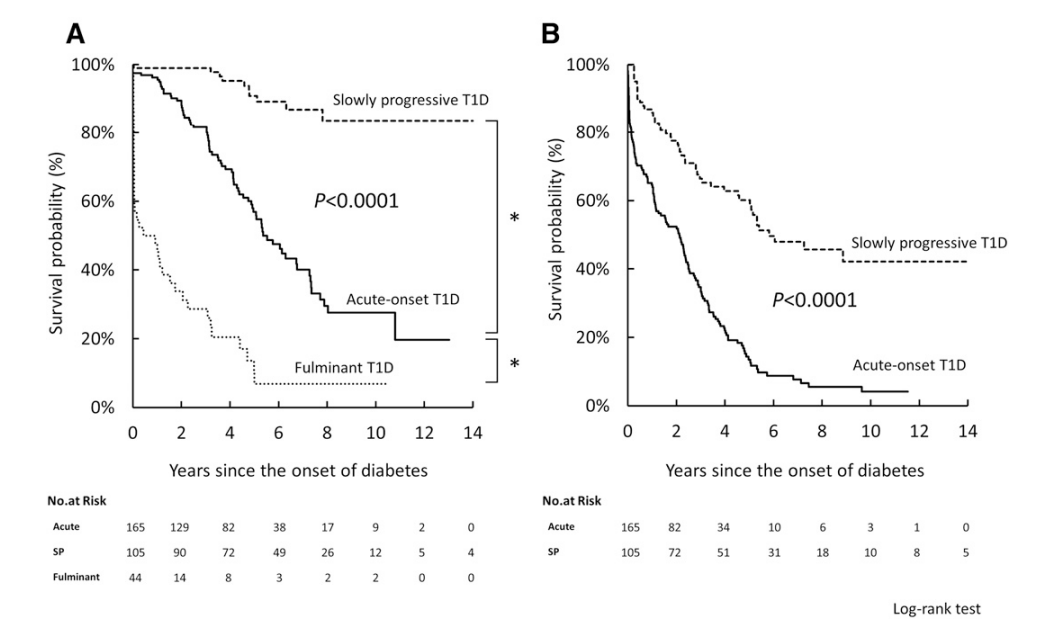
本研究采用多中心、全国性、前瞻性纵向队列设计。纳入符合以下条件的日本1型糖尿病患者:糖尿病持续时间<5年,同时满足至少一项条件:胰岛自身抗体(GAD、IA-2、ZnT8等)阳性,或空腹C肽<1.0 ng/mL。患者分为急性起病(n=165)、缓进型(n=105)、暴发型(n=44)三组。
所有患者每年采集血液样本,测定空腹C肽水平及胰岛自身抗体,并进行HLA分型(DRB1、DQB1等)。数据持续采集最长14年。以达到不可检测的C肽阈值作为β细胞功能丧失终点(急性起病及暴发型),缓进型则以发展至胰岛素依赖为终点。统计采用Kaplan-Meier生存分析、Cox比例风险模型,调整多重临床及遗传因素,分析β细胞功能进展的时间及其影响因素。
研究结果
1,β细胞功能衰退的亚型差异
研究纳入314名患者,平均随访多年,分别为:急性起病型165例,缓进型105例,暴发型44例。
5年内,急性起病型患者中有43.1%达到不可检测C肽,缓进型仅9.1%,暴发型高达93.2%。10年时数据分别为75.4%、16.4%和93.2%(P<0.0001)。
缓进型患者不易达到完全无胰岛功能状态,但逐渐发展为胰岛素依赖者,5年及10年时分别为41.3%和57.9%。相比之下,急性起病型5年内胰岛素依赖高达86.5%。
2,典型急性起病型患者β细胞功能进展异质性分析
142例在登记时仍有一定C肽水平患者中,出现快速恶化(≤5年内达到不可检测)者43例,缓慢恶化(>5年)者11例,部分患者保留功能超过5年(25例)。
这表明即使同为急性起病型,患者间β细胞衰退速度仍存在明显差异。
3,HLA基因型与β细胞功能进展的关联(急性起病型)
DR4/DR4患者的β细胞功能丧失最缓慢,DR4/DR8及DR4/DR9患者丧失速度显著加快。
单一因素及多因素Cox比例风险模型分析显示,DR4/DR4基因型为β细胞耗竭的保护因素(HR约为0.21,P<0.05),DR4/DR8及DR4/DR9组合则是快速耗竭的危险因素(HR约1.8,P<0.05)。
其他HLA基因与β细胞功能衰退速度无显著关联。
4,暴发型1型糖尿病的β细胞耗竭情况
病程短暂,>90%患者在5年内达到不可检测C肽。
多元分析提示年龄较大发病者β细胞功能衰退可能更快,DR4/DR4基因型在单因素遗传模型中情况相似于急性起病型,但综合模型未显示显著相关。
5,缓慢进展型患者β细胞功能进展及预测指标
5年内57.9%患者进展至胰岛素依赖状态(F-CPR<0.6 ng/mL)。
多元分析显示,低BMI(HR约0.86,P=0.0017)、GADA阳性(HR约10.6,P<0.01)及缺乏DR2(DRB115:01-DQB106:02或DRB115:02-DQB106:01)遗传型(HR约0.3,P<0.05)均为胰岛素依赖进展的独立预测因子。
DR9/DR9基因型表现出快速进展趋势,虽统计学尚未达显著水平。
研究价值与意义
本研究基于日本三种临床亚型的1型糖尿病患者,首次通过大规模、多中心、14年长周期随访系统揭示了β细胞功能不可逆损失的多样进展轨迹及其遗传和临床预测模型。研究明确了HLA基因型不仅决定发病风险,更显著影响疾病进程。急性起病型中DR4/DR4基因型患者β细胞耗竭较缓慢,提示该基因型可作为疾病分层和个体化治疗的遗传标志;而DR4/DR8及DR4/DR9基因型患者需重点监测,争取早期干预。缓进型患者中,BMI、GADA及DR2状态的联合预测为临床制定治疗计划、判断胰岛素依赖风险奠定了依据。
此外,研究搭建了一个系统评估日本1型糖尿病异质性的平台,填补东亚人群关于β细胞功能长期动态与预测的空白。结果对精准医学、糖尿病预后判断及新疗法临床试验对象筛选具有指导意义,也为理解不同人种间1型糖尿病发病机制差异提供了线索。
原始出处
Noso S, Chujo D, Imagawa A, Kawasaki E, Awata T, Yasuda K, Abiru N, Kodani N, Oikawa Y, Fukui T, Katsuki T, Kozawa J, Nagasawa K, Osawa H, Takahashi K, Tsuchiya K, Shimoda M, Yasuda H, Maeda N, Shimada A, Kobayashi T, Hanafusa T, Kajio H, Ikegami H, for the Japanese Type 1 Diabetes Database Study (TIDE-J) Genetics. Rapid and Slow Progressors Toward β-Cell Depletion and Their Predictors in Type 1 Diabetes: Prospective Longitudinal Study in Japanese Type 1 Diabetes (TIDE-J). Diabetes Care. 2025;48(8):1-8. DOI:10.2337/dc25-0579
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#1型糖尿病#
17 举报