读书报告 | 一线靶免联合改善BRAFV600突变晚期黑色素瘤患者的生存并延缓脑转移
2025-06-19 iCombo iCombo 发表于上海
研究表明,以BRAF抑制剂为基础的TT联合PD-1单抗是一种安全有效的治疗方案,可为BRAFV600突变晚期黑色素瘤患者带来生存获益并延缓脑转移发生。
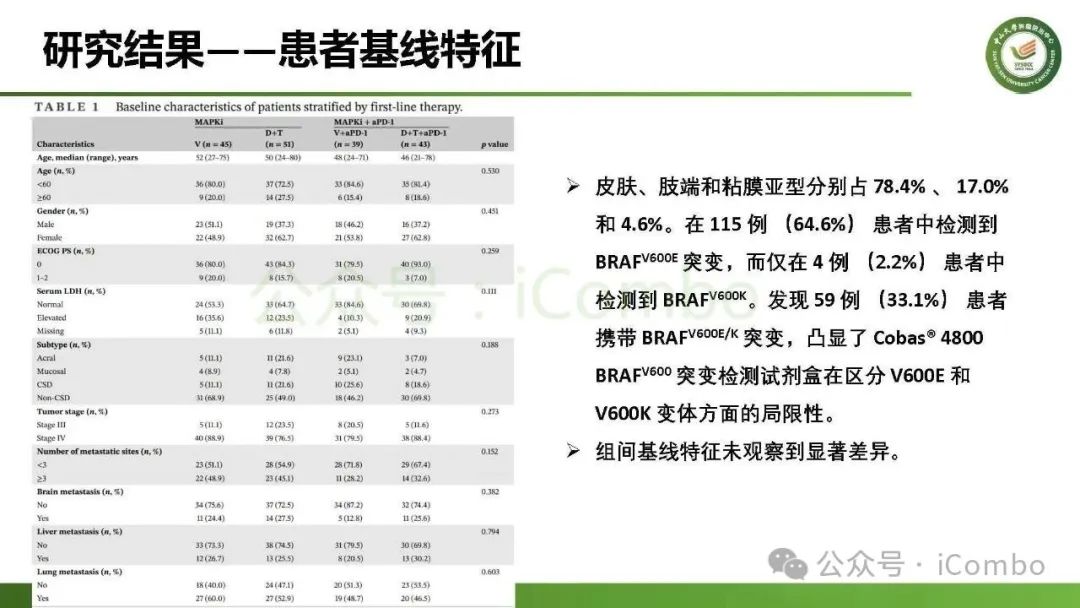
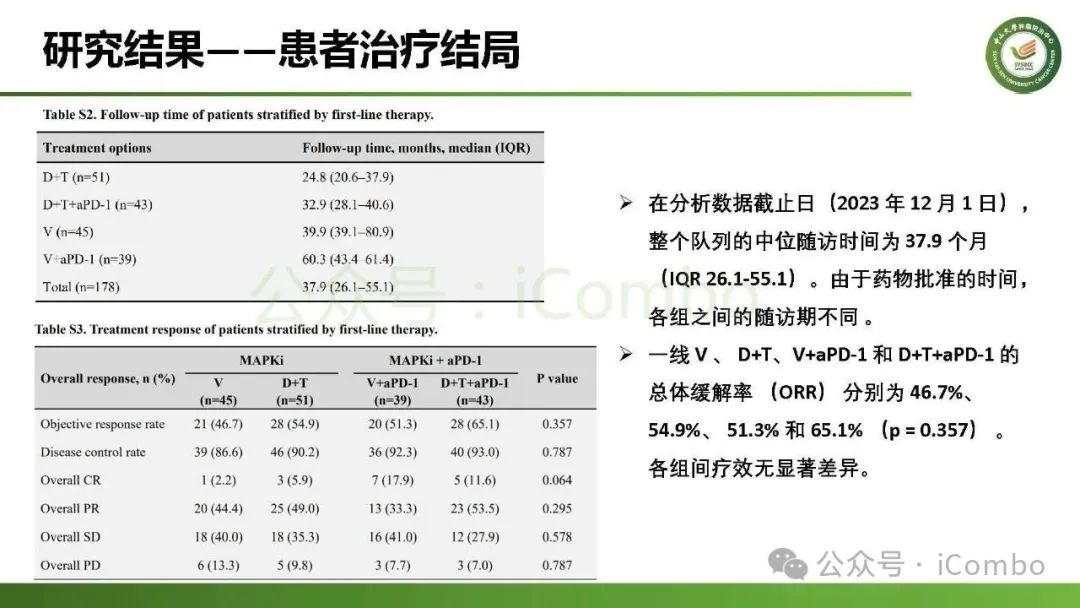
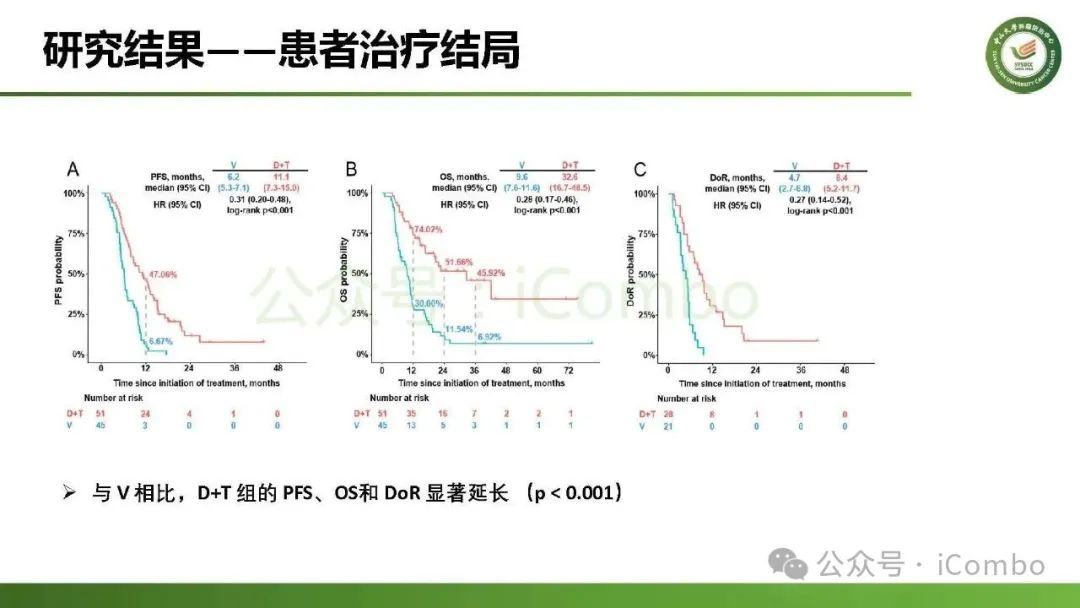
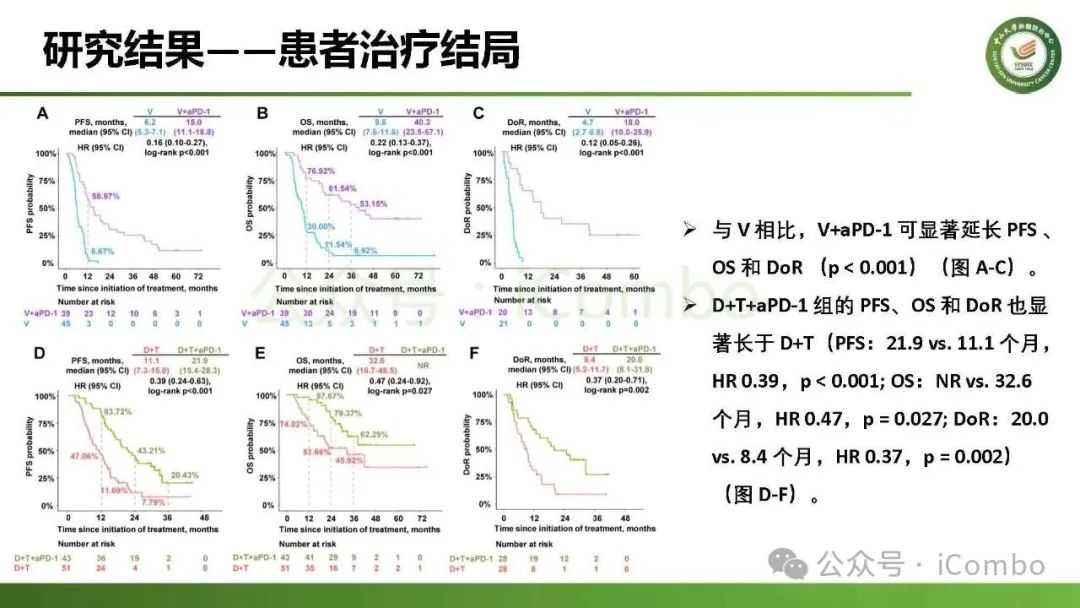
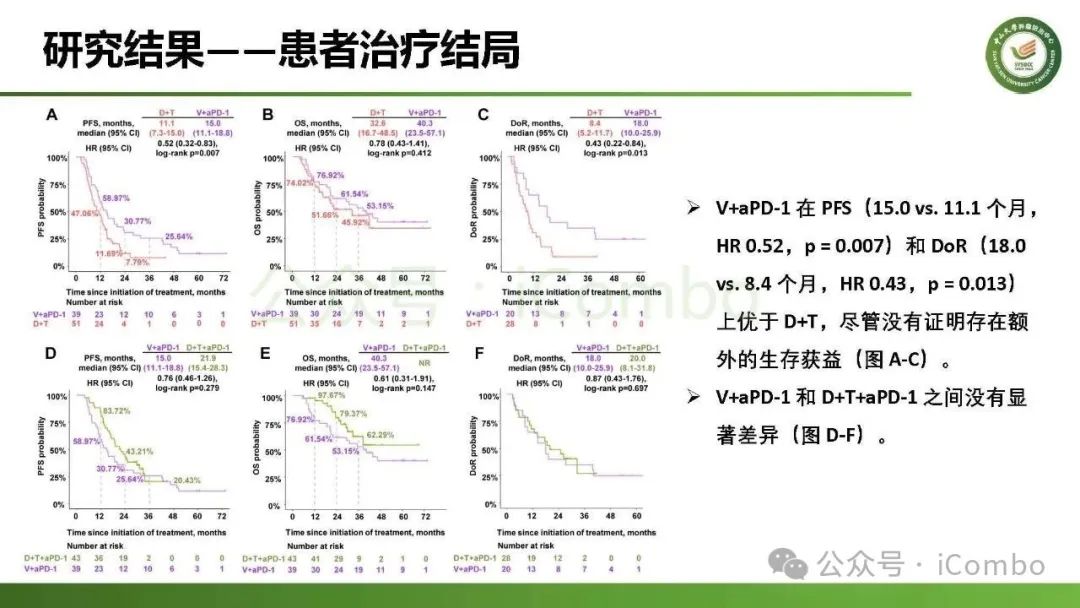
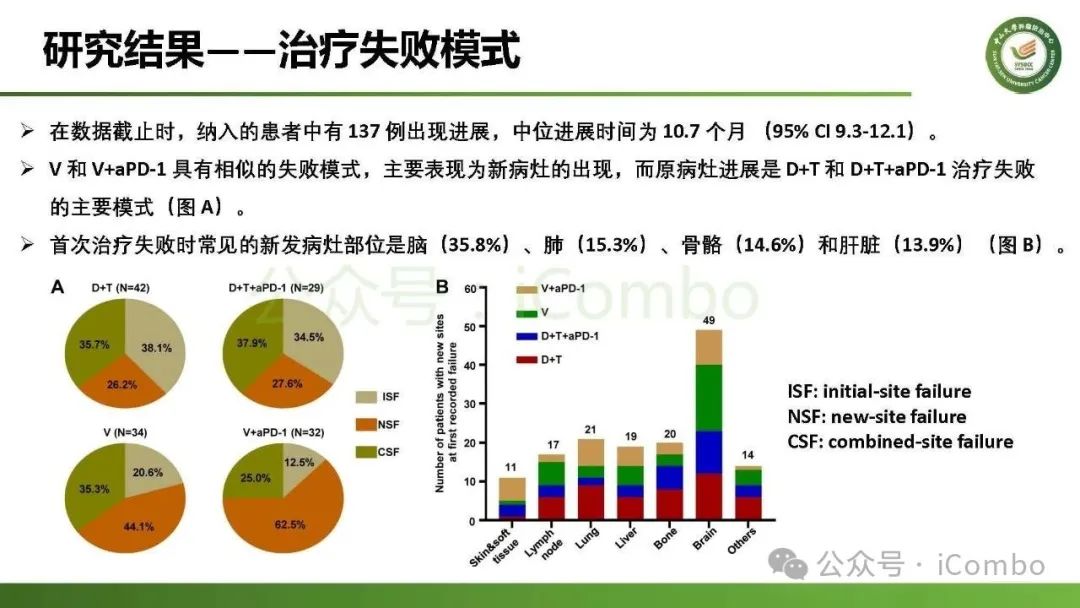
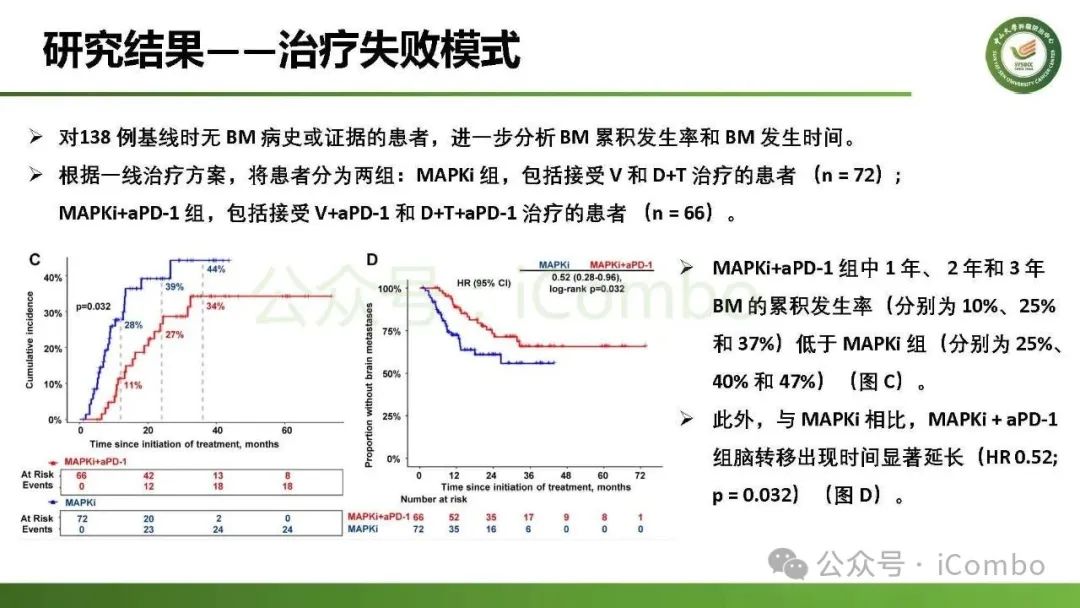
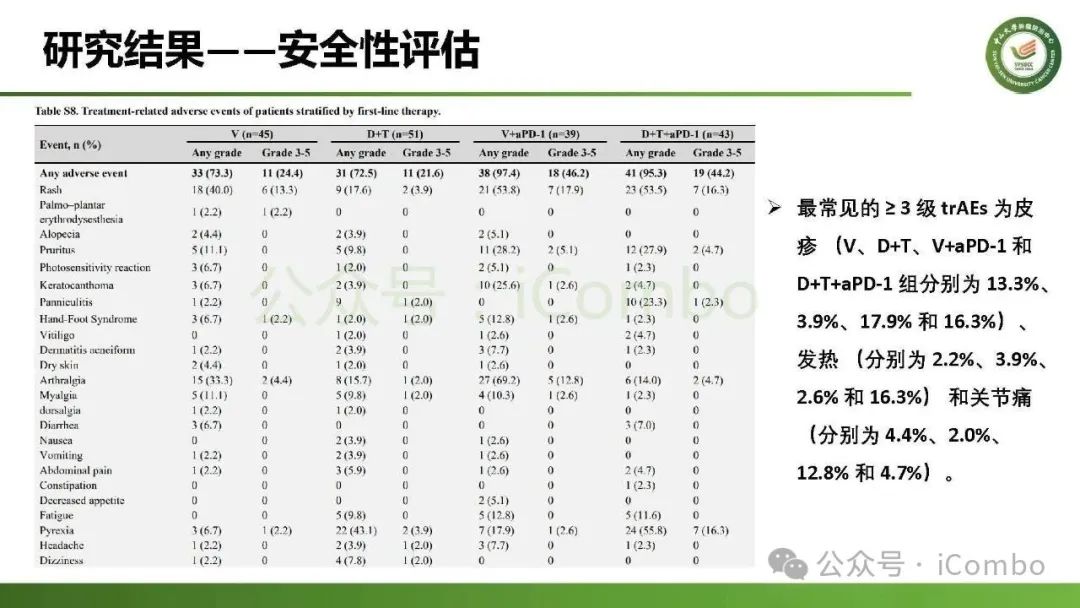
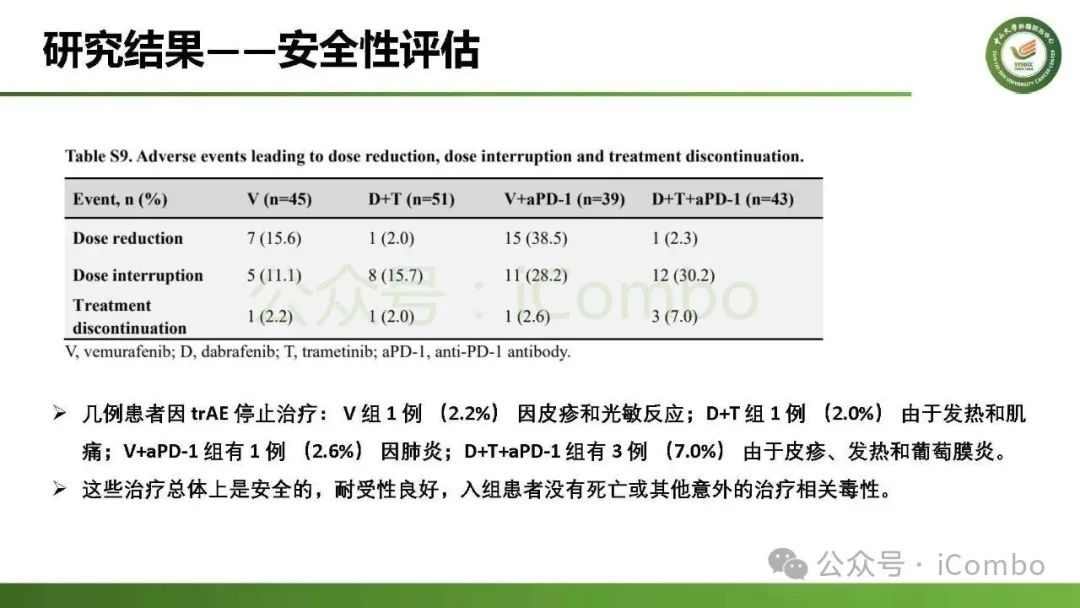
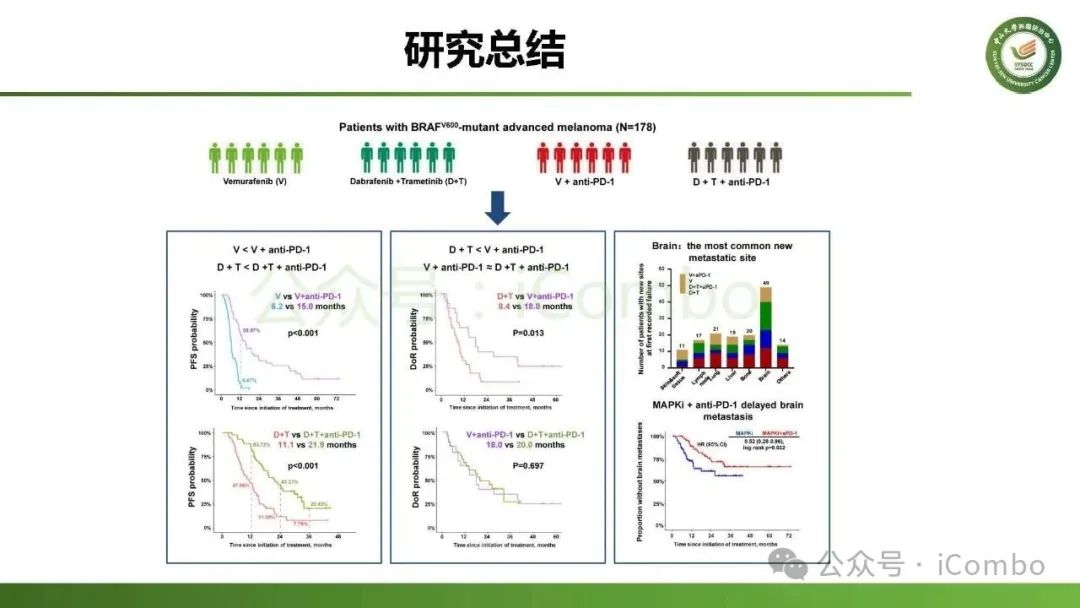
导读 约40%-50%的黑色素瘤患者携带BRAFV600突变,该突变通过持续激活MAPK信号通路促进肿瘤进展。抗PD-1免疫疗法(ICB)和基于BRAFi的靶向疗法(TT)是 BRAFV600 突变晚期黑色素瘤治疗的两大基石。TT起效快但易耐药,ICB应答持久但有效率低。临床前研究显示二者联用可协同增效,但在高加索人群中的关键III期临床试验(IMspire150、KEYNOTE-022等)结论不一。此外,亚洲患者黏膜/肢端型比例高,肿瘤微环境更具免疫抑制性(PD-L1低表达、TMB低等),对ICB原发耐药率更高。对于中国BRAFV600突变的晚期黑色素瘤患者,基于BRAFi的 TT一直是中国CSCO指南推荐的首选治疗方法,但联合ICB是否能为亚洲患者带来额外获益尚缺乏高质量证据。 本研究由中山大学肿瘤防治中心张晓实教授和李丹丹教授团队主导,联合国内三家医疗中心开展了一项回顾性队列分析(2014-2023年)。研究纳入178例BRAF V600突变晚期黑色素瘤患者,分别接受维莫非尼(V)、达拉非尼+曲美替尼(D+T)、V+PD-1单抗和D+T+PD-1单抗治疗。靶免联合组接受 4-6 周的靶向治疗导入,之后联合静脉注射PD-1单抗的“先靶后靶免联合”的优化治疗策略。结果显示,D+T+PD-1单抗组较D+T组显著延长中位PFS(21.9 个月vs 11.1月)、OS(未达到 vs 32.6月)和DoR(20.0 个月vs 8.4月)。V+PD-1单抗组较单药V同样显著延长了PFS、OS和DoR,且其PFS(15.0个月 vs. 11.1个月)和DoR(18.0 个月vs. 8.4个月)优于D+T组,与D+T+PD-1单抗组疗效相当。在BRAF抑制剂为基础的TT中联用PD-1单抗可降低脑转移发生率。 研究表明,以BRAF抑制剂为基础的TT联合PD-1单抗是一种安全有效的治疗方案,可为BRAFV600突变晚期黑色素瘤患者带来生存获益并延缓脑转移发生。研究中采用的包含“靶向治疗导入期” 的优化联合策略值得在临床实践中推广。未来还需开展针对亚洲人群的前瞻性随机对照试验(如比较D+T vs. D+T+PD-1)进一步验证结论,并探索生物标志物(如TILs、PD-L1表达等)以精准筛选获益人群(MedComm (2020). 2025 Feb 17;6(3):e70102. doi: 10.1002/mco2. 70102)。









本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#黑色素瘤# #BRAFV600突变#
21 举报