Endocrine Reviews:胰岛素抵抗在1型糖尿病中的病理生理学及临床治疗意义解析
2小时前 MedSci原创 MedSci原创 发表于上海
本综述全面解析了1型糖尿病胰岛素抵抗的多器官参与机制,明确其非单纯β细胞功能丧失的复杂病理背景,强调了胰岛素抵抗作为心血管及代谢慢性并发症重要致病因素的角色。
研究亮点
-
1型糖尿病(T1D)患者不仅存在胰岛素分泌不足,还普遍存在胰岛素抵抗,且这种抵抗作用在疾病早期即已显现,并随着病程进展持续存在。
-
T1D中的胰岛素抵抗涉及肝脏、骨骼肌、脂肪组织及血管内皮,病理机制复杂,除代谢异常外,还兼有自身免疫等因素的协同参与,形成与2型糖尿病不同的临床表型。
-
除了生活方式干预及胰岛素治疗优化外,部分非胰岛素降糖药物如二甲双胍、GLP-1受体激动剂及SGLT2抑制剂等在T1D患者的胰岛素抵抗及心血管风险管理中展现潜在价值,但其临床应用仍需更多证据。
传统观点认为1型糖尿病(T1D)病理上以胰岛β细胞自身免疫破坏导致胰岛素绝对缺乏为主,胰岛素抵抗仅作为2型糖尿病特征。然而,越来越多研究发现,胰岛素抵抗在T1D中同样常见且不可忽视。其存在不仅影响整体代谢调控与治疗反应,更与血管内皮功能障碍和糖尿病慢性并发症的发生密切相关。时至今日,随着精准医学理念的发展,重新审视T1D异质性及胰岛素抵抗在其发病机制及临床进展中的角色具有重要价值。
当前尚存的两大核心科学难题为:1)胰岛素抵抗究竟是T1D的继发表现,还是在早期甚至促发自身免疫的关键因素?2)针对胰岛素抵抗的治疗策略在T1D中的疗效及安全性如何?本综述通过系统回顾,探讨上述问题与未来研究方向。
近期,发表在Endocrine Reviews杂志上的一项综述性研究,对近年来人类胰岛素抵抗的金标准检测技术——葡萄糖钳夹法技术相关研究数据进行梳理,深入探讨了T1D患者胰岛素抵抗的发生机制、组织特异性影响、病理生理学特点及对临床并发症的贡献,重点指出其治疗上的意义。文章还评述了当前针对T1D胰岛素抵抗的治疗进展及其局限,展望未来精准治疗方向。

本研究基于PubMed数据库检索1980年至2024年6月间关于T1D胰岛素抵抗的相关文献,特别关注基于葡萄糖钳夹金标准的临床研究。同时结合相关代谢、免疫学、分子生物学原理文献,形成综合解析。数据多来源于人类相关研究,辅以作者团队积累的文件资料补充。
(一)组织特异性胰岛素抵抗的临床证据
胰岛素在全身调节葡萄糖、脂肪与蛋白质代谢中发挥核心作用。利用葡萄糖钳夹法对T1D患者进行评估显示,肝脏、骨骼肌、脂肪组织及血管内皮均发生胰岛素抵抗,但程度与机制存在差异。
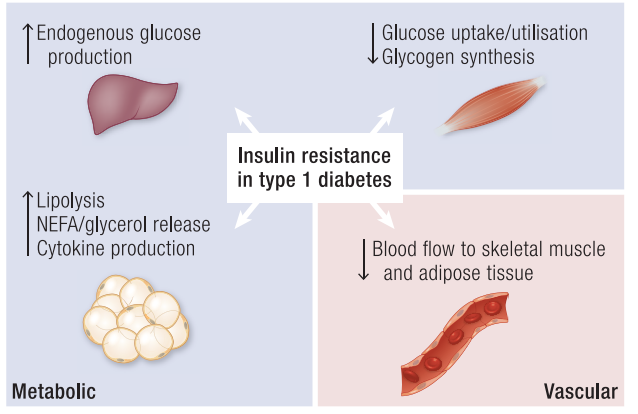
图:在T1D患者中,通过正常血糖-高胰岛素钳夹技术进行的研究表明,其肝脏、骨骼肌、脂肪组织及血管内皮均存在不同程度的胰岛素抵抗。
1. 肝脏胰岛素抵抗
-
T1D患者在钳夹试验中基于外周血胰岛素水平评估,表现为肝脏内源性葡萄糖产生(EGP)抑制不完全,呈现胰岛素抵抗特征。
-
但当考虑生理意义更大的肝门静脉胰岛素水平时,EGP对胰岛素的抑制并无明显异常,提示静脉外周胰岛素浓度不均可能导致假象。
-
促使肝脏胰岛素抵抗的因素包括高胰高血糖素血症、脂肪毒性中非酯化脂肪酸(NEFA)升高、慢性高血糖及肝脏微血管功能障碍。
2. 骨骼肌胰岛素抵抗
-
骨骼肌作为胰岛素介导葡萄糖摄取的主力器官,是全身胰岛素抵抗的主要表现及驱动。
-
在1型糖尿病患者中,骨骼肌胰岛素敏感性明显下降,葡萄糖转运及糖原合成受阻,非氧化代谢途径受损,且肌肉中糖酵解中间物质无积累,暗示葡萄糖转运是限速步骤。
-
这些代谢异常与血糖监测中血糖控制状况及病程有关。
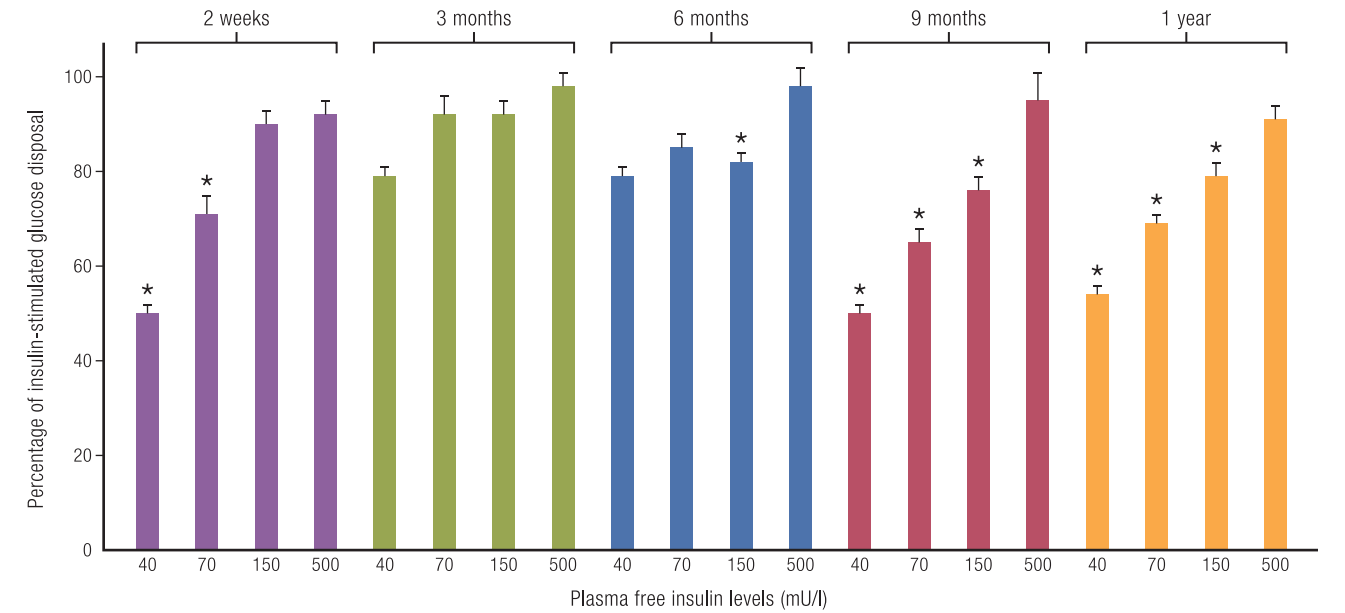
图:T1D患者确诊后不同时间点胰岛素刺激下全身葡萄糖处置百分比的变化:与健康对照组的比较(四步法正常血糖-高胰岛素钳夹研究)
3. 脂肪组织胰岛素抵抗
-
脂肪组织中胰岛素对脂解的抑制作用受损,导致NEFA及甘油释放增加,诱发全身脂肪毒性,促进炎症反应发展。
-
绒毛脂肪细胞特异性因子如脂联素虽总体升高,但其在胰岛素抵抗中的保护作用在T1D中被削弱。
-
其他脂肪因子如瘦素、视黄醇结合蛋白4(RBP-4)水平未见明显变化。
4. 血管内皮胰岛素抵抗
-
胰岛素能促进血管内皮一氧化氮(NO)依赖的血管舒张,增加骨骼肌及脂肪组织血流,从而促进葡萄糖输送。
-
T1D患者表现为血管舒张反应受损,血流减少,由内皮功能异常引起,且该机制对葡萄糖利用的抑制作用独立于全身胰岛素敏感性。
-
内皮胰岛素抵抗与宏观及微血管糖尿病并发症均密切相关。
(二)胰岛素抵抗的自然进展
1. 临床诊断前
胰岛素抵抗在T1D临床表现前多呈现,不仅提前显示胰岛素敏感性的下降,还加速β细胞功能受损及自身免疫出现。研究表明,糖耐量偏低者胰岛素抵抗与多重自身抗体产生正相关,且与糖尿病提前发作相关。胰岛素抵抗可能作为“加速器”加快遗传易感个体糖尿病发病。
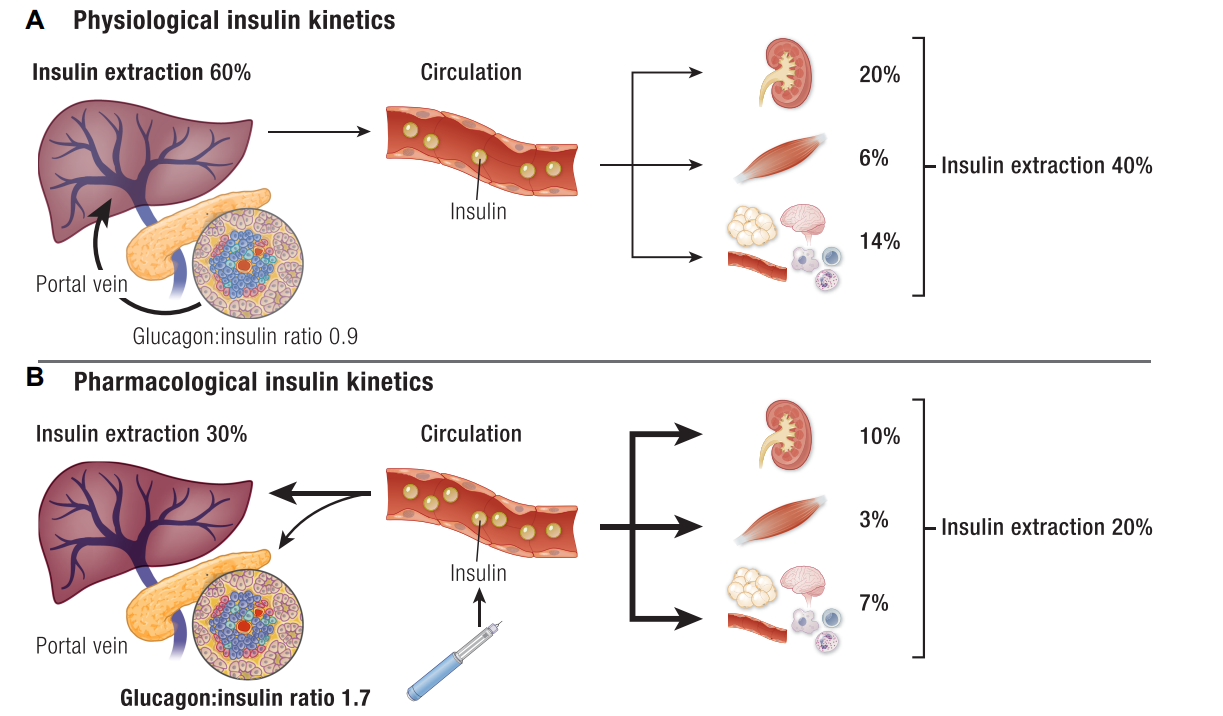
图:(A) 胰岛β细胞分泌后胰岛素的门静脉通路;B) 皮下给药后胰岛素的外周通路;
2. 临床诊断后
肝脏胰岛素敏感性相对稳定,骨骼肌胰岛素抵抗明显,整个病程持续存在。自身免疫和高血糖状态均加重胰岛素抵抗,且相互作用促进慢性并发症发生。机体胰岛素清除率降低和外源性胰岛素治疗引起的全身高胰岛素血症加重胰岛素抵抗。
(三)胰岛素抵抗的分子机制
-
高血糖(葡萄糖毒性)与血糖波动:高血糖促进ROS生成,激活多条代谢异常通路(多元醇、六磷酸基、PKC及AGE形成),诱发炎症反应和微环境损伤,血糖波动加剧氧化应激,损伤内皮功能。
-
高胰岛素血症:外周注射胰岛素途径导致外周胰岛素水平高于门静脉,破坏肝脏胰岛素梯度,增加脂肪堆积和体重并加剧胰岛素抵抗。
-
胰高血糖素异常:α细胞过度分泌胰高血糖素,促进肝脏糖异生、加重高血糖,且对GLP-1及胰岛素抑制敏感性降低。
-
脂肪毒性:脂肪组织胰岛素抵抗诱导脂肪酸过度释放,导致肌肉与肝脏脂质积累及信号干扰,促进炎症与内皮功能障碍。
-
线粒体功能障碍与氧化应激:代谢异常增强线粒体ROS生成,诱发胰岛素信号通路抑制及糖代谢功能下降,形成恶循环,影响β细胞存活与功能。
-
自身免疫介导的炎症反应:促炎细胞因子如TNF-α、IL-6等上调,直接诱发胰岛素抵抗,参与组织损伤与代谢失调。
(四)脂肪肝和代谢性脂肪肝相关疾病(MASLD)
T1D患者脂肪肝患病率不及2型糖尿病,但脂肪代谢异常与胰岛素抵抗仍密切相关。肝脏能量代谢异常及脂质积累变化与T1D病程发展相关,提示肝脏易损性存在且与胰岛素治疗、血糖控制等因素相关。
(五)临床相关性及危险因素
胰岛素抵抗作为1型糖尿病复杂病理生理的重要组成,强烈关联糖尿病微血管及大血管并发症,如糖尿病肾病、视网膜病变、神经病变和动脉粥样硬化。其独立性风险作用超过传统HbA1c等指标,提示临床风险评估需引入胰岛素敏感性测量。
主要危险因素涵盖:
-
肥胖及体脂异常:青少年T1D患者肥胖患病率升高,肥胖通过脂肪毒性进一步诱导胰岛素抵抗,加速β细胞功能衰竭及炎症反应。
-
睡眠障碍:睡眠不足及睡眠质量下降引发代谢异常,降低胰岛素敏感性,增加心血管风险。
-
体力活动不足:缺乏运动导致胰岛素敏感性降低,减少葡萄糖利用,增强心血管及代谢病风险。
(六)治疗策略与前景
1.生活方式干预
运动(尤其结合有氧与阻力训练)显著改善胰岛素敏感性,降低胰岛素需求与体重,增强心肺功能。日常打断久坐并推广适度运动为重要且切实可行的非药物措施。优化睡眠质量同样具积极意义。
2.胰岛素治疗优化
连续皮下胰岛素泵(CSII)可更接近生理胰岛素分布,减少外周高胰岛素血症,改善胰岛素抵抗,降低心血管事件风险。CSII较多次注射还可减少体重增加。
3.非胰岛素药物辅助
-
二甲双胍:减少胰岛素用量,减轻体重,暂时改善代谢,但长期疗效有限。
-
噻唑烷二酮类(如吡格列酮):改善胰岛素抵抗,有辅助作用,但副作用使其应用受限。
-
SGLT2抑制剂:降糖、减重,改善心肾结局,但存在酮症酸中毒风险,需谨慎使用。
-
GLP-1受体激动剂:减轻体重,改善血糖波动,潜在保护β细胞功能,目前多为辅助治疗。
-
胰高血糖素类似物(普兰林肽):改善餐后血糖及胰高血糖素调控,但使用受限于注射频率和胃肠道反应。
未来,精准分型指导下的个性化联合治疗将是提升疗效的关键。
研究价值与意义
本综述全面解析了1型糖尿病胰岛素抵抗的多器官参与机制,明确其非单纯β细胞功能丧失的复杂病理背景,强调了胰岛素抵抗作为心血管及代谢慢性并发症重要致病因素的角色。该研究有助于临床医生深化对T1D异质性的认识,促进从单一胰岛素替代向多维度精准治疗转变。
同时,文章点明传统糖化血红蛋白(HbA1c)指标和现有心血管风险预测模型在评估T1D患者动脉硬化和死亡风险方面的局限,提示胰岛素敏感性评估在临床决策中的潜在价值。生活方式干预及胰岛素治疗方式优化是降低胰岛素抵抗、改善代谢状况的基础,而包括二甲双胍、GLP-1RA、SGLT2i等的非胰岛素药物辅助使用需结合风险管理,未来需要大规模临床和真实世界数据验证。
此外,本综述提出了胰岛素抵抗与自身免疫之间非单向因果关系的可能,促使未来基础及转化研究重点关注二者互作机制,有助于早期筛查、预防T1D发生和进展,开辟全新干预策略。
原始出处
Apostolopoulou M, et al. Insulin Resistance in Type 1 Diabetes: Pathophysiological, Clinical, and Therapeutic Relevance. Endocrine Reviews. 2025;46(3):317-348. DOI:10.1210/endrev/bnae032.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言




















前往app查看评论内容
2 0 举报