首都医科大学附属北京天坛医院荣登 Science顶刊!施福东教授揭秘,神经炎症在多种神经系统疾病中的关键作用与治疗前景
2025-06-24 MedSci原创 MedSci原创 发表于上海
本综述为神经科学与神经免疫学领域构筑了扎实且系统的知识框架,揭示神经炎症在多发性硬化、脑卒中、阿尔茨海默病及帕金森病中的异同及其治疗潜力。
神经炎症指的是中枢神经系统(CNS)中免疫细胞的浸润及局部免疫细胞(主要为微胶质细胞和星形胶质细胞)的激活状态。过去,CNS曾被认为是免疫特权区,但近年来证据表明,CNS具有持续的免疫监视功能,且在疾病或损伤诱发时存在大量免疫细胞的募集和局部炎症反应。神经炎症在多种神经疾病中被证实是共同的病理特征,既具保护功能,也可导致持续的神经损伤,促进疾病进展。理解神经炎症的共同点与差异,对于开发精准治疗策略尤为重要。
多发性硬化作为免疫介导的自身免疫疾病,典型病理体现在外周淋巴细胞早期激活及穿透血脑屏障(BBB),引发CNS内的强烈炎症反应。脑卒中后,血管梗死或出血导致大量细胞死亡,释放危险相关分子模式(DAMPs),激活微胶质及招募免疫细胞,形成继发性炎症损伤。阿尔茨海默病(AD)与帕金森病(PD)等蛋白质错误折叠聚集疾病,早期微胶质细胞通过识别并清除病理蛋白表现保护作用,但持续激活则导致神经毒性因子释放,加速神经元死亡。神经炎症的异质性及其在不同疾病阶段的动态变化,成为当前医学研究和治疗面临的主要难题。
6月19日,由北首都医科大学附属北京天坛医院/天津医科大学总医院的施福东教授团队和加拿大卡尔加里大学医学部合作发表在Science杂志上的综述文章,系统回顾了神经炎症在多种神经系统疾病中的角色机制以及其临床治疗的现状和挑战。文章聚焦多发性硬化(MS)、脑卒中、AD与PD四类具代表性的神经疾病,从病理机制、免疫细胞参与、疾病进展及相应的治疗策略等多角度进行全面阐述,揭示了神经炎症作为神经退行性病变核心驱动力的关键地位,以及如何利用免疫调节药物干预神经炎症减少神经损伤的未来潜力。

研究方法
本研究为系统综述,整合来自临床与基础研究的最新成果,包括动物模型实验、人类脑组织病理学观察、分子遗传学研究及临床试验数据,综合分析神经炎症在上述四种主要神经疾病中的发病机制及治疗干预进展。研究重点不在于实验设计细节,而在于多角度整合和比较神经炎症特征和治疗策略。
研究结果
1,神经炎症在各疾病中的共同机制与异同
- 所有疾病均存在微胶质细胞的激活及免疫细胞的募集,神经炎症通过释放促炎细胞因子、氧化应激产物和蛋白酶加剧神经退行性损伤。
- 多发性硬化和脑卒中早期存在大量外周免疫细胞(尤其是T细胞和单核系细胞)的浸润,AD和PD中外周免疫细胞浸润较少,局限于脑膜及血管旁区,更多表现为CNS内微胶质和星形胶质细胞激活的持续炎症。
- 微胶质细胞活性的时间序列与功能表现存在明显差异:多发性硬化中微胶质细胞从早期即显有害特性;而在AD和PD中,微胶质细胞的激活呈双相变化,初期发挥清除异常蛋白的保护作用,后期则转变为促进炎症和神经毒性的亢奋状态。
- T淋巴细胞在MS中以克隆性扩张形式大量存在,表现为强烈且长期的自身免疫反应;AD和PD中则为低度浸润且数量有限,但仍能促进神经炎症。
- B细胞于MS患者脑膜和血管旁形成聚集簇,强烈参与病理,其他疾病中B细胞较为稀少且未见形成类似结构。
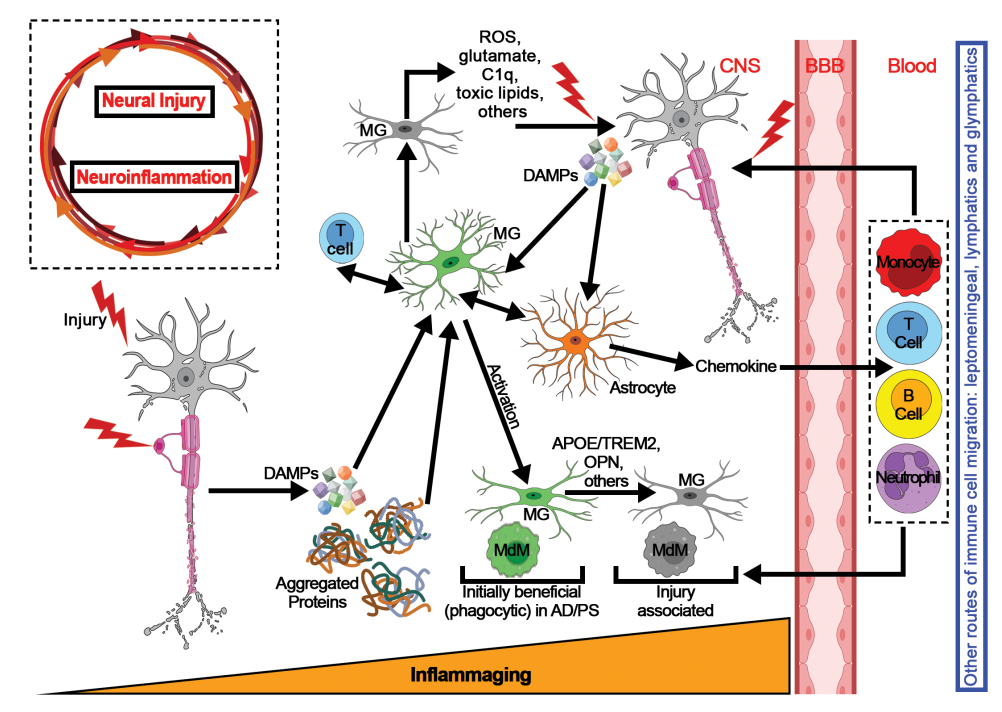
图:神经炎症与神经损伤相互促进
2,临床影像与病理证据支持神经炎症的作用
- PET成像利用转位蛋白(TSPO)配体显示MS和脑卒中急性及慢性阶段微胶质激活明显,且与疾病进展和症状严重度相关。
- AD早期和PD患者脑部亦检测到TSPO信号升高,提示活跃的微胶质细胞参与,但其作用具有阶段性和复杂性。
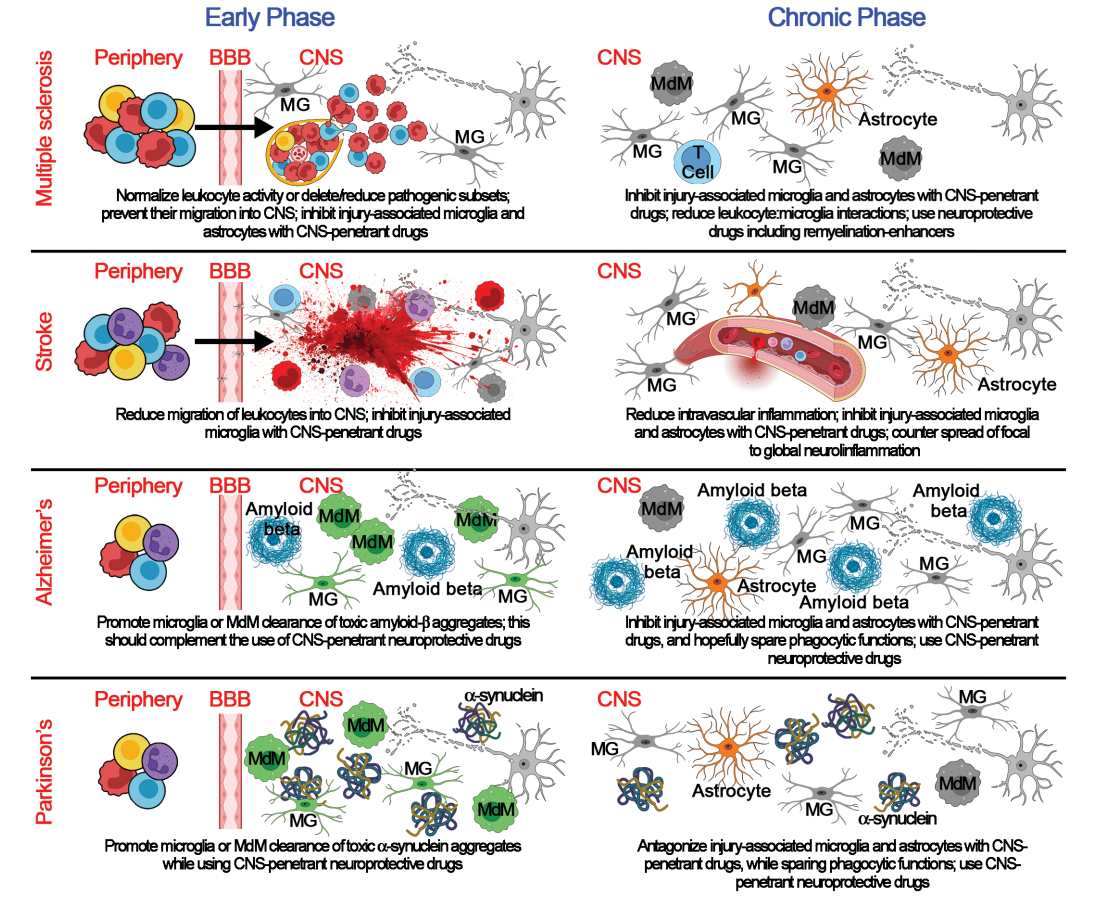
图:在不同疾病的急性和慢性阶段影响神经炎症的药物所需具备的作用
3,治疗策略现状及前景
- MS治疗取得巨大进展,20余种疾病修饰疗法(DMTs)通过抑制外周淋巴细胞增殖、阻断细胞迁移(如纳他珠单抗、佛尼度胺)或细胞耗竭(如奥雷珠单抗)显著减少复发和 CNS 内新病变形成。
- BTK(布鲁顿酪氨酸激酶)抑制剂作为一种新兴中枢渗透性药物,靶向微胶质细胞和B细胞,已经在进展期MS的多阶段临床试验中展现延缓残疾进展潜力。
- 脑卒中治疗中免疫调节尚处于探索阶段,Fingolimod 和纳他珠单抗部分临床试验显示短期改善,但尚无广泛临床应用,主要挑战为用药时机和作用靶点选择。新型对白介素及炎症通路靶点药物,如TLR4拮抗剂ApTOLL表现出积极前景。
- AD和PD中,免疫调节治疗起步晚,目前专注于控制蛋白聚集和神经炎症,如抗Amyloid抗体(Aducanumab、Lecanemab)虽能减少斑块,但对认知改善有限,且有副作用风险。促进微胶质细胞功能的TREM2激动剂及Masitinib等新药正在临床试验阶段。
- 常规抗炎药物(如萘普生、塞来昔布)在预防AD发病中未显示效益,提示需要更精准和强效的免疫干预策略。
4,神经炎症的复杂性与个体化挑战
- 神经炎症既有利于清除病理蛋白和修复受损组织,也可通过持续激活转变为促炎、神经毒性状态。
- 微胶质细胞呈现多样状态,未来治疗药物应精准调控其有害与有益功能的平衡,避免过度抑制清除功能。
- 神经炎症涉及多种细胞间交互(如T细胞与微胶质、微胶质与星形胶质细胞),理想疗法需针对关键介质(如补体C1q、骨桥蛋白)以及调控免疫细胞迁移的机制。
| 细胞/疾病状态 | 共同点 | 差异点 |
|---|---|---|
| 微胶质细胞 | 激活状态,促炎及神经毒性因子释放 | MS早期即有害,AD/PD出现早期保护-后期有害的双相活化 |
| T淋巴细胞 | 均有抗原特异性T细胞存在 | MS中数量多且持久,AD/PD中数量少且持续性未知 |
| B淋巴细胞 | 脑内均有B细胞存在 | MS脑内大量集合形成滤泡样结构,非MS疾病仅散在存在 |
| 蛋白质聚集和损伤 | DAMPs激活微胶质、星形胶质细胞 | 多发性硬化为免疫驱动起始事件,AD/PD为蛋白质错误折叠后继发炎症 |
| 治疗药物 | 免疫调节剂能缓解炎症 | MS治疗已成熟,卒中早期试验中,AD/PD免疫治疗仍为探索阶段 |
研究价值
这篇综述文章系统梳理了神经炎症在不同神经系统疾病中的多维度角色,突显了其在疾病进展中的核心地位。研究强调,虽然神经炎症在疾病间存在共性机制,例如微胶质细胞和外周免疫细胞的活化、促炎因子分泌等,但不同疾病中神经炎症的空间—时间特征及免疫组成的差异,需要针对具体病种设计特异的治疗方案。以多发性硬化为代表的周边免疫驱动性疾病,传统免疫抑制剂发挥显著疗效;而依赖于CNS内微胶质慢性激活的神经退行性疾病,则亟待CNS穿透的精准免疫调节剂出现。
新兴的BTK抑制剂、TREM2激动剂、补体系统抑制剂等靶向微胶质细胞的药物显示了广阔的前景。并提出将免疫治疗与去除致病蛋白质聚集的疗法联用,或许可期待协同改善预后。临床试验中诸如认知评估和功能评分等传统终点对免疫疗法反应的检测不足,呼吁发展更多影像及免疫生物标志物,促进精准评价治疗效果。这不仅拓宽了神经炎症治疗的视角,也为未来多病种的跨界治疗战略奠定基础。
梅斯小编点评
本综述为神经科学与神经免疫学领域构筑了扎实且系统的知识框架,揭示了神经炎症在多发性硬化、脑卒中、阿尔茨海默病及帕金森病中的异同及其治疗潜力。多发性硬化已成为神经免疫治疗的成功典范,然而非自身免疫性神经疾病中,靶向微胶质细胞和局灶神经炎症的治疗仍充满挑战,特别是在血脑屏障的限制以及免疫细胞双向调节特性之间取得平衡。
未来研究建议聚焦动态解析微胶质细胞功能多样性及其免疫互作网络,开发能精准区分有益与有害活化状态的分子标志,进而设计阶段特异性治疗方案。此外,联合免疫治疗与蛋白错误折叠及神经元保护策略可能突破当前临床疗效瓶颈。最后,常用免疫调节剂(如羟氯喹、烟酰胺)及嵌合抗原受体(CAR)T细胞疗法的潜力值得深入探索,开启神经疾病治疗的新篇章。
原始出处
Shi F-D, Yong VW. Neuroinflammation across neurological diseases. Science. 2025 Jun 19;388(6642):ea dx0043. doi: 10.1126/science.adx0043.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#神经系统疾病# #神经炎症#
19 举报