【协和医学杂志】人体脂肪分布与颈动脉粥样硬化的相关性
9小时前 协和医学杂志 协和医学杂志 发表于上海
进一步分析脂肪分布与颈动脉粥样硬化的相关性,旨在为肥胖/超重人群颈动脉硬化的防控提供理论依据。
由于人们生活方式和饮食结构的变化,肥胖发生率持续攀升。据世界肥胖联盟预计,至2035年,全球将有超过40亿肥胖/超重人群,占全球总人口的一半以上[1]。我国超重与肥胖的发病率和增长速度均居世界首位,已成为全球超重和肥胖人数最多的国家[2-4]。预计至2030年,我国成人肥胖患病率将达61%左右[5]。
肥胖是慢性非传染性疾病的危险因素之一,且不同类型的肥胖在预测心血管事件发生方面具有不同预测价值。研究表明,腹型肥胖预测心血管事件发生风险的价值高于全身性肥胖[6]。颈动脉粥样硬化与心脑血管动脉粥样硬化呈正相关,且二者有共同的病理基础和危险因素[7]。
此外,研究还显示,内脏脂肪与颈动脉粥样硬化、冠心病的发生密切相关[8-11]。体质量指数(BMI)和腰臀比是临床常用的肥胖评估指标,但BMI不能反映内脏脂肪分布情况,腰臀比仅能粗略反映肥胖类型。因此,探索新的肥胖评估指标以准确评价脂肪分布情况具有重要临床意义。
本研究通过Inbody人体成分分析仪得出受试者人体成分数据,分析人体成分与颈动脉粥样硬化的相关性,并将躯干脂肪与四肢脂肪的比值(躯干脂肪/四肢脂肪)、腰臀比、内脏脂肪面积按照四分位数分组,进一步分析脂肪分布与颈动脉粥样硬化的相关性,旨在为肥胖/超重人群颈动脉硬化的防控提供理论依据。
资料与方法
1.1 研究对象
本研究为回顾性横断面分析,以2020年1月—2023年1月北京协和医院国际医疗部(西单院区)健康管理中心体检的健康人群为研究对象,收集其临床资料,包括一般资料、实验室指标、Inbody770人体成分分析及颈动脉超声检查结果。
入选标准:(1)年龄≥18岁;(2)过去1年内至少进行过1次全面体检,包括血液检测、人体成分分析和颈动脉超声检查;(3)本地居民。
排除标准:(1)有严重心肝肾疾病或功能障碍;(2)有病情未控制的糖尿病、甲状腺功能亢进等疾病;(3)应用糖皮质激素;(4)存在新发肿瘤;(5)重要指标资料不完整。
本研究已通过北京协和医院伦理审查委员会审批(审批号:K6719),并豁免研究对象知情同意。
1.2 研究方法
一般资料收集:(1)基本信息:年龄、性别、既往病史(高血压、糖尿病、痛风等);(2)查体数据:身高、体重、收缩压、舒张压、腰围(通过腋中线肋弓最低点和髂前上嵴最高点的中点沿腰围一周的距离)、臀围(沿臀部膨隆处一周的距离),并计算BMI和腰臀比。
实验室检查:禁食≥9 h后,采集研究对象的血标本,记录血糖、糖化血红蛋白、血脂[总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)]、尿酸(UA)、同型半胱氨酸(HCY)等指标结果。
常规采用宽频或变频线阵探头联合低频凸阵探头或小凸阵探头或扇形探头对研究对象进行颈动脉彩色多普勒超声检查。超声检查由医院3 名有 5 年以上经验的超声医师共同完成,所有操作严格按照《中国脑卒中血管超声检查指导规范》[12]实施。 详细记录双侧颈总动脉、颈动脉内膜中层厚度(CIMT),并观察是否有颈动脉粥样硬化斑块,记录斑块位置、大小、形态及声波特征。CIMT增厚≥1.0 mm定义为颈动脉内膜增厚;CIMT增厚≥1.5 mm,凸出于血管腔内,或局限性内膜增厚高于周边CIMT的50%定义为颈动脉粥样硬化斑块[13]。本研究中,颈动脉粥样硬化包括颈动脉内膜增厚或存在颈动脉斑块两种情况。
采用Inbody770人体成分分析仪检测人体成分,包括体脂肪量、体脂率、去脂体重、骨骼肌量、骨骼肌指数(SMI)、躯干脂肪、四肢脂肪、内脏脂肪面积等指标。
1.3 样本量计算
基于颈动脉粥样硬化在体检人群中的发生率,并参考以往文献数据显示的我国颈动脉粥样硬化发病率为21.0%进行样本量计算。为确保研究结果的精确性,设定误差不超过2%(即置信区间上限与下限之差为4%)。本研究设定显著性水平α=0.05(双侧检验),采用PASS 15.0统计分析软件进行样本量估算。初步计算结果显示需纳入1624名研究对象,考虑可能存在10%的脱失率,至少应纳入1805名研究对象,以保证研究设计的科学性。
1.4 统计学处理
数据采用易侕软件2.0以及R语言进行统计学分析。符合正态分布的连续变量以均数±标准差表示,组间比较采用独立样本t检验;分类变量以频数(百分数)表示,组间比较采用χ2检验。采用多元Logistic回归分析探讨人体脂肪分布与颈动脉粥样硬化的相关性,计算优势比(OR)及95%置信区间(CI)。为进一步探究人体脂肪分布与颈动脉粥样硬化的相关性,根据四分位数(Q1、Q2、Q3、Q4)将躯干脂肪/四肢脂肪、内脏脂肪面积、腰臀比进行分组比较,并绘制森林图以直观显示人体脂肪分布与颈动脉粥样硬化发生风险的相关性。所有统计检验均为双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 研究对象基本资料
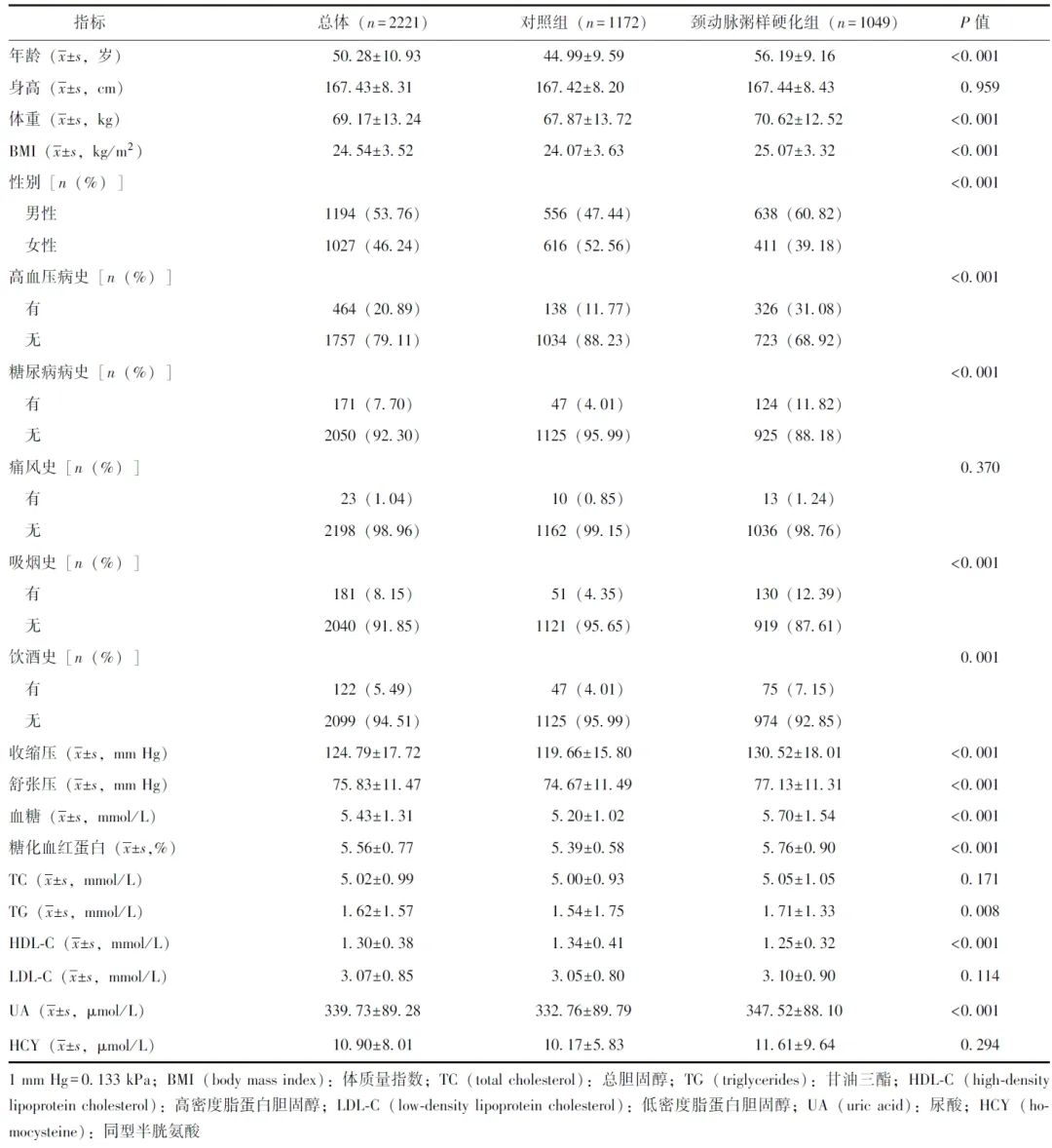
本研究共纳入健康体检人群2221名,其中男性1194名(53.76%),女性1027名(46.24%),平均年龄为(50.28±10.93)岁。根据颈动脉超声检查结果将研究对象分为颈动脉粥样硬化组(n=1049)和对照组(n=1172)。颈动脉粥样硬化组平均年龄、男性占比、体重、BMI高于对照组(P均<0.001)。与对照组比较,颈动脉粥样硬化组有高血压病史、糖尿病病史人数占比以及收缩压、舒张压显著升高(P均<0.001)。与对照组比较,颈动脉粥样硬化组血糖、糖化血红蛋白(HbA1c)、TG、UA等指标水平均显著升高(P均<0.05)。详见表1。
表1 颈动脉粥样硬化组与对照组的基线资料比较
2.2 人体成分分析结果
人体成分分析结果显示,颈动脉粥样硬化组腰臀比、去脂体重、骨骼肌量、SMI、体脂肪量、体脂率、躯干脂肪量、躯干脂肪率、四肢脂肪量、躯干脂肪/四肢脂肪、内脏脂肪面积和基础代谢率较对照组升高,差异均具有统计学意义(P均<0.05)。 而两组四肢脂肪率比较,差异无统计学意义(P=0.549)。详见表2。
表2 颈动脉粥样硬化组与对照组人体成分比较
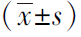
2.3 人体成分与颈动脉粥样硬化的多因素Logistic回归分析结果
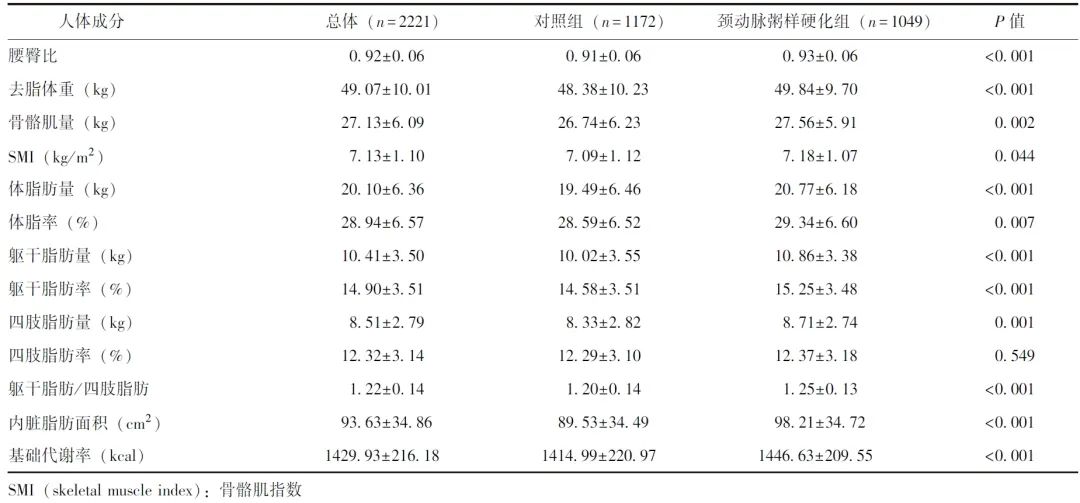
多因素Logistic回归分析结果表明,在未调整其他变量的模型1中,除四肢脂肪率外,其他人体成分指标均与颈动脉粥样硬化发生风险显著相关(P均<0.05),其中,躯干脂肪/四肢脂肪与颈动脉粥样硬化发生风险相关性最为显著(OR=15.626, 95% CI:8.252~29.589,P<0.001)。
在调整了年龄、性别、吸烟史和饮酒史的模型2中,虽然有关指标的相关性减弱,但躯干脂肪/四肢脂肪与颈动脉粥样硬化风险的关联性依然显著,该比值每增加1个单位,颈动脉粥样硬化风险增加约3.7倍(OR=4.693,95% CI: 1.761~12.506,P=0.002)。腰臀比每增加1个单位,颈动脉粥样硬化风险略升高(OR=1.001, 95% CI: 1.000~1.002, P=0.004)。以上结果表明,控制主要混杂因素后,体脂分布特征(特别是躯干脂肪/四肢脂肪和腰臀比)与颈动脉粥样硬化仍存在显著相关性。详见表3。
表3 颈动脉粥样硬化和人体成分的相关性分析
2.4 四分位数分组比较结果
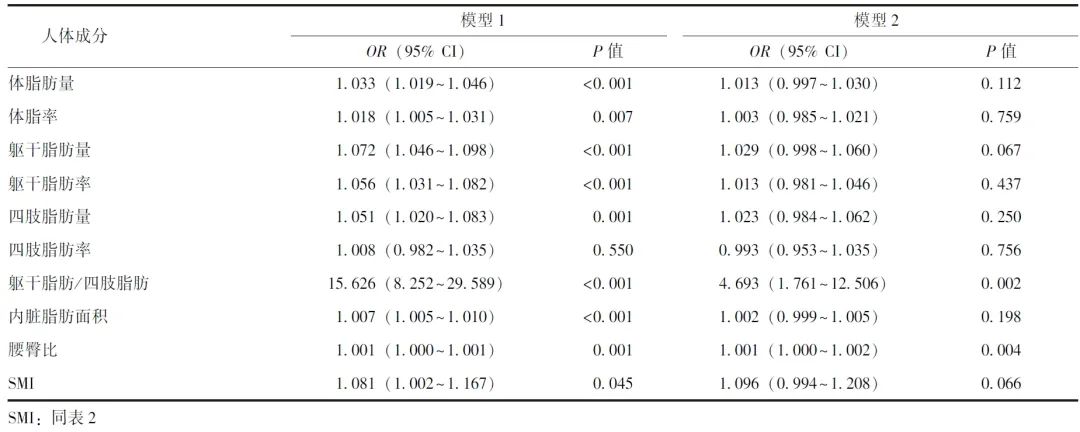
调整年龄、性别、吸烟史和饮酒史后,将躯干脂肪/四肢脂肪、内脏脂肪面积、腰臀比3个变量根据四分位数(Q1~Q4)分为Q1组、Q2组、Q3组和Q4组,其中Q1组为参照。结果显示,躯干脂肪/四肢脂肪、内脏脂肪面积和腰臀比与颈动脉粥样硬化风险具有相关性。调整年龄和性别后,在躯干脂肪/四肢脂肪方面,与Q1组比较,Q4组动脉粥样硬化风险显著增加(OR=1.81, 95% CI: 1.26~2.61, P=0.001),表明较高的躯干脂肪含量可显著增加颈动脉粥样硬化风险。在内脏脂肪面积方面,Q2组、Q3组和Q4组的颈动脉粥样硬化风险均高于Q1组,但差异无统计学意义(P>0.05)。在腰臀比方面,Q4组颈动脉粥样硬化风险高于Q1组,但差异无统计学意义(OR=1.29, 95% CI: 0.96~1.72, P=0.090),详见图1。
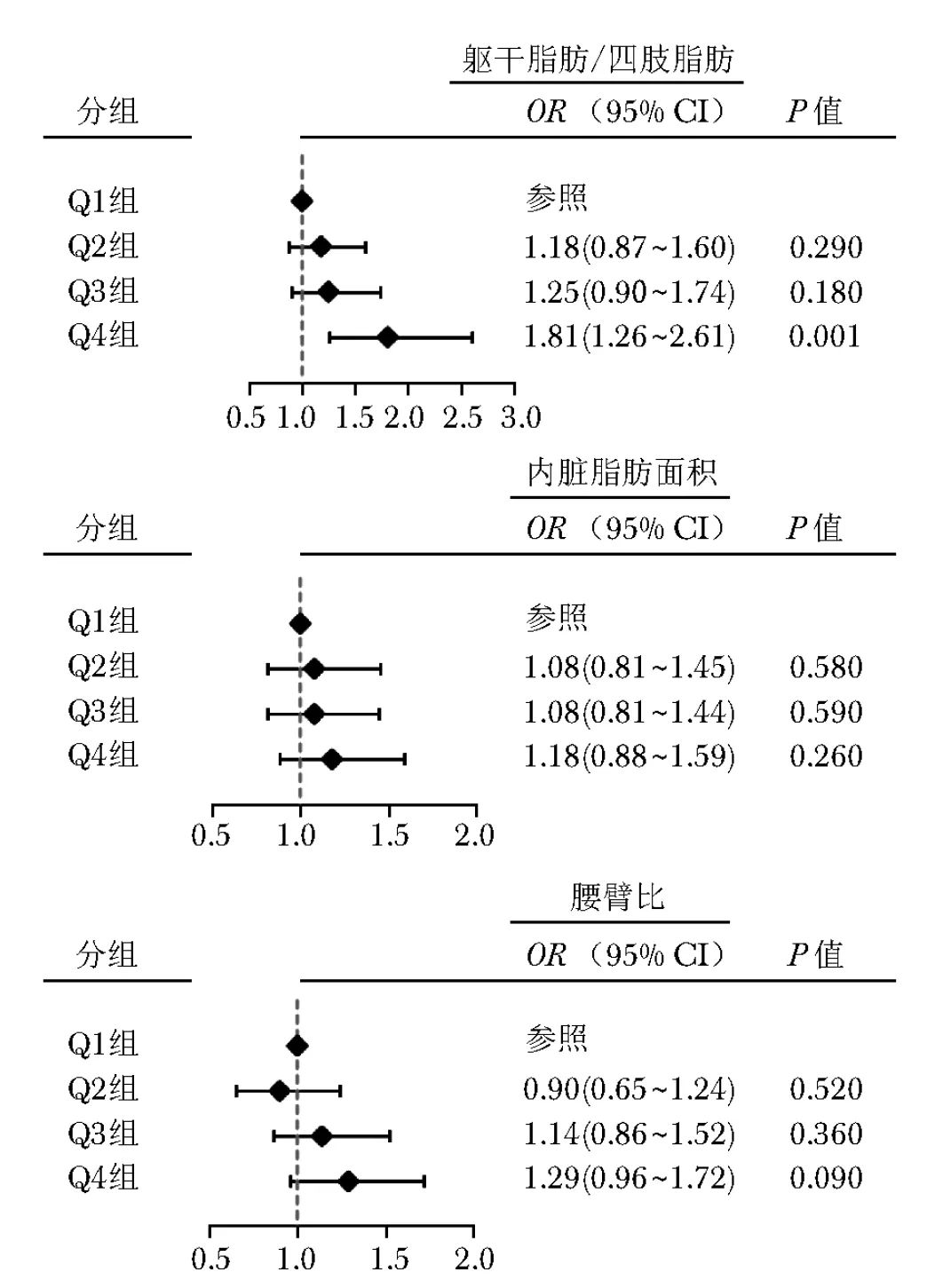
图1 躯干脂肪/四肢脂肪、内脏脂肪面积及腰臀比与颈动脉粥样硬化关系的森林图
3 讨论
肥胖是动脉粥样硬化的重要诱因之一,其通过引发慢性低度炎症反应,导致一系列复杂的病理生理变化,最终促进动脉粥样硬化的形成[14]。在这一过程中,脂肪组织产生多种炎症因子,如白细胞介素(IL)-6、IL-8、肿瘤坏死因子-α[14-15]等,这些炎症因子不仅可降低胰岛素敏感性,还会促进促炎免疫细胞如M1巨噬细胞[16-17]的招募和激活,进而造成血管舒张能力受损和动脉血管壁重构,促进动脉粥样硬化的形成。
研究显示,不同类型脂肪尤其是腹部内脏脂肪与颈动脉粥样硬化密切相关。Randrianarisoa等[8]对731例无明显心血管疾病的非糖尿病受试者行颈部超声检查,结果显示,内脏脂肪指数与CIMT相关,二者的相关性高于胰岛素抵抗指数与CIMT的相关性,因此内脏脂肪指数可用于评估非糖尿病人群的动脉粥样硬化发生风险。一项横断面研究探讨了中国人内脏脂肪指数与CIMT的相关性,结果显示中国人内脏脂肪指数>106的人群颈动脉粥样硬化风险显著增加[9]。BMI是衡量肥胖程度的重要指标,但无法准确反映内脏脂肪分布情况,而腰臀比仅可对内脏和腹部脂肪相对量进行粗略估计,因此需寻找评估结果准确,且适合大规模人群筛查的评估指标。本研究采用Inbody人体成分分析仪分析研究对象的人体成分,可进一步细化脂肪分布情况与颈动脉粥样硬化风险的相关性。
本研究结果显示,调整年龄、性别、吸烟及饮酒史后,躯干脂肪/四肢脂肪、腰臀比与颈动脉粥样硬化发生风险具有显著相关性,提示具有较高躯干脂肪/四肢脂肪、腰臀比的人群发生颈动脉粥样硬化的风险较高,需重点筛查,也显示躯干脂肪/四肢脂肪、腰臀比在心血管健康评估中的潜在价值。为进一步探究脂肪分布与颈动脉粥样硬化的相关性,本研究将躯干脂肪/四肢脂肪、腰臀比、内脏脂肪面积按四分位数分组,结果显示,躯干脂肪/四肢脂肪越高的人群发生颈动脉粥样硬化的风险越大,提示除关注血脂、血糖、血压因素外,还应重视脂肪分布变化,尤其是躯干脂肪/四肢脂肪的变化。腰臀比、内脏脂肪面积按照四分位数分组进行比较,结果显示,与Q1组比较,Q2组、Q3组和Q4组的颈动脉粥样硬化风险差异无统计学意义,与既往研究结果不符,可能与干扰因素如口服他汀类降血脂药物等的影响有关。
本研究不足之处在于躯干脂肪无法区分内脏脂肪与皮下脂肪,内脏脂肪面积仅能粗略评估内脏脂肪,可采用双能X线吸收测量法(DXA)或腹部CT更准确地评估内脏脂肪和皮下脂肪。然而,与DXA、腹部CT相比,Inbody人体成分分析无需复杂操作技巧,更适合基层社区医务人员使用,是社区基层医疗单位防控向心性肥胖、动脉粥样硬化等慢性疾病的有效工具。
综上,人体脂肪分布与颈动脉粥样硬化发生具有显著相关性,躯干脂肪/四肢脂肪越高,颈动脉粥样硬化发病率越高。内脏脂肪面积与颈动脉粥样硬化发生的关联机制更为复杂,需进一步深入探究二者的相关性。
参考文献
[1]World Obesity Federation.World obesity atlas 2023[EB/OL].[2023-04-30]. https://data.worldobesity.org/publications/?cat=19.
[2]Hedley A A, Ogden C L, Johnson C L, et al. Prevalence of overweight and obesity among US children, adolescents, and adults, 1999—2002[J]. JAMA, 2004, 291(23): 2847-2850.
[3]Wang Y, Wang L, Qu W. New national data show alarming increase in obesity and noncommunicable chronic diseases in China[J]. Eur J Clin Nutr, 2017, 71(1): 149-150.
[4]Ng M, Fleming T, Robinson M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980—2013: a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2014, 384(9945): 766-781.
[5]王友发, 孙明晓, 薛宏, 等. 《中国肥胖预防和控制蓝皮书》解读及中国肥胖预防控制措施建议[J]. 中华预防医学杂志, 2019, 53(9): 875-880.
[6]Yuan S, Bruzelius M, Xiong Y, et al. Overall and abdominal obesity in relation to venous thromboembolism[J]. J Thromb Haemost, 2021, 19(2): 460-469.
[7]陈丽萍, 于国良, 杨春海. 高分辨率超声检测高血压和冠心病患者的动脉壁增厚及粥样硬化斑块[J]. 中国超声医学杂志, 1998, 14(3): 16-18.
[8]Randrianarisoa E, Lehn-Stefan A, Hieronimus A, et al. Visceral adiposity index as an independent marker of subclinical atherosclerosis in individuals prone to diabetes mellitus[J]. J Atheroscler Thromb, 2019, 26(9): 821-834.
[9]Wang X L, Si Z K, Wang H, et al. Association of Chinese visceral adiposity index and carotid atherosclerosis in steelworkers: a cross-pal study[J]. Nutrients, 2023, 15(4): 1023.
[10]Kouli G M, Panagiotakos D B, Kyrou I, et al. Visceral adiposity index and 10-year cardiovascular disease incidence: the ATTICA study[J]. Nutr Metab Cardiovasc Dis, 2017, 27(10): 881-889.
[11]Qiao T, Luo T, Pei H, et al. Association between abdominal obesity indices and risk of cardiovascular events in Chinese populations with type 2 diabetes: a prospective cohort study[J]. Cardiovasc Diabetol, 2022, 21(1): 225.
[12]国家卫生计生委脑卒中防治工程委员会. 中国脑卒中血管超声检查指导规范[J]. 中华医学超声杂志(电子版), 2015, 12(8): 599-610.
[13]肖渊茗, 陈志恒, 武留信, 等. 颈动脉超声检查在健康体检人群中的应用[J]. 中华健康管理学杂志, 2016, 10(1): 66-70.
[14]Li P, Wang L, Liu C. Overweightness, obesity and arterial stiffness in healthy subjects: a systematic review and Meta-analysis of literature studies[J]. Postgrad Med, 2017, 129(2): 224-230.
[15]Cox A J, West N P, Cripps A W. Obesity, inflammation, and the gut microbiota[J]. Lancet Diabetes Endocrinol, 2015, 3(3): 207-215.
[16]Koenen M, Hill M A, Cohen P, et al. Obesity, adipose tissue and vascular dysfunction[J]. Circ Res, 2021, 128(7): 951-968.
[17]Aroor A R, Jia G H, Sowers J R. Cellular mechanisms underlying obesity-induced arterial stiffness[J]. Am J Physiol Regul Integr Comp Physiol, 2018, 314(3): R387-R398.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















前往app查看评论内容
1 0 举报