Translational Psychiatry:猴免疫缺陷病毒感染早期阶段恒河猴大脑转录组学分析揭示HAND潜在机制
2025-02-04 xiongjy MedSci原创 发表于陕西省
SIV感染早期(第10天和第20天)显著诱导恒河猴前额叶皮层中抑制性中间神经元的丧失和广泛的基因表达异常。感染后第10天,免疫应答和炎症相关基因显著上调,而第20天免疫激活减弱,但神经元损伤持续存在。
人类免疫缺陷病毒(HIV)感染不仅会导致获得性免疫缺陷综合征(AIDS),还与一系列神经认知障碍(HAND)密切相关。尽管现代抗逆转录病毒治疗(ART)显著延长了HIV感染者的寿命,HAND的发病率仍然居高不下,尤其是在轻度至中度认知障碍方面。HAND的神经病理特征包括神经元丧失、突触损伤以及神经炎症反应。然而,由于缺乏能够在感染早期动态观察脑内分子变化的研究,人类相关研究受限于尸检样本和合并症干扰,致使我们对HAND早期发病机制的理解仍不充分。

本研究利用猿免疫缺陷病毒(SIV)感染恒河猴模型,探讨了早期系统性感染阶段(感染后第10天和第20天)前额叶皮层内的基因表达变化及神经元损伤情况。研究采用单核转录组测序(snRNA-seq)技术,分析了SIV感染后不同时期恒河猴大脑前额叶皮层中神经元和神经胶质细胞的转录组差异,旨在揭示潜在的细胞类型特异性分子机制,从而为理解HIV相关神经认知障碍的早期病理改变提供新的线索。
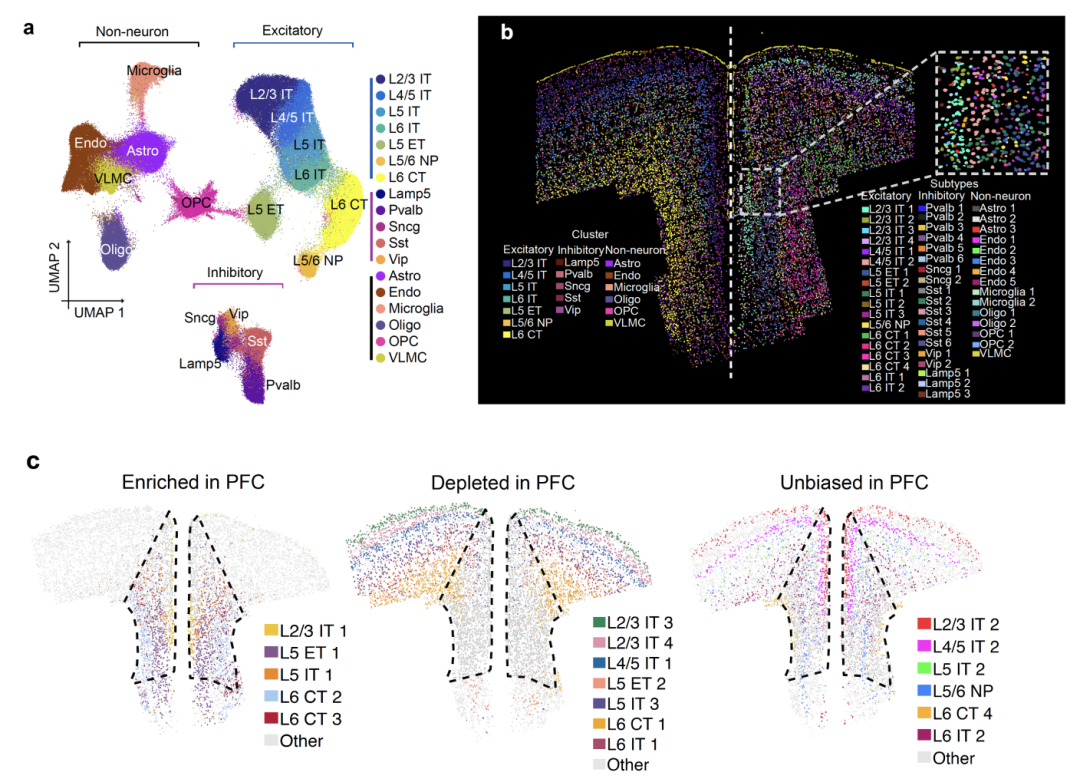
研究共纳入6只健康的Mamu-A*01阳性恒河猴,随机分为3组,分别在感染SIVmac251病毒后第10天和第20天取样,并设置未感染的对照组。脑组织样本经过单核提取、文库构建及高通量测序,最终获得69,151个高质量的细胞核转录组数据。通过Seurat包进行数据预处理、聚类分析和细胞注释,研究鉴定出15种不同的细胞亚群,包括兴奋性神经元、抑制性中间神经元、星形胶质细胞、少突胶质前体细胞、少突胶质细胞、微胶质细胞、血管周细胞及内皮细胞等。

图1:中间神经元的选择性丧失
研究结果显示,SIV感染早期可导致前额叶皮层中抑制性中间神经元的显著丧失。具体而言,感染后第10天,中间神经元的比例由32.1%下降至17.5%,而到第20天进一步下降至11.3%。免疫组化分析结果与转录组数据一致,显示γ-氨基丁酸脱羧酶67(GAD67)的表达在灰质和白质中均显著降低,提示中间神经元的广泛丧失。此外,微胶质细胞的数量在感染后显著增加,表明存在神经炎症反应,而血管周细胞的比例则明显下降,可能影响血脑屏障的完整性。
基因差异表达分析(DEGs)揭示了SIV感染诱导的细胞类型特异性转录组改变。在感染后第10天,鉴定出3490个差异表达基因(DEGs),其中1100个基因上调,2390个基因下调;而在第20天,差异基因数量减少至1282个(118个上调,1164个下调)。这些差异基因涉及多条信号通路,包括I型干扰素信号通路、细胞因子信号通路和抗病毒反应通路等。进一步的富集分析表明,许多基因调控与免疫应答、神经炎症及神经退行性疾病相关。
值得注意的是,研究发现SIV感染诱导的基因表达改变具有时间依赖性。在感染后第10天,差异基因主要集中在与抗病毒免疫应答相关的通路,如干扰素信号通路和炎症反应通路,表明此阶段存在急性免疫激活。而到第20天,这些免疫相关基因的表达水平明显下降,提示免疫反应逐渐减弱,但神经元损伤和基因表达异常仍然持续存在。这种变化模式提示,早期SIV感染可能通过诱导免疫激活和炎症反应,进而导致神经元损伤和神经认知功能障碍。

图2:差异表达基因(DEGs)的火山图、Venn图及富集分析结果
研究还探讨了SIV感染对神经元-神经胶质细胞相互作用的影响。细胞间互作网络分析显示,SIV感染显著改变了配体-受体相互作用的表达模式,尤其是在星形胶质细胞和兴奋性神经元之间。例如,编码分泌型磷蛋白1(SPP1)的基因在星形胶质细胞中下调,而其受体CD44在兴奋性神经元中也呈现下调,提示这一配体-受体对的失活可能削弱神经元的突触可塑性和神经保护机制。此外,研究发现SIV感染可调控多种转录因子和微小RNA(miRNA)的表达,例如IRF家族转录因子和miR-130a,这些分子在调控免疫应答和神经炎症中具有重要作用。
尽管本研究揭示了SIV感染早期前额叶皮层内的广泛分子和细胞变化,但仍存在一定局限性。首先,样本量较小可能限制了结果的泛化性;其次,研究仅关注早期感染阶段,尚未探讨长期感染对脑结构和功能的影响。未来研究需扩大样本规模,延长随访时间,并结合不同脑区的转录组数据,以全面揭示HIV/SIV感染相关神经病理变化的动态过程。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















干扰信号通路
31 举报
#前额叶皮层# #SIV感染# #神经认知障碍# #神经炎症# #恒河猴模型#
36 举报