绘真约大咖 | 宁忠华教授:聚焦常见的中枢神经系统肿瘤,为什么都需要注重基因检测?
2025-07-18 苏州绘真医学 苏州绘真医学 发表于上海
基因检测在中枢神经系统肿瘤中意义重大,可辅助脑胶质瘤、髓母细胞瘤等多种肿瘤的分型、分级、治疗指导及预后评估,推动精准诊疗。
随着病理学的发展和病理检测技术的进步,尤其是第二代测序技术(NGS)、全基因组甲基化测序(WGBS)等组学技术的提高,肿瘤遗传背景和发生发展机制逐渐清晰。越来越多的分子生物学标志物被证实在中枢神经系统(CNS)肿瘤分类、分型、分级、治疗和预后方面发挥重要作用。2016 年世界卫生组织(WHO)中枢神经系统肿瘤分类第四版修订版首次在组织学形态的基础上引入分子表型,提出整合诊断的理念,旨在提高病理诊断的客观性和可重复性,完善个体化管理流程,促进临床试验、基础实验和流行病学研究的开展,并为优化资源配置、制定政策提供支持。
针对基因检测在中枢神经系统肿瘤患者中的价值,小编整理了几个问题:1.脑胶质瘤患者,做基因检测主要有哪些指导意义?2.髓母细胞瘤患者,做基因检测主要有哪些指导意义?3.室管膜瘤患者,做基因检测主要有哪些指导意义?4.垂体瘤患者,做基因检测主要有哪些指导意义?5.脑膜瘤患者,做基因检测主要有哪些指导意义?
绘真:
1.脑胶质瘤患者,做基因检测主要有哪些指导意义?
宁忠华教授:
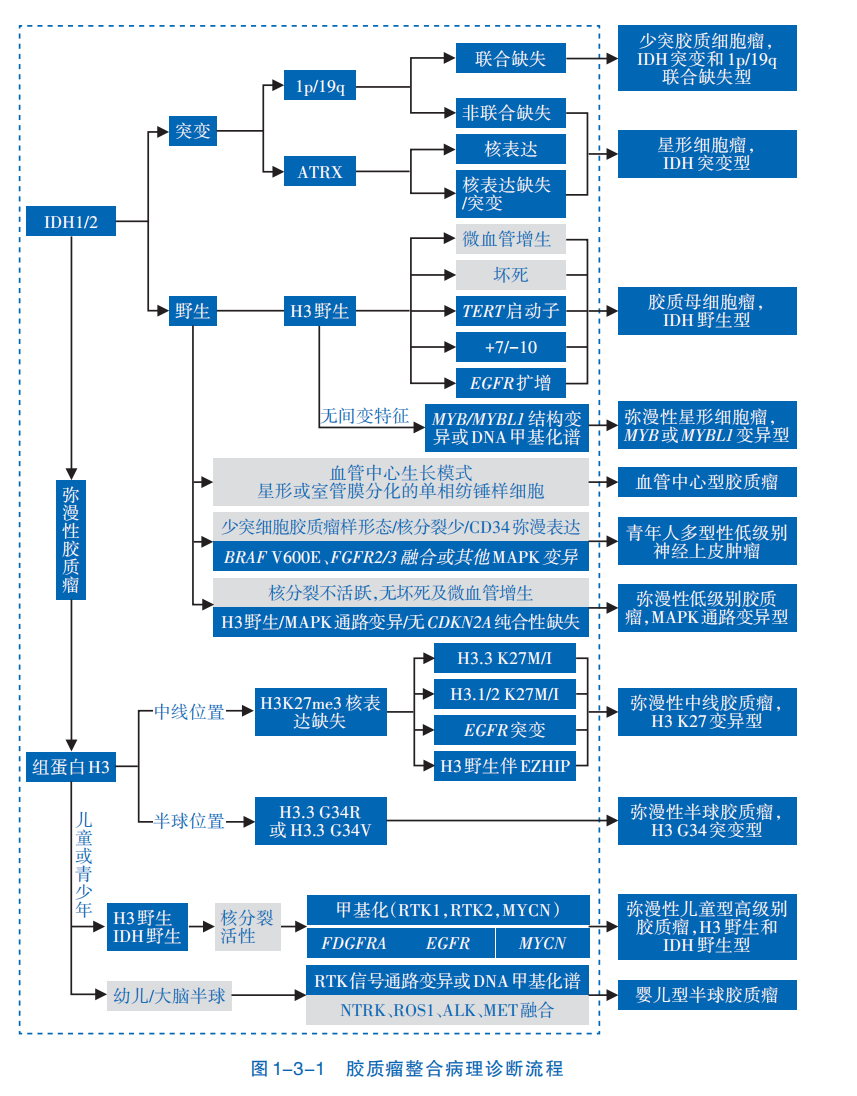
脑胶质瘤作为最常见的原发性颅内肿瘤,目前采用以手术为主,结合放疗、化疗的综合治疗模式。其确诊和分型依赖于组织病理学和分子突变的整合诊断。
《2021版WHO中枢神经系统肿瘤分类》遵循“综合和分层诊断”原则,诊断依据组织学形态与分子标记物,将成人型弥漫性胶质瘤明确划分为三大类型:第一种星形细胞瘤(IDH突变型)、第二种少突胶质细胞瘤(IDH突变和1p/19q共缺失型)、第三胶质母细胞瘤(IDH野生型)。这一分类方式凸显了分子标志物在脑胶质瘤诊疗中的关键作用。
在肿瘤分级与预后评估方面,像CDKN2A/B纯合缺失变异可使弥漫性星形细胞胶质瘤IDH突变型直接归为WHO 4级,提示预后不良;而TERT启动子突变是判断胶质母细胞瘤亚型的重要依据,《中国恶性肿瘤学科发展报告(2023年)》的数据显示,TERT突变在胶质瘤患者中发生的几率为 45%。
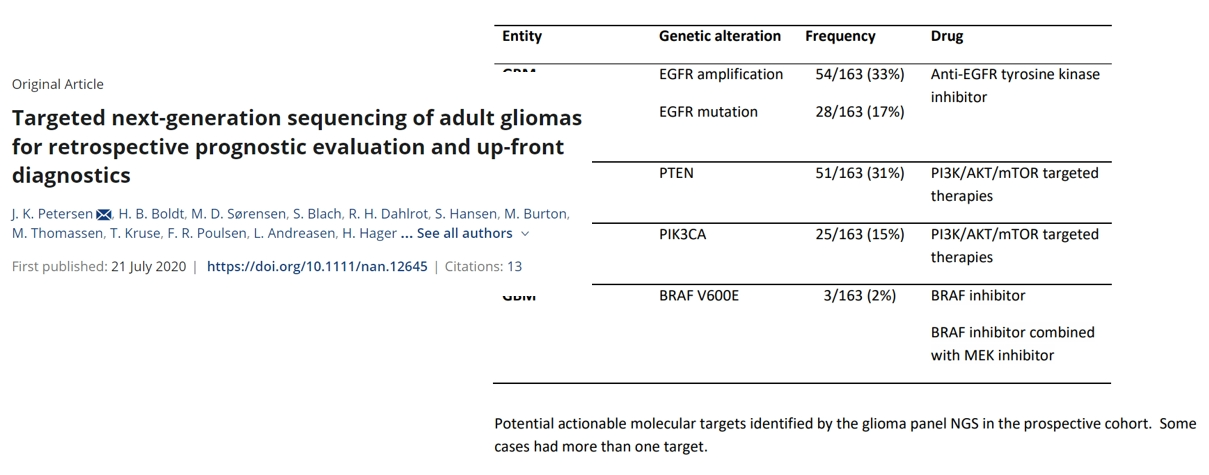
在靶向治疗指导层面,PTPRZ1-MET(ZM)融合、NTRK融合、FGFR变异、IDH突变等均能为脑胶质瘤提供精准治疗方向,受到国内外指南的强烈推荐;在免疫治疗领域,肿瘤细胞PD-L1表达、微卫星不稳定(MSI)等均属于应检测的疗效指标。研究证实,通过NGS检测,超过半数的胶质母细胞瘤存在可干预的分子靶点。由此可见,基因检测已成为明确脑胶质瘤分子分型、制定个体化治疗方案、精准判断预后的核心环节,正推动诊疗模式向精准化、标准化阶段迈进。








绘真:
2.髓母细胞瘤患者,做基因检测主要有哪些指导意义?
宁忠华教授:
常有髓母细胞瘤患者来询问需不需要做基因检测,或者做基因检测有哪些意义。今天我来回答一下大家关于这方面的疑问。首先我介绍下什么是髓母细胞瘤。髓母细胞瘤(medulloblastoma,MB)是起源于小脑早期神经祖细胞的胚胎性恶性肿瘤,在儿童群体中最为常见。其标准治疗策略为手术联合全脑全脊髓放疗及辅助化疗。
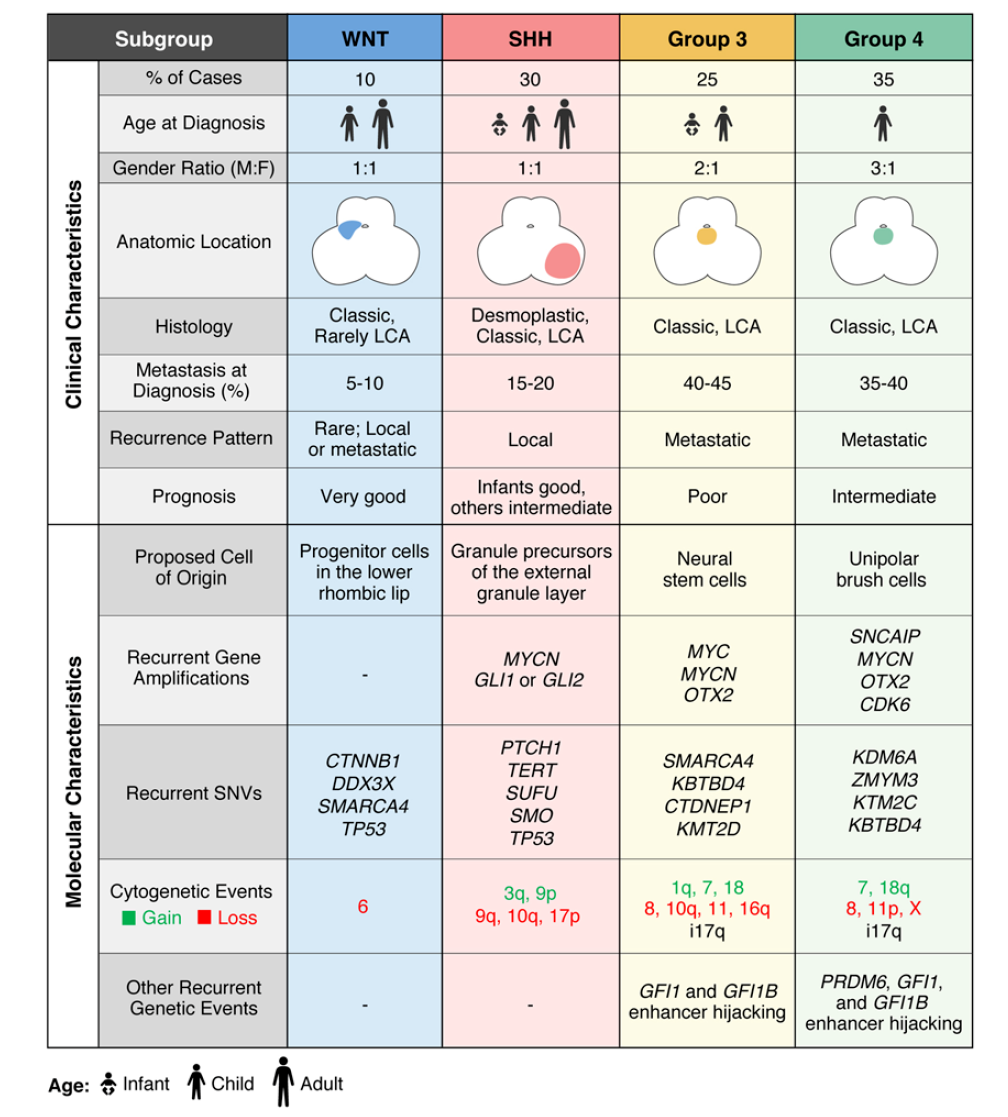
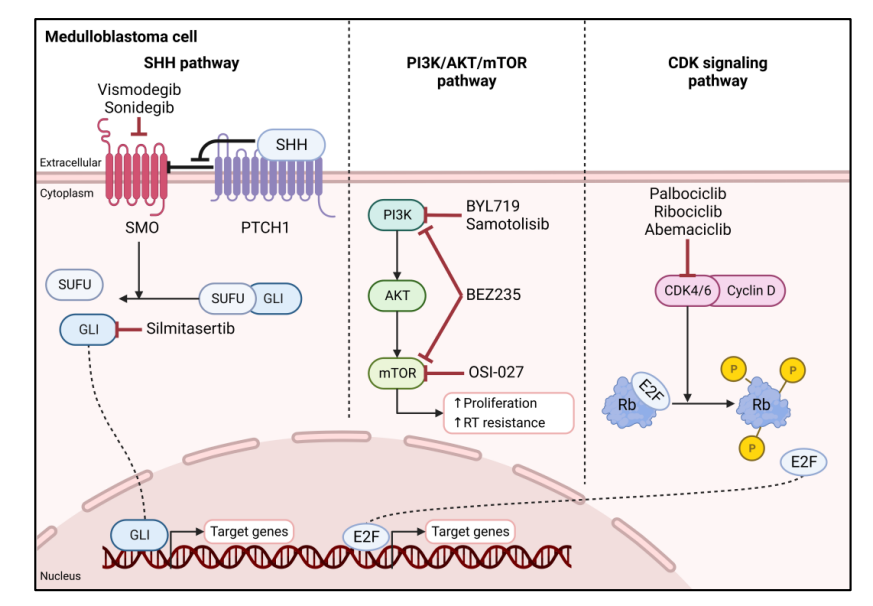
《中国髓母细胞瘤整合诊治指南》指出,近年来针对髓母细胞瘤基因分型及其预后意义的研究已形成共识—髓母细胞瘤可分为WNT、SHH、Group3和Group4四大分子亚型,各亚型在组织起源、年龄分布、分子特征与临床结局上均存在明显差异。具体而言,像《儿童髓母细胞瘤诊疗规范》的介绍,CTNNB1突变对应WNT型,PTCH1/SMO/SUFU突变对应SHH型,MYC扩增(与染色体17q一些异常)对应G3型,CDK6和MCYN扩增(及染色体17q异常等)对应G4型。
此外,约5%的MB患者存在遗传性基因背景,临床推荐检测SUFU、PTCH1、APC、TP53、BRCA2等基因变异,以实现髓母细胞瘤的早期预防和诊断。由此可见,基因检测可辅助完成患者的分子分型、预后评估及遗传性分析。
在儿童中枢神经系统肿瘤NCCN指南中,基于患者分子分型(WNT型、SHH型、非WNT/非SHH型)、基因变异、手术切除程度、组织学类型及播散情况,将儿童髓母细胞瘤划分为低危组、标危组、高危组和极高危组,并据此推荐差异化的放化疗辅助及维持治疗方案。
在治疗层面,NCCN指南建议,携带SHH通路相关基因突变(如PTCH1基因失活突变)的成人髓母细胞瘤患者,可考虑维莫德吉(Vismodegib)治疗。此外,更多基于基因检测指导的靶向治疗方案逐步在临床研究中展现潜力。








绘真:
3.室管膜瘤患者,做基因检测主要有哪些指导意义?
宁忠华教授:
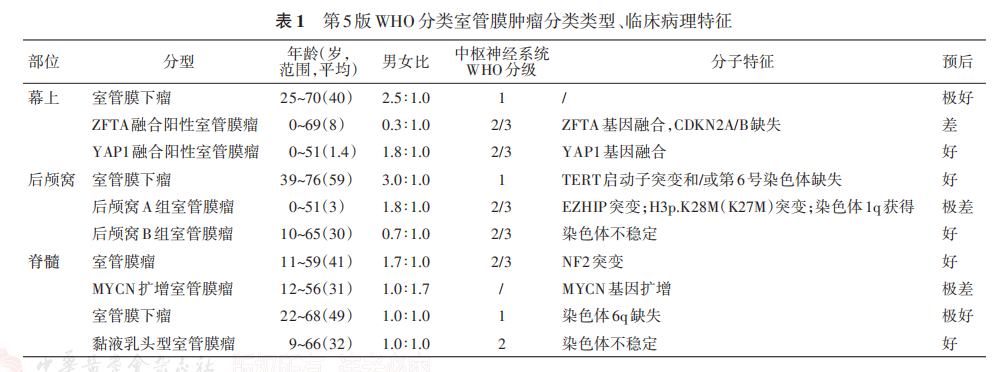
接下来我介绍一下什么是室管膜肿瘤。室管膜肿瘤是一组具有室管膜分化特征的界限清楚的大脑或脊髓神经胶质瘤,其发生发展与特定分子变异密切相关,关键的分子特征包括ZFTA融合以及MYCN扩增等。
NCCN指南推荐在合适的临床情境下,对室管膜瘤患者检测ZFTA和YAP1融合。幕上室管膜瘤通常出现ZFTA激活融合,激活NF-kappa-B信号通路,其在病理分型中具有重要意义,ZFTA融合阳性室管膜瘤是CNS肿瘤WHO分类中的独特亚型,侵袭性往往强于其他幕上室管膜瘤,且多见于儿童,仅发生于幕上区域。
部分脊髓室管膜瘤存在MYCN扩增,这类肿瘤侵袭性更高,被归类为SP-EP-MYCN(脊髓室管膜瘤,MYCN扩增型),这个亚型已被纳入新的WHO肿瘤分类。同时TERT、CDKN2A/B、NF2以及染色体层面的异常均作为辅助诊断的检测指标,纳入WHO分类指南推荐。
明确分子变异后,医生可针对高侵袭性分子特征的肿瘤制定更积极的手术、放化疗方案,或探索新型靶向治疗方向,同时为判断治疗耐药及调整方案提供依据。值得注意的是,根据WHO中枢神经系统肿瘤分类相关研究,全基因组DNA甲基化分层聚类分析被视为几乎所有肿瘤类型的理想诊断标准,正逐步成为神经病理学中极其有用的诊断工具,尤其适用于室管膜瘤等疑难中枢神经系统肿瘤的诊断。






绘真:
4.垂体瘤患者,做基因检测主要有哪些指导意义?
宁忠华教授:
有垂体瘤患者经常会提问,做基因检测有何指导意义?接下来我给大家介绍一下什么是垂体瘤。垂体瘤(Pituitary Adenomas,PAs)是起源于垂体前叶的常见肿瘤。多数垂体瘤为良性,通过手术或药物治疗易于控制且预后良好;但少部分属于侵袭性垂体瘤,表现为对标准治疗耐药、局部多次复发甚至转移,这类患者亟须及时的针对性治疗。
当前,晚期侵袭性垂体腺瘤的治疗仍面临挑战。替莫唑胺是难治性垂体腺瘤和垂体腺癌的一线治疗药物,多数侵袭性垂体瘤患者对烷基化剂替莫唑胺(TMZ)治疗反应良好。
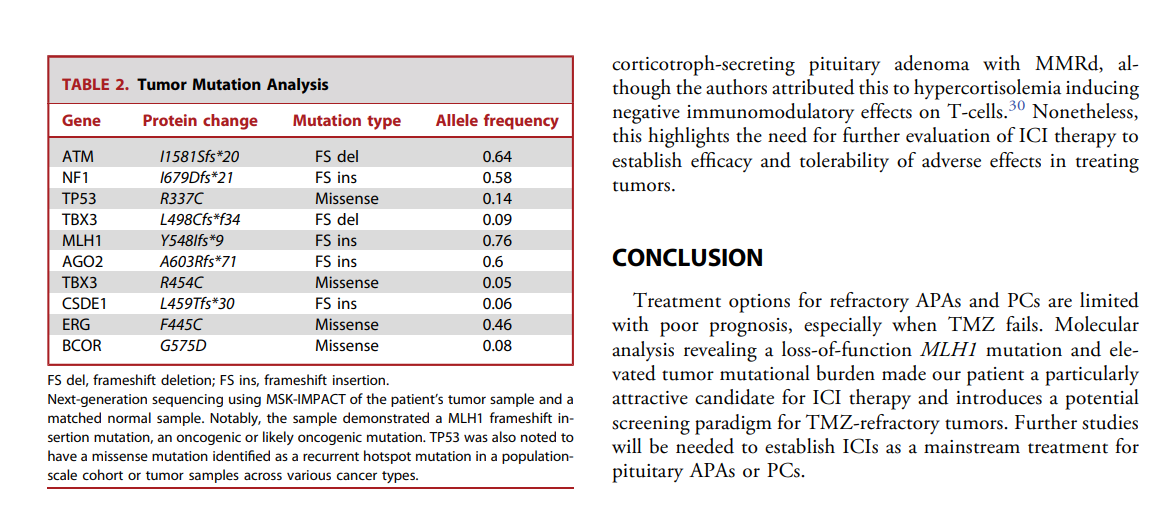
此外,RAF/MEK/ERK、PI3K/Akt/mTOR及EGFR等通路在垂体腺瘤中呈上调状态,与肿瘤发生及治疗密切相关。国外已有难治性垂体瘤患者通过免疫检查点抑制剂获益的案例,该患者携带MMR基因突变、蛋白表达缺失且呈现高肿瘤突变负荷(TMB-H)。
目前《中国难治性垂体腺瘤诊治专家共识》指出,分子层面与MEN1和AIP基因突变相关的垂体腺瘤可能更具难治性,提示较差的预后,对这类垂体腺瘤需积极的应对。因此,以靶向治疗和预后评估为目的的基因检测,在难治性垂体腺瘤患者的临床管理中是至关重要的。
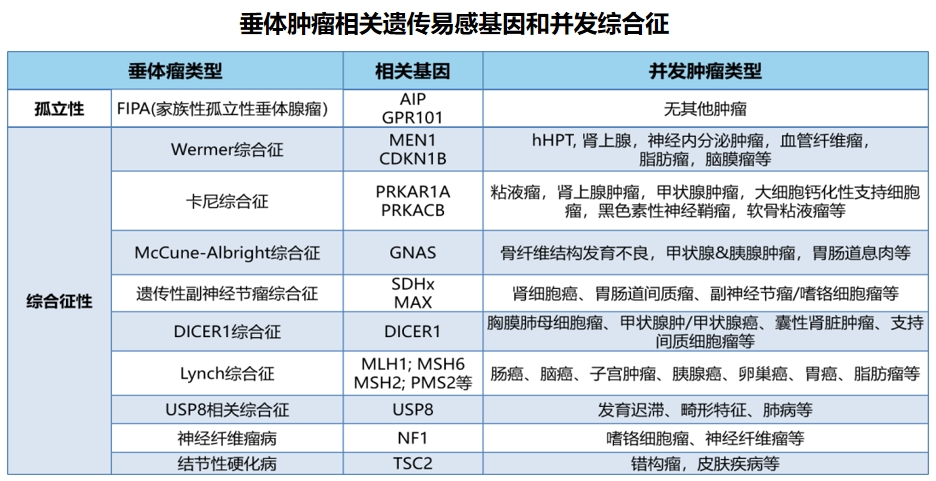
此外,基因检测在遗传性评估中的价值也被指南重点强调,对于年轻患者或有明确垂体瘤及内分泌肿瘤家族史者,建议进行胚系遗传基因检测,以寻找相关遗传学改变证据,已文献报道的基因包括:MEN1、AIP、GPR101、CDKN1B、PRKAR1A、GNAS、NF1等等。







绘真:
5.脑膜瘤患者,做基因检测主要有哪些指导意义?
宁忠华教授:
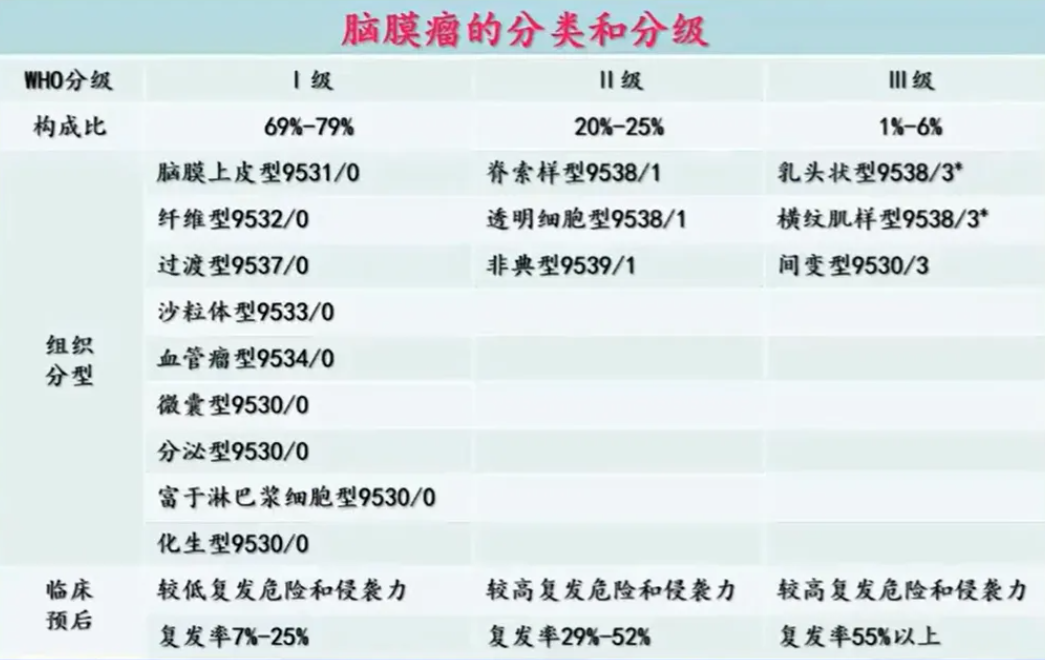
脑膜瘤作为颅内常见肿瘤,具有病理学类型多样、临床表现复杂的特点。2021年WHO中枢神经肿瘤分类将其分为WHO1-3级,级别越高恶性程度越高,预后也越差。
《脑膜瘤分子诊疗专家共识》也指出,脑膜瘤从基因到蛋白质的分子病理学特征,与其病理学分级及临床预后密切相关。因此,将分子分型应用于患者的诊断、治疗、病情监测及后续方案决策,具有重要意义。
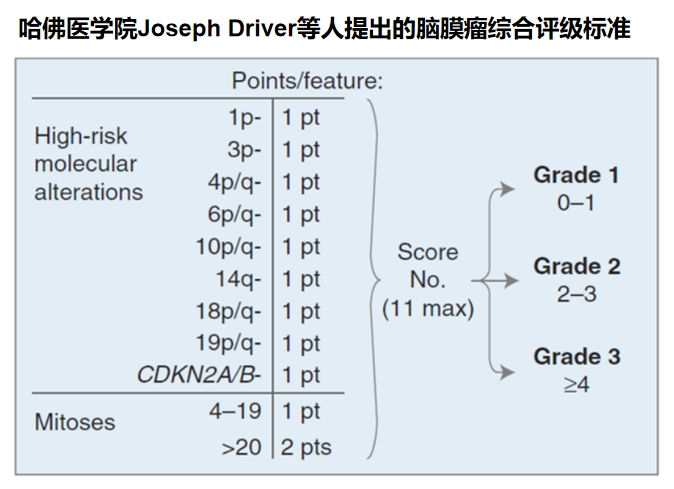
在分级分类指导方面,2021年WHO更新的诊断标准首次将基因特征纳入脑膜瘤评估体系。例如,NF2、AKT、SMO、TERT、CDKN2A/B等基因突变及染色体异常,可为肿瘤精细化分类分级提供依据。其中,若检出TERT启动子突变或CDKN2A和(或)CDKN2B纯合性缺失,可直接判定为3级脑膜瘤。哈佛大学医学院研发的新评估模型,通过整合基因指标、染色体异常及核分裂象等多种因素,相比传统方法能更精准地预测肿瘤复发风险。
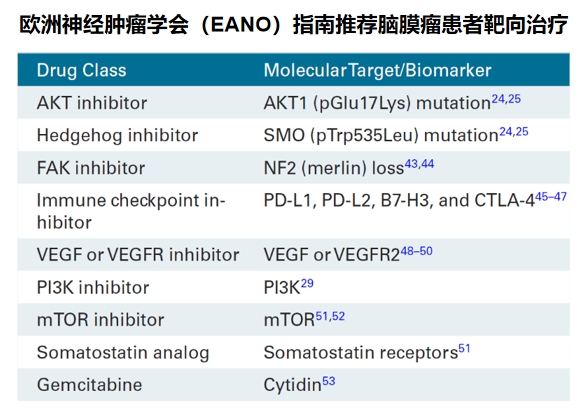
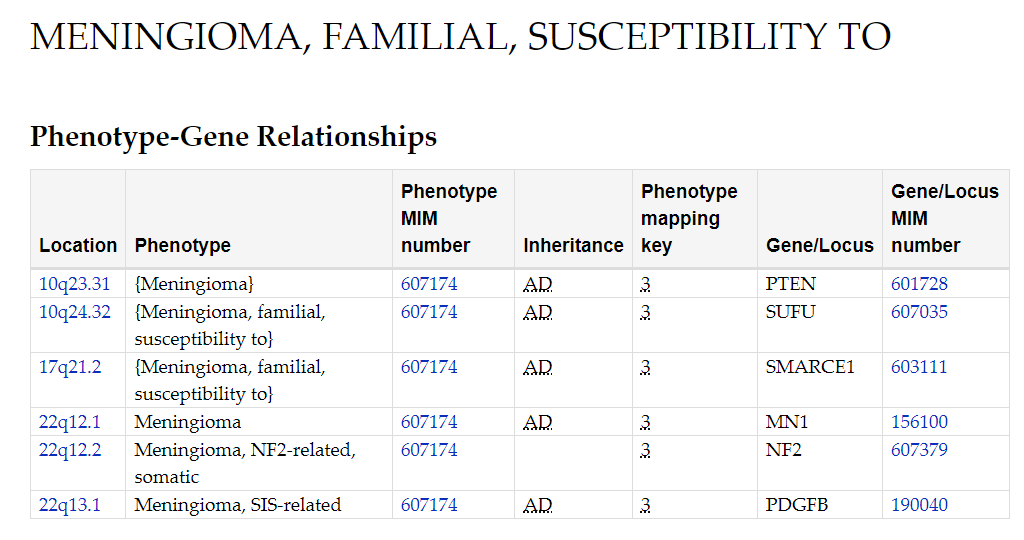
临床实践中,脑膜瘤共识明确建议通过基因检测辅助判定肿瘤类型,以降低误诊、漏诊风险。在治疗层面,参考《欧洲神经肿瘤学会脑膜瘤诊治指南》,若检出AKT1、SMO、NF2、PIK3CA等基因突变,患者可能获得靶向治疗机会;据报道,脑膜瘤免疫检查点抑制剂的临床试验也正在进行,部分免疫药物展现出良好疗效。此外,NF2、PTEN、SUFU等与脑膜瘤遗传相关的基因,也需引起临床关注。
当前,分子检测正推动脑膜瘤诊疗从传统病理分型向“分子-病理”整合诊断迈进,为实现精准化治疗提供关键支撑。








本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#中枢神经系统肿瘤# #基因检测#
4 举报