孤立性纤维性肿瘤(SFT)
SFT好发于胸膜、肺、脑膜、腹膜及纵隔,患者可能无症状或表现为咳嗽、胸痛、呼吸困难或咯血,很少伴有难治性低血糖和肥厚性骨关节病的副肿瘤综合征。
大体观察,胸膜SFT通常表现为包裹、局限、实性的肿块,部分病例伴有囊性变、出血或坏死;可有蒂或无蒂,在一些病例中可见宽基底,肿瘤直径1-30cm不等。
显微镜下,可见交替的细胞密集区域和细胞稀疏区域,细胞间存在不同密度的胶原间质,偶尔有鹿角状的分支血管。肿瘤细胞排列成束状及片状结构,细胞形态呈纺锤形到卵形,边界不清楚,细胞核呈梭形到多边形。在一些肿瘤中可见黏液样间质、脂肪区和上皮样细胞形态区域。虽然大多数肿瘤细胞形态温和,具有微小的异型性和低核分裂活性,但在一些病例中可表现出明显的细胞异型性,核分裂活性增加和坏死。虽然大多数肿瘤是惰性的,局部复发、转移少见,但一些患者仍然因为肿瘤的复发、转移而死亡。2017年,美国学者Demicco根据年龄、肿瘤直径、核分裂计数及坏死比例评分,将SFT分为低级别、中级别及高级别三个等级,三个等级的SFT患者预后具有显著差异。
免疫组化染色方面,绝大多数SFT表达CD34、BCL-2和CD99,然而,上述抗体的特异性都不是很高 。此外,SFT还可以在细胞核表达B-catenin,这导致SFT易误诊为硬纤维瘤病、肉瘤样间皮瘤或转移癌。对于SFT,细胞核表达STSA6具有较高的敏感性及特异性。由于STAT6位于12q染色体上,距离MDM2基因及GLI1基因距离较近。所以,在去分化脂肪肉瘤中,可见STAT6的细胞核表达。
在分子遗传学上,SFT可见12q染色体倒置,从而导致NAB2::STAT6基因融合。此外,TERT启动子突变与SFT的侵袭性临床病理特征相关。一小部分SFT发生去分化,转变为高级别肉瘤,很少包含异源骨肉瘤或横纹肌肉瘤成分。去分化成分可见p16和p53的过表达,Rb的缺失,以及CD34和STAT6的缺失,在部分病例中甚至可见NAB2::STAT6基因融合的缺失,然而,NAB2::STAT6嵌合DNA/ RNA融合转录本在病变组织中保留,可以通过二代测序鉴定。
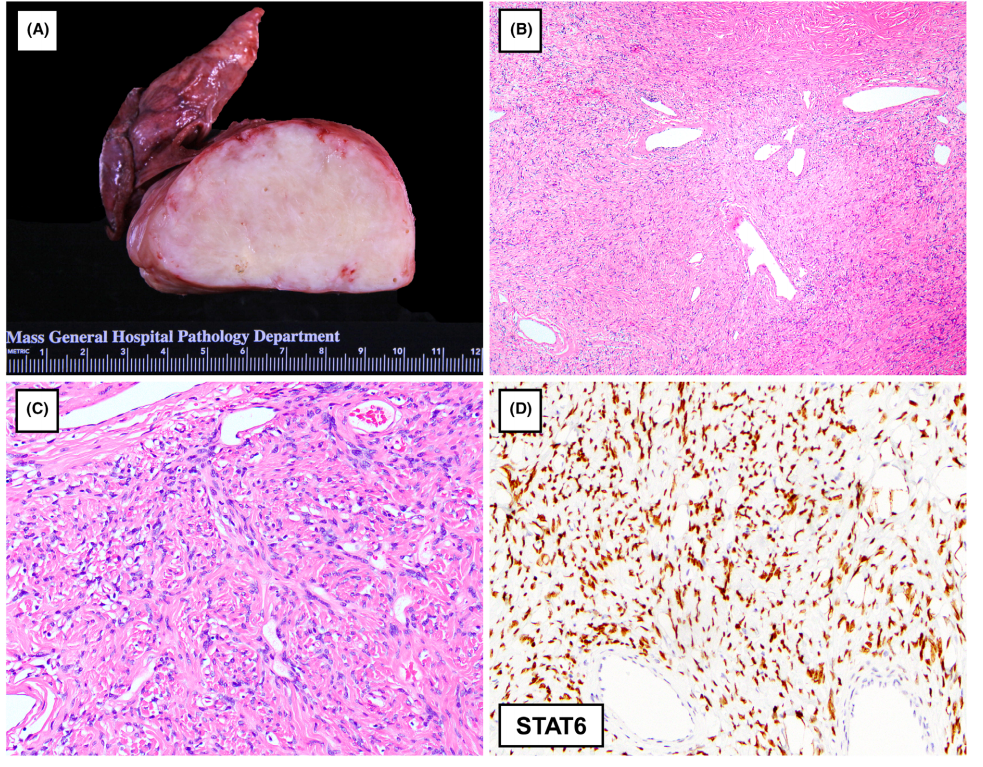
图1. 孤立性纤维性肿瘤(SFT)。(A)大体上,该胸膜肿瘤附着于邻近肺组织,切面灰白实性。(B)在低倍镜下,肿瘤显示胶原间质,并伴有巨大的鹿角血管形成。(C)在高倍镜下,肿瘤细胞形态温和,呈纺锤形或卵圆形。(D)弥漫的STAT6细胞核染色,是孤立性纤维性肿瘤的特征。
钙化纤维性肿瘤(CFT)
CFT是一种罕见的良性纤维母细胞肿瘤,通常累及胸膜,较少累及腹膜、肺、心包/纵隔、大网膜及肠系膜,女性略多见。胸膜病变可能是单发或多发性播散性,类似于间皮瘤或转移性疾病,但局部复发罕见,无转移报道。
大体观察,CFT切面灰白实性分叶状,无明显包膜,肿瘤直径为1-20cm。
显微镜下,瘤组织胶原间质密集,其间散在少许成纤维细胞样梭形细胞。局灶可见砂砾体样物质或营养不良性钙化,伴灶状淋巴细胞、浆细胞浸润,没有明显的细胞异型性、核分裂或坏死。
免疫组化染色,梭形细胞表达CD34,不表达STAT6、B-catenin、S-100、CK和ALK。CFT的发病机制目前尚不清楚。虽然一些研究认为它是炎症性肌纤维母细胞肿瘤或IgG4相关疾病的硬化阶段,近期的一项研究发现CFT中可见ZN717、FRG1和CDC27的突变和多个染色体拷贝数丢失,表明CFT在基因上与炎症性肌纤维母细胞肿瘤不同。
硬纤维瘤(DT)
DT是一种浸润性成纤维母细胞/肌纤维母细胞肿瘤,发病年龄广泛,好发于创伤/手术后的患者中。DT最常累及腹/胸壁和软组织,很少涉及胸膜,累及胸膜者具有局部侵袭性,无转移潜能。
大体观察,DT瘤组织边界不清,切面灰白实性粗糙。
显微镜下,瘤组织胶原间质丰富,排列呈漩涡状或席纹状;瘤细胞形态温和,排列呈束状,细胞核拉长,核仁不明显。
免疫组化染色,瘤细胞表达SMA,偶尔表达Desmin,但不表达CD34、S-100、ALK和CK,70%-80%的病例中可见B-catenin的细胞核表达。然而,在DT中,B-catenin的细胞核表达也并非特异性的,也可见于孤立性纤维性肿瘤、滑膜肉瘤、肉瘤和肉瘤样间皮瘤。
分子遗传学上,DT可见体细胞CTNNB1突变(通常是第3外显子的T41A、S45F或S45P),CTNNB1突变导致B-catenin蛋白的异常积累,并激活WNT通路。CTNNB1的分子检测可用于缺乏B-catenin表达的病例。目前,在DT的诊断中,B-catenin的免疫组化检测或CTNNB1的分子检测,只是理想标准,而不是基本标本,最终诊断要结合临床、形态、免疫组化及分子检测。
滑膜肉瘤(SS)
SS是一种侵袭性肉瘤,其特征是SS18与SSX家族成员之一的融合。虽然累及四肢软组织最常见,但原发胸膜-肺的SS已有报道。
大体观察,滑膜肉瘤呈大而多结节状,切面呈棕灰色,有囊性变性、坏死和钙化。
显微镜下,滑膜肉瘤分为单相、双相或低分化型。单相滑膜肉瘤是最常见的亚型,瘤细胞为蓝染的梭形细胞,细胞核深染,背景是纤细的胶原蛋白,偶尔可见肥大细胞和小的鹿角血管。双相型滑膜肉瘤同时包含上皮细胞和梭形细胞成分。值得注意的是,单相滑膜肉瘤累及肺部,侵犯呼吸道上皮,形成类似双相滑膜肉瘤的外观。低分化滑膜肉瘤表现出细胞增多,甚至圆形细胞形态,类似于其他小圆细胞肿瘤。
免疫组织化学染色,滑膜肉瘤均可表达上皮标志物,例如CK、BCL2及CD99,而CD34、SMA、Desmin、SOX10均为阴性。TLE1对滑膜肉瘤很敏感,但特异性不是很高。胸膜滑膜肉瘤的鉴别诊断包括梭形细胞癌、胸腺瘤、肉瘤样/双相间皮瘤、孤立性纤维性肿瘤等。胸膜滑膜肉瘤和间皮瘤的部分免疫组化表达具有重叠性,例如,滑膜肉瘤和间皮瘤中均表达Calretinin。SS18-SSX融合特异性免疫组化对滑膜肉瘤具有显著的敏感性和特异性。
分子遗传学上,大多数滑膜肉瘤存在t(X;18)(p11;q11),SS18与SSSX1,SSX2融合,很少有SSX4融合。不常见的融合包括SS18L1::SSX1、EWSR1::SSX1、MN1::SSX1和SS18::NEDD4。对于所有部位的局限性滑膜肉瘤,组织学亚型(双相对单相)和SS18::SSX融合型(SSX1、SSX2),均不能预测生存率。
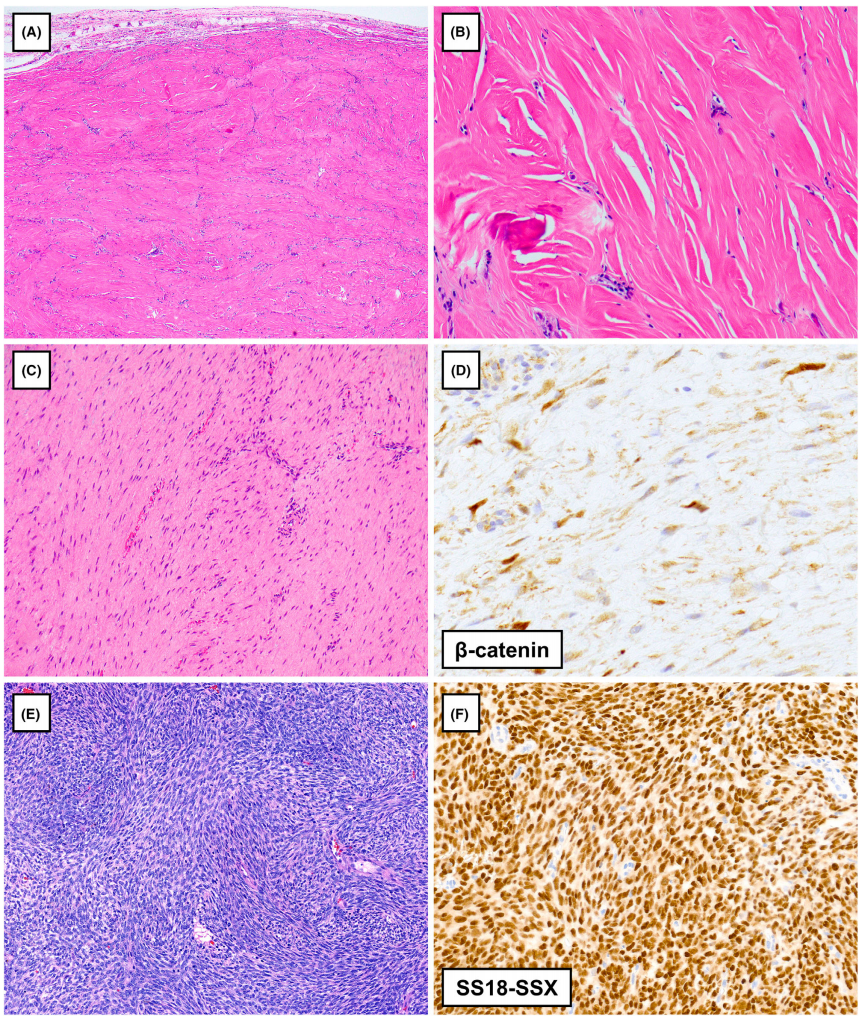
图2. 胸膜的其它梭形细胞肿瘤。(A)钙化纤维性肿瘤表现为孤立的少细胞胸膜结节。(B)在高倍镜下,钙化纤维性肿瘤在致密的胶原背景下,显示稀疏的纤维母细胞梭状细胞,并伴有局灶性钙化。(C)胸膜硬纤维瘤病可见温和的梭形细胞呈束状排列。(D)硬纤维瘤病瘤细胞细胞核局灶表达B-catenin。(E)胸膜-肺单相型滑膜肉瘤,可见均匀的梭状细胞,呈束状排列。(F)SS18-SSX融合特异性抗体的免疫组化染色阳性。
神经鞘瘤
神经鞘瘤是一种良性肿瘤,源于Schwann细胞。胸腔内神经鞘瘤通常发生在后纵隔,很少发生在胸膜或肺。胸膜肺神经鞘瘤临床表现为偶发肿块、胸痛、呼吸困难或咳嗽。
大体观察,肿瘤外观呈球状,表面光滑,切面呈棕褐色至黄色,有时可见出血或变性。在某些病例中,可以看到附着的周围神经。
显微镜下,淋巴细胞在周围组织浸润明显。传统的神经鞘瘤可见致密的高细胞(Antoni A)和低细胞(Antoni B)区域的交替排列,具有透明的厚壁血管。高倍镜下,瘤细胞核呈纺锤状,可见Verocay体。少数肿瘤可见瘤细胞增生活跃、核分裂增加或退行性及异型性改变,上述改变,易误诊为恶性肿瘤。
免疫组化,瘤细胞表达S-100和SOX10,纵隔/腹膜后神经鞘瘤中,可见AE1/AE3表达。
在分子遗传学上,肿瘤组织可见NF2失活突变,也可见Hippo通路的激活。
恶性外周神经鞘肿瘤(MPNST)
MPNST的诊断需要至少满足以下情况之一:
(1)存在肉瘤或良性周围神经源性肿瘤病史(通常是神经纤维瘤,很少是神经鞘瘤);
(2)I型神经纤维瘤引起的肉瘤;
(3)免疫组化证据支持Schwannian来源的肉瘤。
与神经鞘瘤一样,胸腔内MPNST通常起源于后纵隔,很少起源于胸膜或肺。
大体观察,肿瘤切面呈漩涡状、鱼肉样改变,可见出血和坏死。
显微镜下,瘤组织高细胞区和低细胞区交替,瘤细胞呈梭形,呈束状排列于胶原-黏液样间质中,细胞核呈波浪状改变。瘤组织可见多形性、地图样坏死及核分裂增加。部分肿瘤包含异源性横纹肌肉瘤、软骨肉瘤、骨肉瘤、血管肉瘤或腺样、鳞样分化成分。这种情况下,需要与转移性黑色素瘤、神经鞘瘤、滑膜肉瘤和肉瘤样间皮瘤相鉴别。
免疫组化染色,S-100和SOX10在MPNST中呈斑片状表达。在部分病例中,S-100和SOX10表达缺失。在MPNST中,H3K27me3表达完全缺失,在肉瘤样癌、子宫内膜间质肉瘤和胸壁去分化软骨肉瘤中,H3K27me3可有不同程度的缺失。然而,H3K27me3的完全缺失,强烈提示MPNST的可能性。
分子遗传学上,MPNST涉及体细胞或胚系的NF1、CDKN2A或PRC2的突变。
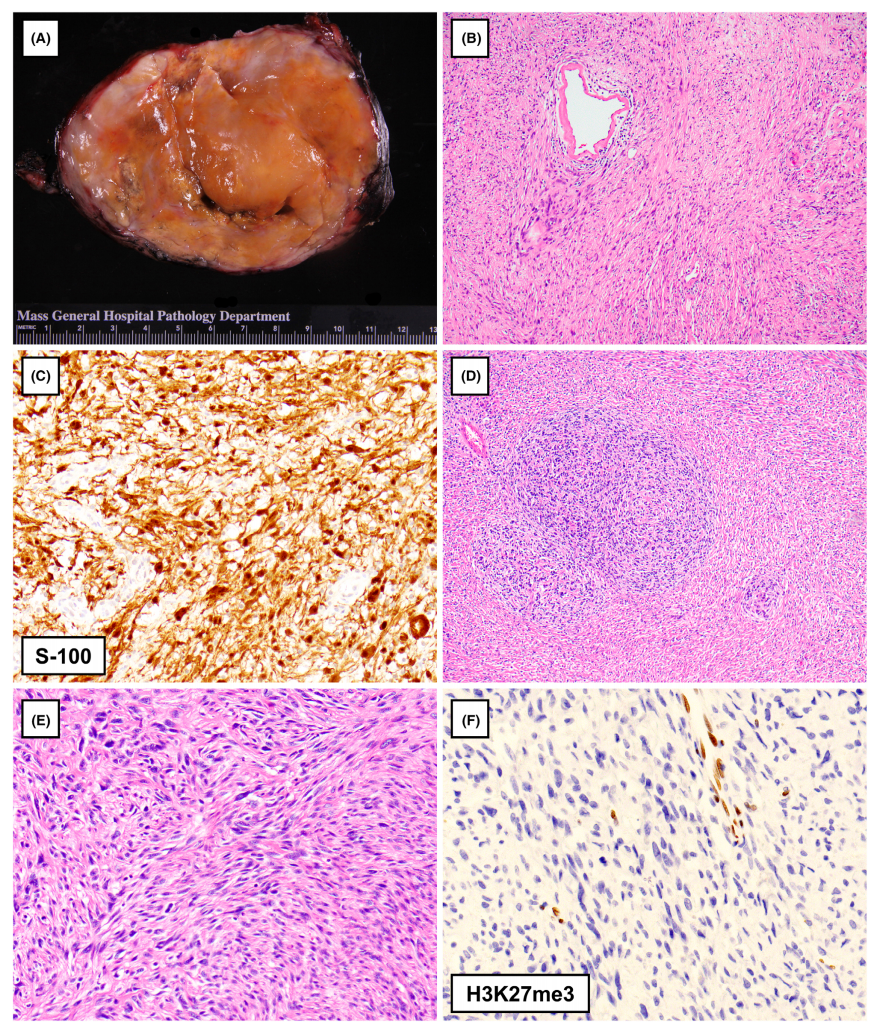
图3. 神经鞘肿瘤。(A),胸膜神经鞘瘤呈球形,切面黄色,可见囊性变。(B)显微镜下,神经鞘瘤可见致密的高细胞(Antoni A)和低细胞(Antoni B)区域的交替排列。(C)神经鞘瘤可见弥漫性S-100表达。(D)MPNST可严重累及胸膜和胸壁;组织学上,它表现为高细胞和低细胞交替区域,呈羽毛状、漩涡状排列。(C)在高倍镜下,异型性的梭形细胞呈束状排列。(F)大约一半的MPNST显示H3K27me3表达完全缺失。
与传统类型的MPNST不同,上皮样MPNST可见H3K27me3表达,涉及SMARCB1突变及INI1的缺失。
炎性肌成纤维母细胞瘤(IMT)
IMT是一种纤维母细胞/肌纤维母细胞肿瘤。IMT可以局部复发,但远处转移罕见。
大体观察,IMT呈现质硬肿块,切面可见出血、变性及钙化。
显微镜下,肿瘤间质呈黏液及胶原样改变,常伴有淋巴细胞、浆细胞浸润。瘤细胞呈梭形,胞浆嗜酸,可见泡状核。细胞密度增加、核多形性、核分裂及坏死较为少见。
免疫组化染色,瘤细胞常表达SMA,偶尔表达Desmin,20%-40%的病例可表达CK,这易与肉瘤样间皮瘤或癌相混淆。由于炎症背景中可见大量的IgG4阳性的浆细胞,易误诊为IgG4相关的疾病。富于IgG4阳性浆细胞的IMT,ALK、ROS1、pan-TRK免疫组化染色阴性。
分子遗传学上,IMT涉及酪氨酸激酶的多种基因重排,大约一半的病例中有ALK重排,其余的病例中有涉及ROS1、NTRK3、RET或其他基因的融合。具有ALK重排的IMT,ALK的免疫组化弥漫阳性。同样,那些有ROS1或NTRK3融合的患者,分别可见ROS1或pan-TRK免疫组化弥漫阳性。
滤泡性树突状细胞肉瘤(FDCS)
FDCS较为少见,具有滤泡树突状细胞的组织学和免疫表型特征。FDCS多为结外发生,常累及腹膜后、胃肠道或纵隔。
大体观,FDCS切面质地较硬,与周围组织界限不清。
显微镜下,瘤细胞排列呈合胞片状、轮状、结节状,瘤细胞外观呈梭形、卵形、上皮样至多形性,胞浆嗜酸性,核长到卵圆形,染色质分散,核仁小,核膜光滑。少许淋巴细胞均匀地分布在间质中,可作为疾病的诊断线索之一。一部分瘤细胞显示多核形态,可见血管性囊性变性或突出的黏液样间质。
免疫组化,瘤细胞通常表达多种滤泡树突状细胞标记物,如CD21、CD23、CD35、clusterin、D2-40、CXCL13、 SSTR2、FDCSP和SRGN。瘤细胞也可以表达S-100、CD68、EMA和claudin-4。背景的淋巴细胞通常为不成熟的T淋巴细胞。在40%-50%的病例中,可见TDT阳性的T细胞数量增加。
分子遗传学上,大多数FDCS具有复杂的基因突变,涉及NF-kB通路(如BIRC3、NFKBIA、TRAF3、SOCS3和TNFAIP3)和CDKN2A及TP53突变,在部分肿瘤中,可见克隆免疫球蛋白受体基因重排、 BRAF V600E突变和PD-L1、PD-L2的上调。
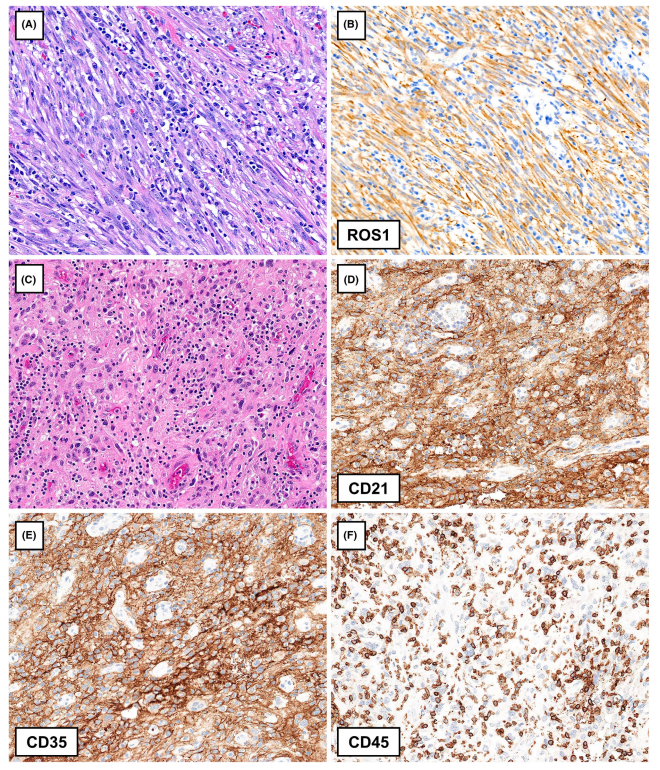
图4. 有明显炎症背景的间叶源性肿瘤。(A)胸膜-肺IMT显示水肿背景下梭形细胞束松散,并伴有明显的淋巴细胞、浆细胞浸润。(B)免疫组化染色,该肿瘤ROS1阳性,提示ROS1重排。(C)胸膜-肺FDCS显示梭形-上皮样肿瘤细胞,胞浆嗜酸性,细胞边界不清楚。免疫组化结果显示,肿瘤细胞表达 CD21(D)和CD35(E)。(F)CD45染色突出显示了在肿瘤细胞中均匀分布的背景淋巴细胞。
上皮样血管内皮瘤(EHE)
EHE是一种罕见的恶性血管肿瘤,以WWTR1::CAMTA1基因融合为特征,很少发生YAP1::TFE3或其他融合。临床表现类似于间皮瘤或转移癌。
大体观,肿瘤经常包围并沿裂隙和小叶间隔延伸到肺实质。
显微镜下,胸膜肺肿瘤在低倍镜下常表现为淋巴管样和肺泡样外观。高倍镜下,在黏液样透明的间质中,肿瘤细胞呈索状、小梁、巢状排列,细胞形态从上皮样到局灶状纺锤形,细胞质嗜酸不透明,细胞核不明显。胞浆内可见液泡。大多数肿瘤(除了伴有YAP1::TFE3融合的肿瘤)并没有显示出真正的血管结构和形成良好的血管通道,大多数肿瘤可见较小的异型性和较少的核分裂,但有一小部分肿瘤可见明显的多形性、坏死和较多的核分裂,这些特点与不良预后相关。
免疫组化染色,EHE表达内皮标记物,如ERG、CD31、CD34和FLI1,在一部分EHE肿瘤细胞可表达CK,这易误诊为转移癌或间皮瘤。瘤细胞核表达CAMTA,强烈提示CAMTA1重排,是EHE具有较高敏感性和特异性的标志物。TFE3阳性可见于伴有YAP1::TFE3基因融合的EHE中,TFE3既不敏感,也不具有特异性,也可见于CAMTA1::WWTR1融合的肿瘤中。YAP1 -C端表达缺失,提示YAP1::TFE3融合的EHE。
分子遗传学上,大多数EHE存在t(1;3)(p36;q25)染色体易位,导致WWTR1::CAMTA1融合。伴有YAP1::TFE3融合的EHE好发于年轻人,呈巢状生长,可见良好的血管形成。EHE较为少见的基因融合亚型,例如WWTR1::MAML2和WWTR1::ACTL6A,常累及心脏。
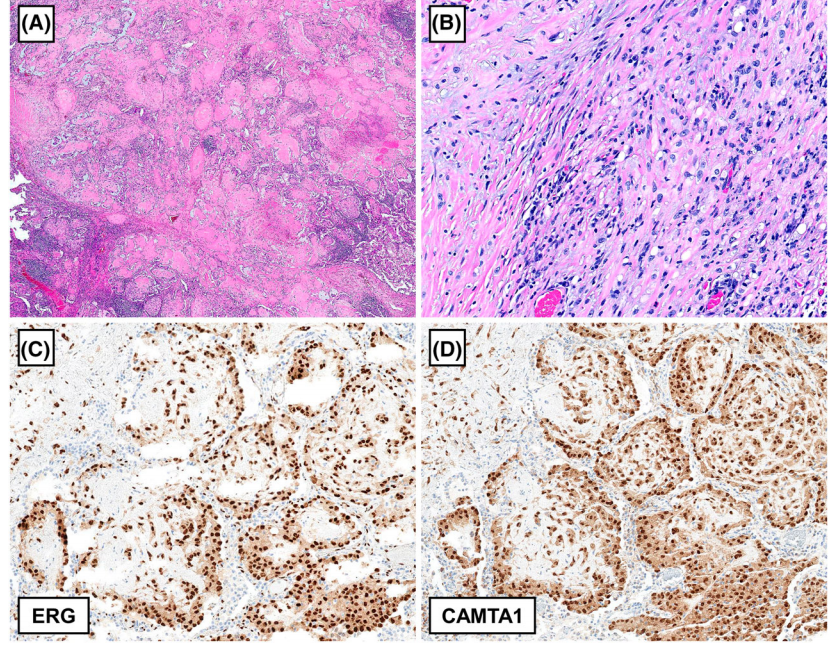
图5. EHE。(A)在低倍镜下,肿瘤显示透明间质,并侵犯肺实质,可见明显的肺泡样生长模式。(B)在高倍镜下,上皮样肿瘤细胞呈索状、小梁状排列,胞浆呈玻璃状嗜酸性和分散的胞浆内空泡。肿瘤细胞表达ERG(C)和CAMTA1(D)。
促纤维增生的小圆细胞肿瘤(DSRCT)
DSRCT是一种具有EWSR1::WT1融合和多表型分化的恶性肿瘤。DSRCT具有高度侵袭性,预后较差。
大体观,肿瘤边界不清,呈多结节状,伴有坏死和出血。
显微镜下,瘤细胞嵌在胶原-结缔组织间质中,呈索状、巢状、片状排列,细胞核呈圆形-卵圆形,胞浆少,核仁不明显。在少数病例中,瘤细胞可呈现横纹肌样或上皮样形态。瘤细胞多形性不常见,坏死及核分裂常见。
免疫组化染色,瘤细胞可不同程度表达CK、EMA、Desmin(点灶状表达),不表达myogenin和myoD1。免疫组化表达的不典型,使DSRCT的诊断具有挑战性,鉴别诊断包括尤文氏肉瘤、滑膜肉瘤和神经内分泌癌。
分子遗传学上,DSRCT存在t(11、22)(p13;q12)染色体易位,导致EWSR1::WT1融合。WT1-C端的核表达,是DSRCT诊断的有力证据。DSRCT可高表达雄激素受体(AR),目前,AR成为DSRCT潜在的治疗靶点。
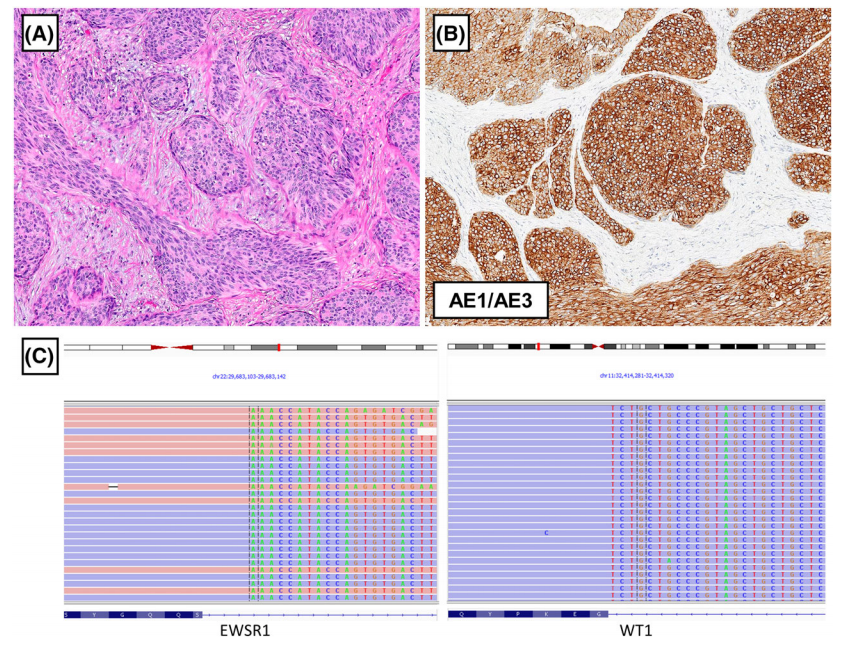
图6. DSRCT。(A)胸膜DSRCT可见卵圆形到纺锤状的肿瘤细胞巢,可见胶原到局灶状纤维增生的背景。(B)瘤细胞弥漫表达AE1/AE3。(C)NGS检测显示,DSRCT存在EWSR1:: WT1融合,EWSR1第8外显子与WT1第8外显子融合。
参考文献及书籍:
Rerkpichaisuth V, Hung YP. Mesenchymal tumours of the pleura: review and update. Histopathology. 2024 Jan;84(1):163-182. doi: 10.1111/his.15035. Epub 2023 Sep 10. PMID: 37691389.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#孤立性纤维性肿瘤#
3 举报