湖南省人民医院成伟/湖南师大刘红文Angew:高激活效率串联锁定型NIR-II荧光探针,实现泛癌长时间高信背比成像与精准手术切除
2025-07-18 BioMed科技 BioMed科技 发表于上海
新型 NIR-II 探针 ACy-H-NTR 通过级联激活和双重淬灭机制,实现泛癌快速高对比度成像,助力微小肿瘤精准切除,临床潜力显著。
背景介绍
恶性肿瘤的精准切除是提高患者生存率的关键,但现有临床影像技术(如MRI、CT)在术中实时导航和微肿瘤识别中存在局限。荧光成像技术虽具备高灵敏度优势,但传统探针面临两大困境:一是"始终开启"式探针(如临床常用ICG)需48小时代谢才能显影;二是现有"双锁"探针激活效率低、响应慢,且难以适配不同癌种的异质性。如何实现泛癌种快速、高对比度成像,成为提升肿瘤手术精度的核心挑战。

近日,湖南省人民医院(湖南师范大学附属第一医院)成伟教授课题组与湖南师范大学刘红文副教授课题组合作,开发一种级联激活-双重淬灭型NIR-II探针 ACy-H-NTR。双锁机制:缺氧响应型NTR触发与酸响应型哌嗪(H⁺识别)串联激活,仅于肿瘤微环境生效,显著降低假阳性;性能突破:NIR-II发射与"激活-滞留"机制协同作用,实现T/N比7.8(较ICG提升4.9倍),维持>48小时肿瘤特异性成像,支持<2 mm微小肿瘤精准切除;临床验证:人源癌组织样本中清晰划定肿瘤边界,证实临床手术导航潜力。通过整合串联锁定和双重淬灭的设计,同时优化了激活效率、NIR-II 区成像能力以及“激活-滞留”机制,该探针克服了当前的局限性,能够实现精确的泛癌识别和手术导航。相关研究成果以“Precision Screening and Surgical Rep of Pan-Cancer Using a Tandem-Locked NIR-II Fluorescent Probe with Optimized Activation Efficiency”为题,发表于国际化学权威期刊《Angewandte Chemie International Edition》(DOI: 10.1002/anie.202509372)。
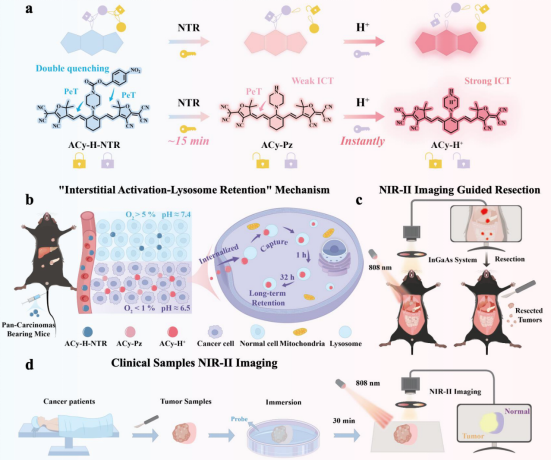
图1 串联锁定和双淬灭探针ACy-H-NTR的设计及其在泛癌小鼠模型中通过NIR-II成像指导肿瘤切除示意图
主要研究内容
为提高体内成像的T/N比,研究证实ACy-H-NTR在1100 nm长通滤波下具有良好的NIR-II成像潜力。为验证其“串联锁定&双淬灭”策略,在模拟肿瘤微环境(低氧含NTR/弱酸性)下测试:在中性条件(pH 7.5, 含NADPH)下,随NTR浓度增加,探针最大吸收波长蓝移70 nm(800 nm → 730 nm),同时910 nm荧光增强6.4倍;转至酸性环境后,相比中性条件,最大吸收峰红移回800 nm(730 nm → 800 nm),且910 nm荧光信号进一步增强2.3倍。总体在酸性条件下展现出比单一中性条件更显著的吸收变化和更强的荧光增强。该结果有力支持探针的串联激活机制:先在低氧环境(含NTR)下解锁第一重“锁”释放初始信号,后在酸性条件下质子化解锁第二重“锁”放大荧光输出(图2)。
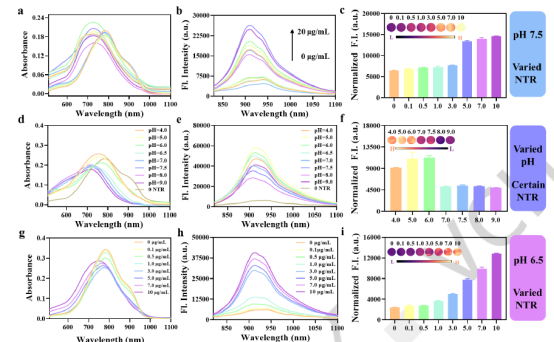
图2 ACy-H-NTR的光谱性质
为阐明“串联锁定&双淬灭”机制,理论计算(Gaussian/Multiwfn)显示:ACy-H-NTR 的 HOMO 位于阴离子菁染料(ACy),LUMO 位于哌嗪单元;硝基苄基酯和哌嗪单元对 ACy 产生显著 PET 效应,实现双重荧光淬灭。其还原产物 ACy-Pz 仍保持类似轨道分布(HOMO/ACy, LUMO/哌嗪),且哌嗪在不同质子化状态下持续通过 PET 抑制荧光。分子对接揭示 ACy-H-NTR 与 NTR 强结合:His-124 形成氢键,并存在多个 C-H/π-H 键作用,对4个结合位点亲和力高(结合能:-9.279 至 -7.638 kcal/mol)。化学动力学实验表明,在NADPH 存在下,ACy-H-NTR 与 5 μg/mL NTR 反应后,910 nm 荧光信号快速增强(15 min 达平台),利于肿瘤微环境快速激活。与ICG 相比,ACy-H-NTR 在 808 nm 激光(25-150 mW/cm²)连续照射 30 min 后光信号更稳定(图3),归因于内消旋取代基增强的稳定性,适合长期成像。
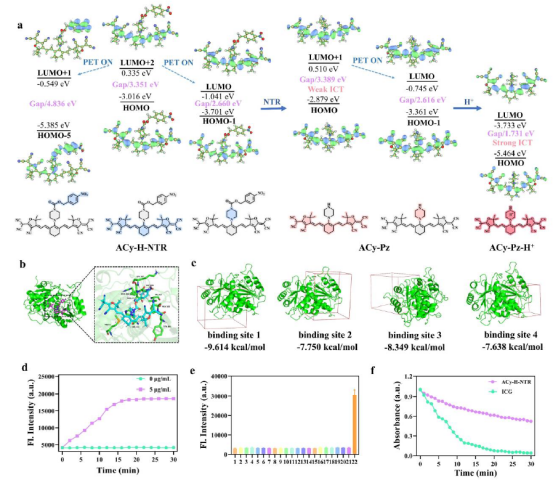
图3 探针双淬灭机理和响应动力学研究
荧光探针的长时成像能力为复杂手术提供了充足时间窗,实现术中实时肿瘤定位与边界可视化,助力精准切除并保护健康组织。在胰腺癌小鼠模型中,相比临床对照ICG(仅微弱积累、快速衰减、T/N=3.4),ACy-H-NTR 在肿瘤微环境激活下,肿瘤部位呈现强NIR-II荧光,信号逐渐增强,注射24小时达峰值(T/N=16.8) 且48小时后仍维持强信号,显著延长手术窗口。这种优异的长滞留与高T/N比(优于多数现有探针)归功于“串联锁定&双淬灭”设计及“激活-滞留”效应机制。凭借出色的靶向性和高对比度,注射24小时后成功实施NIR-II荧光引导的肿瘤切除:探针清晰界定边界,指导精准手术。术后成像确认肿瘤完全移除且无残留荧光,证明其为荧光导航手术提供高效精准工具(图4)。
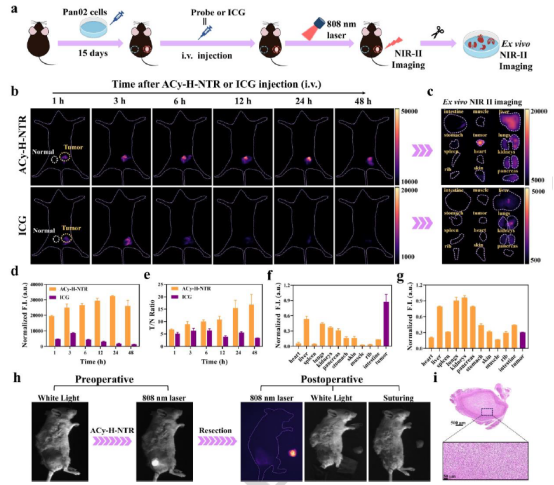
图4 使用吲哚菁绿作为对照对皮下胰腺癌肿瘤模型进行成像
精确检测微小转移灶(<2 mm)对于及时辅助治疗至关重要,可显著提高肿瘤患者的生存率。为此,我们评估了ACy-H-NTR作为识别和切除多发性微转移灶的新策略。注射后1小时,仅体积较大的肿瘤T2显示强荧光(提示肿瘤体积与缺氧程度正相关),而较小的肿瘤T1、T3和T4信号较弱。随时间推移,所有肿瘤荧光逐渐增强,约12小时达到最佳富集和激活效率。此时,微转移灶的T/N比在4.2至7.8之间,有效区分了微小肿瘤与正常组织。最终,在NIR-II成像引导下,成功实现了多个微小肿瘤的精准切除(图5)。
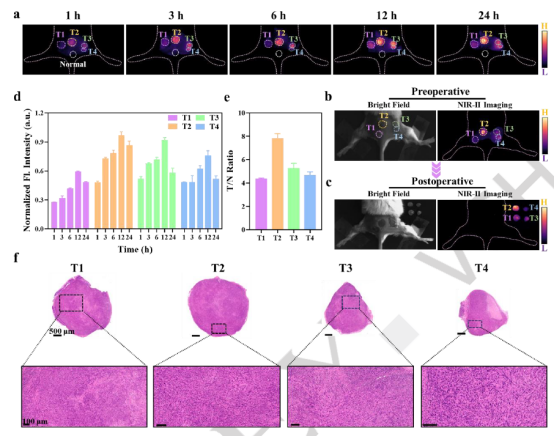
图5 近红外二区成像引导的多微小肿瘤手术切除
为更贴近临床场景,评估了 ACy-H-NTR 在原位及转移肿瘤模型中用于精准成像和NIR-II引导手术的可行性。尾静脉注射后3小时,荧光主要聚集于肝脏,肿瘤无明显信号。12小时后,肝脏信号减弱,原位肿瘤区域发出强荧光,证实探针被肿瘤特异性激活,并成功引导了肿瘤完全切除(术后原发灶无残留荧光)。在肝转移和腹膜转移模型中,注射后2小时荧光同样富集于肝脏。12-24小时间,转移灶(如右下肝区、腹部)出现并维持强荧光信号,凸显其长时成像能力。NIR-II引导下成功实施了肝转移灶扩大切除和腹膜两个肿瘤的精准切除,术后成像均确认荧光完全消除,验证了其识别并引导切除不同部位转移瘤的有效性(图6)。
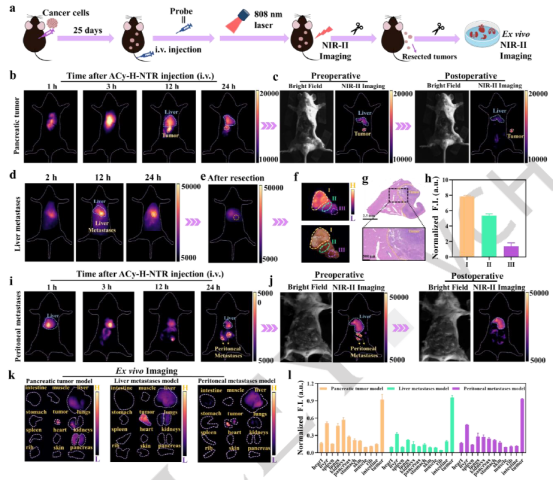
图6 近红外二区成像引导下的胰腺原位以及转移肿瘤的手术切除
为验证 ACy-H-NTR 对临床样本的识别能力,研究使用新鲜人肝细胞癌组织进行体外实验。将样本浸入探针溶液孵育后,肿瘤区域的NIR-II荧光信号随时间逐渐增强,20分钟达到平台,而邻近非肿瘤及正常组织仅显示微弱信号。所有肿瘤区域均呈现显著荧光,T/N比值达4.0-8.0,满足临床精确界定肿瘤边界的需求(图7)。最终的H&E染色组织学验证确认了探针识别的高度准确性,证明其在复杂临床样本中区分恶性区域的高特异性。
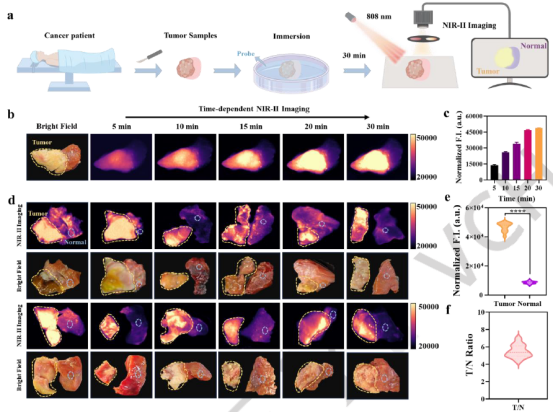
图7 人HCC组织样本的NIR-II成像
综上所述,本研究基于阴离子花菁染料创新性地开发了NIR-II探针ACy-H-NTR,其基于“串联锁定&双淬灭”策略和“激活-滞留”机制,靶向肿瘤微环境(TME)实现高精度泛癌长期成像与精准切除。该探针在天然状态下自身荧光可通过PET与ICT协同作用被有效淬灭,而在TME中经历快速级联激活:先被还原消除对硝基苄基酯“锁”,随后中间体ACy-Pz在酸性下质子化,通过抑制PET和增强ICT,恢复并放大NIR-II信号。其阴离子特性促进了肿瘤基质激活与溶酶体长滞留。相比对照探针(如Cy-Pz和ICG),ACy-H-NTR显著降低非特异性信号,获得优异T/N比,能精准指导微肿瘤切除。在胰腺癌、肝转移及腹膜转移等多种临床前模型中,均证明了其卓越的成像能力和手术导航效果。
这也是成伟教授与刘红文副教授课题组合作的胰腺癌荧光成像和手术导航系列研究第三篇文章(前两篇见后续工作)。
聚焦于攻克胰腺癌高侵袭转移特性下快速可视化与精准切除的难题。本研究开发了新型 FRET介导的双比率NIRF/PA双模态探针SiRho-SHD-NTR。该探针凭借与硝基还原酶(NTR)的高亲和力及快速反应特性,能高效穿透癌细胞。活体应用中,PA成像用于初诊定位,NIRF成像实现快速可视化。其突出优势在于:喷洒探针后仅需约5分钟,即可完成原位胰腺癌小鼠的精准肿瘤成像,并能快速可视化转移灶,指导手术切除。该探针为胰腺癌(包括原发与转移灶)的快速可视化及影像引导手术提供了有力工具。相关成果以 “A Self-Calibrating Fluorescent-Photoacoustic Integrated Probe Enables Fast Visualizing Pancreatic Cancer and Imaging-Guided Tumor Surgery” 为题发表于 《Small》(封面文章)。

针对侵袭性强、治疗进展有限的胰腺导管腺癌,本研究开发了新型近红外荧光(NIRF)成像探针ICG-PTP。该探针通过将活性靶向肽KTLLPTP(特异性识别PDAC细胞表面过表达的Plectin-1)修饰于ICG上,赋予其主动靶向PDAC细胞的能力。在PDAC原位小鼠模型中,ICG-PTP实现了显著改善的肿瘤信号背景比(T/N=4.28),远优于ICG(T/N=2.34)。其成功应用于皮下及原位PDAC的NIRF成像引导手术切除,精准识别肿瘤边缘并提高切除效率。此外,ICG-PTP在PDAC转移瘤检测中也展现潜力。该探针表现出良好的生物安全性,为外科医生提供实时肿瘤信息,并为转移瘤治疗提供新策略,具有广阔的临床应用前景。相关成果以 “Active-Targeted ICG for Surgical Navigation and Fluorescence Guided Laparoscopic Photothermal Ablation in Pancreatic Ductal Adenocarcinoma” 为题发表于《Analytical Chemistry》。

【成伟教授简介】
成伟教授,医学博士,主任医师,FACS,博士和硕士研究生导师,博士后导师,湖南省人民医院副院长;湖南省高层次卫生人才学科带头人,湖南省人民医院“ 131 ”人才。长期耕耘于临床一线,以解决临床问题为出发点,围绕肝胆胰肿瘤的临床和分子荧光影像等领域,依托于湖南省人民医院肝胆外科(目前有8个科室,450张床位),开展医-工交叉研究,在Angewandte Chemie International Edition,Analytical Chemistry,Small,Theranostics,International Journal of Surgery 和Ann Surg等杂志发表论文40余篇。
【刘红文副教授简介】
刘红文副教授,博士生导师。长期从事有机小分子探针的研究,以第一作者或通讯作者发表高水平论文30余篇,被引用近4000余次,包括Angew. Chem. Int. Ed., Chem. Soc. Rev., Chem. Sci., Anal. Chem., Coordin. Chem. Rev.等权威期刊,并获得授权的国家发明专利3项。主持了国家自然科学基金面上项目、国家自然科学基金青年项目、湖南省自然科学基金青年项目B类及2018年度中国博士后“创新人才计划”等项目。
原文链接:
http://10.1002/anie.202509372
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













高激活效率串联锁定型荧光探针
1 举报
#恶性肿瘤# #NIR-II探针#
9 举报