Chinese Medicine:新鱼腥草素钠对侵袭性肺曲霉病的治疗作用与机制解析
2025-07-07 MedSci原创 MedSci原创 发表于上海
新鱼腥草素钠(SNH),一种由传统中药鱼腥草提取物衍生的化合物,因其抗菌抗真菌及免疫调节活性备受关注。
人类每日通过呼吸道吸入大量曲霉(Aspergillus fumigatus)孢子,健康个体可通过黏液纤毛系统及肺泡巨噬细胞等免疫细胞有效清除,而免疫功能受损者则易发生孢子萌发,导致曲霉菌丝侵袭伴高度的发病率与死亡率。侵袭性肺曲霉病(IPA)为曲霉病中侵袭性最强且最致命的形式,因近年来器官移植等免疫抑制治疗的普及发病率显著上升。肺泡巨噬细胞作为先天免疫首要防线,不仅识别并吞噬曲霉孢子,还调控炎症反应及免疫细胞募集。其关键识别受体如TLR2,依赖下游信号转导通路协调抗感染反应。与此同时,microRNA在巨噬细胞功能调控中作用显著。新鱼腥草素钠作为鱼腥草的改良产物,已知具有抗菌、抗肿瘤及免疫调节活性,但其在IPA中的作用及免疫调控机制尚缺乏深入研究。
近年来,新鱼腥草素钠(SNH),一种由传统中药鱼腥草提取物衍生的化合物,因其抗菌抗真菌及免疫调节活性备受关注。然而,其对IPA治疗的免疫机制尚未明晰。近期,我国学者在Chinese Medicine期刊上发表了一项研究,系统阐述了SNH对IPA模型小鼠的治疗效应及其调控巨噬细胞不同激活状态对曲霉感染响应的分子机制,填补了该领域的知识空白。
本研究采用免疫抑制小鼠鼻内滴注A. fumigatus孢子建立IPA模型,评估SNH不同剂量对肺组织真菌负荷及组织病理学的影响;体外以MH-S细胞作为肺泡巨噬细胞模型,检测SNH对细胞活性、形态变化、吞噬及杀菌功能的影响;利用转录组学、microRNA测序及分子对接技术深入剖析SNH调节巨噬细胞免疫功能的信号通路及miRNA调控网络。同时,CRISPR-Cas13d介导TLR2基因敲降及miRNA模拟物/抑制剂的转染实验,验证关键调控因子在SNH抗曲霉活性中的功能。
主要研究结果
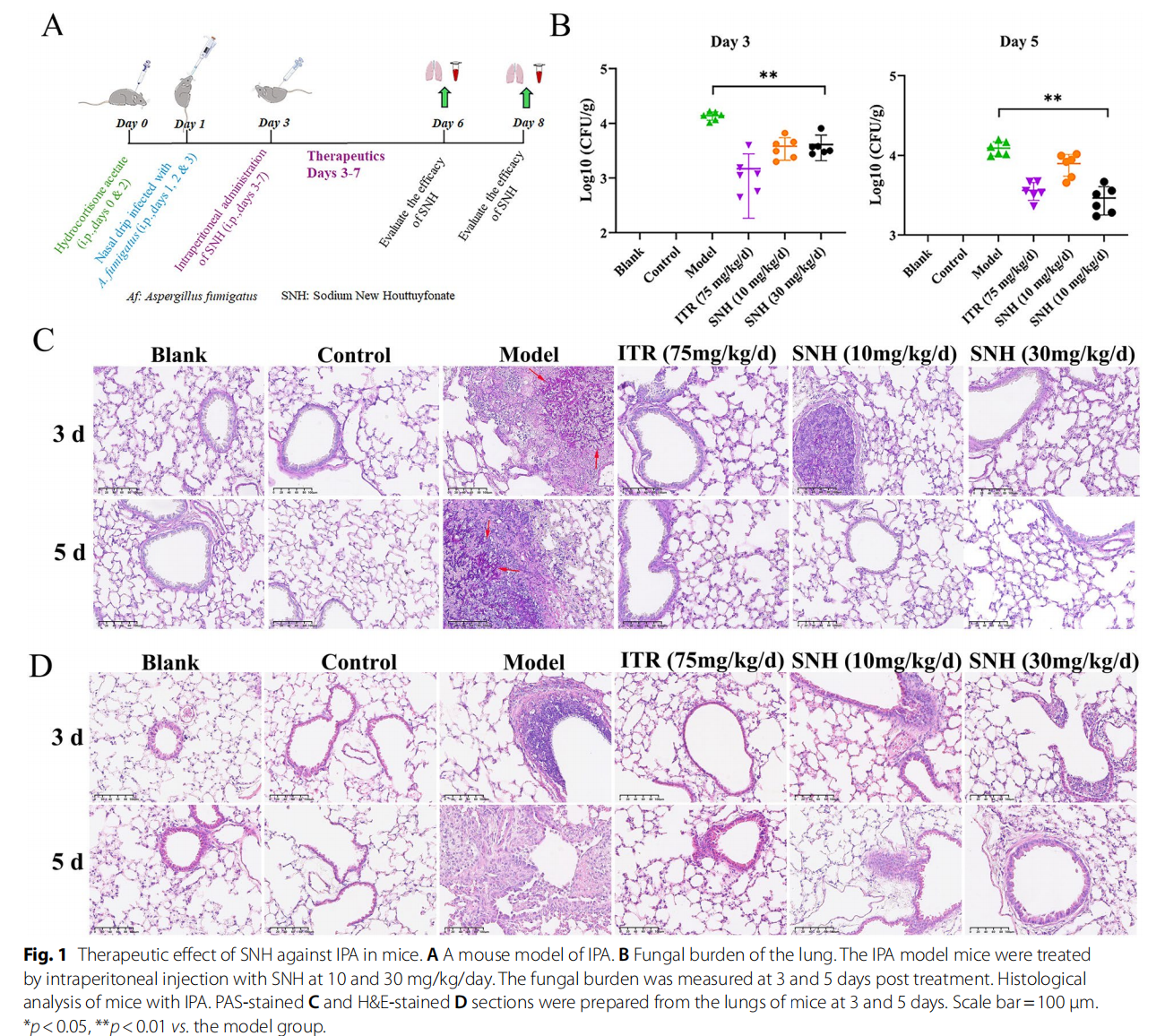
SNH对IPA疗效明显,改善肺组织病理及免疫细胞浸润
- SNH以10和30 mg/kg剂量经腹腔注射治疗IPA小鼠3与5天,肺组织曲霉CFU显著下降(P<0.05)。
- PAS染色显示,SNH治疗组肺组织曲霉菌丝减少,H&E染色体现肺泡结构保护及炎性细胞浸润减轻。
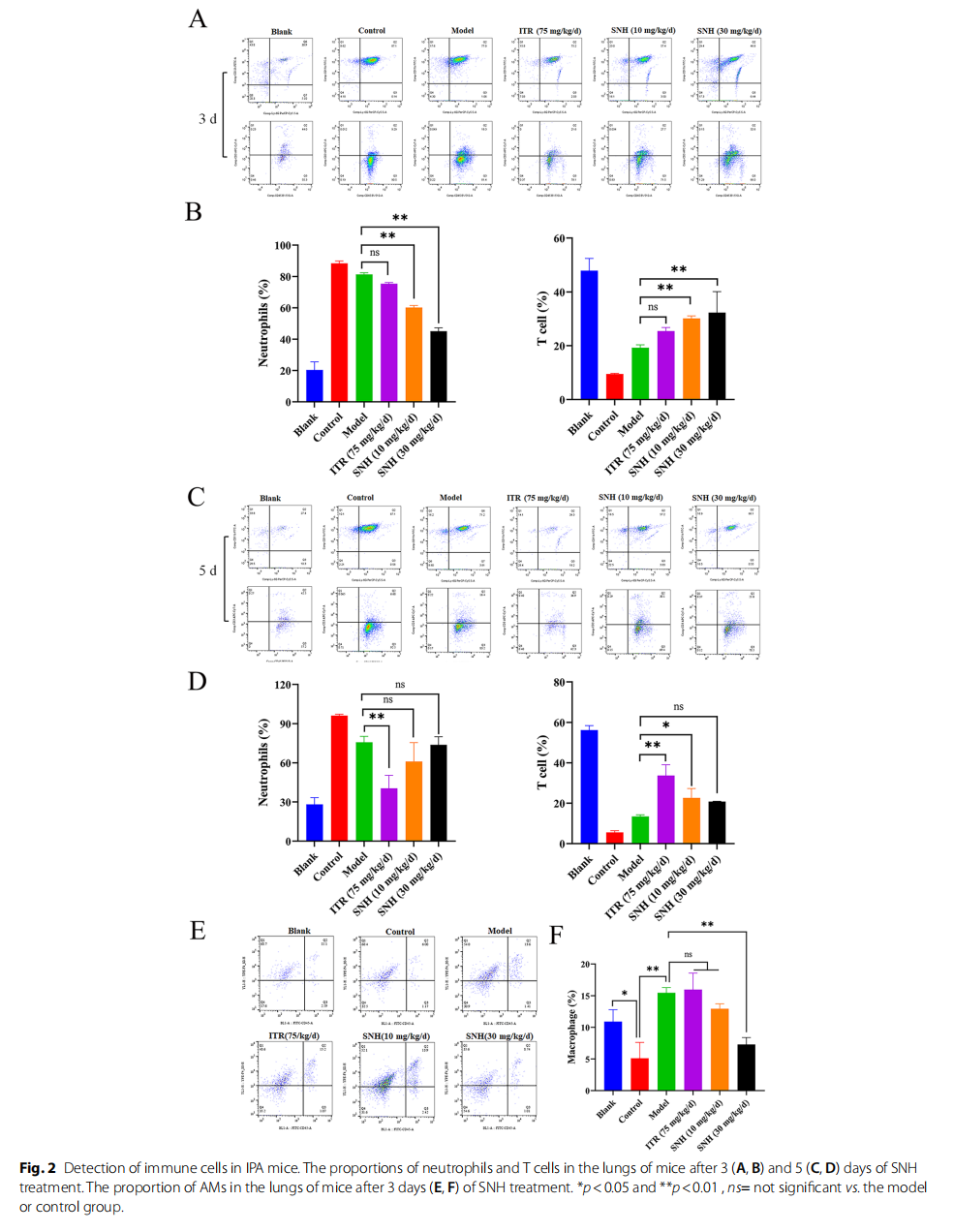
- 免疫细胞分析揭示,SNH3天用药显著降低肺中中性粒细胞比例,增高T细胞比例;5天用药10 mg/kg剂量下T细胞比例显著增加。IPA模型肺泡巨噬细胞比例随感染增加,SNH可有效调节其含量。
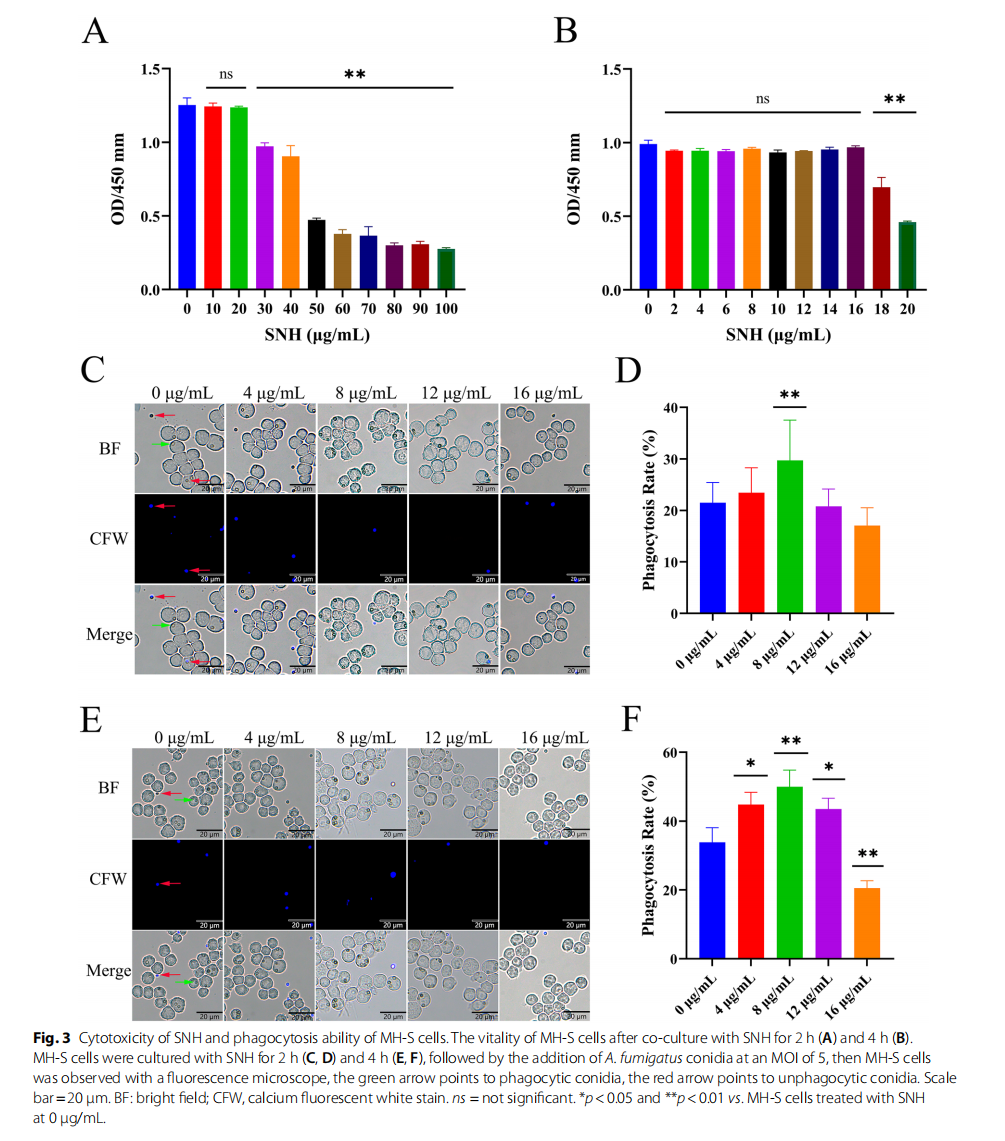
SNH增强MH-S细胞对曲霉孢子的吞噬与杀灭能力
- SNH 16 µg/mL以内对MH-S细胞无明显毒性,胞形态未见损伤。
- SNH处理2-4小时后,MH-S细胞对A. fumigatus孢子的吞噬率显著提升,8 µg/mL浓度最优(P<0.05)。
- SNH促进MH-S细胞杀灭曲霉孢子,4小时培养效果优于2小时,ROS产生未见显著变化。
SNH激活MH-S细胞的TLR2/TRAF6/IRF5及TLR2/TRAF6/ERK通路
- 非感染MH-S细胞中,SNH诱导212个差异表达基因,富集于TLR信号通路。重要基因如Jun、MIP-1α/β上调,SARM1下调。
- RT-qPCR与WB结果一致显示SNH升高TLR2、TRAF6及IRF5表达,相关炎症因子(TNF-α、IL-1β、IL-17A、CCL2等)迅速上调后随时间调低,提示短暂激活调控炎症稳态。
- MH-S细胞感染曲霉孢子后,SNH诱导149个差异表达基因,富集于细胞因子-受体及IL-17等通路。TLR2、TRAF6及ERK1表达明显上升,炎症相关基因持续高表达。
- 分子对接分析显示SNH与TLR2受体直接结合,结合自由能-6.54 kcal/mol,结合位点涉及关键氨基酸残基。
- 通过CRISPR-Cas13d成功敲降TLR2后,MH-S细胞吞噬及杀灭能力下降,SNH部分恢复其功能,表明TLR2为SNH作用的关键靶点。
SNH下调miR-328-5p和miR-6975-3p表达,解除对TLR2信号通路的抑制
- miRNA测序鉴定SNH处理MH-S细胞后,miR-328-5p和miR-6975-3p显著下调。
- 预测显示miR-328-5p与TLR2、IRF5编码区域有结合位点,miR-6975-3p靶向TLR2。
- RT-qPCR及过表达/抑制实验验证miR-328-5p和miR-6975-3p调控TLR2及相关蛋白表达,进而影响极巨噬细胞的曲霉孢子吞噬与杀伤功能。
研究价值与意义
本研究系统揭示了新鱼腥草素钠通过双靶向机制——直接结合TLR2激活关键下游信号通路(IRF5和ERK通路)与调控miRNA(miR-328-5p和miR-6975-3p)的协同作用,增强肺泡巨噬细胞清除A. fumigatus的能力。这不仅深化了对曲霉感染免疫防御机制的理解,也为IPA等免疫抑制相关真菌感染的治疗提供了全新策略。鉴于现有一线药物存在耐药性及毒副作用,开发基于宿主免疫调节的疗法尤为关键。SNH作为传统中药衍生的安全有效药物,具备良好的临床转化潜力,有望与现有抗真菌药物形成互补,改善IPA患者预后。
此外,该研究阐明了miRNA在巨噬细胞免疫调节中的关键角色,提示未来可针对特定miRNA进行靶向干预,开拓精准免疫治疗新途径。同时,实验验证TLR2为SNH生物作用的核心靶点,提示TLR2激动剂可能成为新型免疫治疗药物研发焦点。
不过,研究也存在局限,仅初步解析了免疫细胞比例及信号通路变化,需进一步深入探讨SNH对不同免疫细胞亚群(如特定T细胞亚群)及整体免疫网络的影响;同时,体内外模型的剂量优化和长期安全性评估仍需补充。此外,miRNA的具体下游靶基因和通路的复杂调控关系还有待更全面剖析。
原始出处
Zhou et al. The immunomodulatory effects of sodium new houttuyfonate on different states of macrophage against Aspergillus fumigatus infection via distinct mechanism in invasive pulmonary aspergillosis. Chinese Medicine. 2025;20:102. https://doi.org/10.1186/s13020-025-01157-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#侵袭性肺曲霉病# #新鱼腥草素钠#
15 举报