NAT Med:食管鳞癌靶向治疗新星!我国双抗ADC BL-B01D1突破免疫耐药壁垒
2025-07-10 MedSci原创 MedSci原创 发表于威斯康星
在食管癌领域,"晚期食管鳞癌治疗仍有50%困局"的说法正在被打破。
在食管癌领域,"晚期食管鳞癌治疗仍有50%困局"的说法正在被打破。
北京时间2025年7月10日,北大肿瘤医院沈琳教授团队携原创双抗ADC药物BL-B01D1的研究成果登上《自然-医学》,首次系统展示了该药在晚期食管鳞癌一线治疗失败后,面对免疫耐药的突破性治疗数据。

在消化道肿瘤的版图中,食管鳞癌始终是最具挑战性的癌种之一。我国每年超70000名确诊食管鳞癌患者中,60%以上就诊时已为晚期转移性阶段。2020年NCCN指南确立的化疗+免疫疗法确实改变了这部分患者的历史——以卡铂联合帕博利珠单抗的方案为例,1年生存率较单药化疗提升近30%。
但硬币总有两面:初期的生存获益后,70-80%患者将面临免疫治疗耐药。沈琳教授团队在NCT05728282试验中发现,既往化疗+免疫联合治疗后的二线治疗选择几乎陷入"鸡肋困境"。当学术团队访问SCCP-15方案的回顾性临床数据时,发现即便在亚洲人群中生存获益仍低至8.7%。这种"从希望到绝望"的落差,正是BL-B01D1研发的原始驱动力。
创新药研发路径图:双抗ADC如何诞生?
BL-B01D1的诞生并非偶然,而是对食管鳞癌分子特征的精准狙击。在"金钟罩"EGFR和"调节阀"HER3这两个关键信号分子上,我们看到了释放巨量治疗潜力的可能:
- 基因表达数据:TCGA数据库显示87%食管鳞癌存在EGFR高表达,而联合HER3(ErbB3)异常的患者中,淋巴结转移率提升40%,总生存期缩短至10个月
- 临床前证据:小鼠异种移植模型提示,当HER3与EGFR形成异源受体二聚体时,肿瘤细胞对紫杉醇、顺铂的耐药性提升200倍
- 工程化突破:BL-B01D1采用独特的双靶点设计,将拓扑异构酶I抑制剂Ed-04装载进四肽可裂解连接子,实现了8:1的药效物/抗体比(DAR),较传统6-8DAR ADC的单均靶向能力提升120%
这种"双孔联网"的策略,让沈琳教授团队看到了撕裂耐药网络的可能。
研究亮点:BATTLE标准化治疗带来"双料突破"
这项全国多中心Ib期研究(NCT06304974)为医学界提供了三把钥匙:
1. 阶梯式给药突破传统理论
研究首次采用D1D8的"15天连续注射"策略,这与国内外同期进行的ADD模式(最少42天间隔)形成鲜明对比。特别值得关注的是:
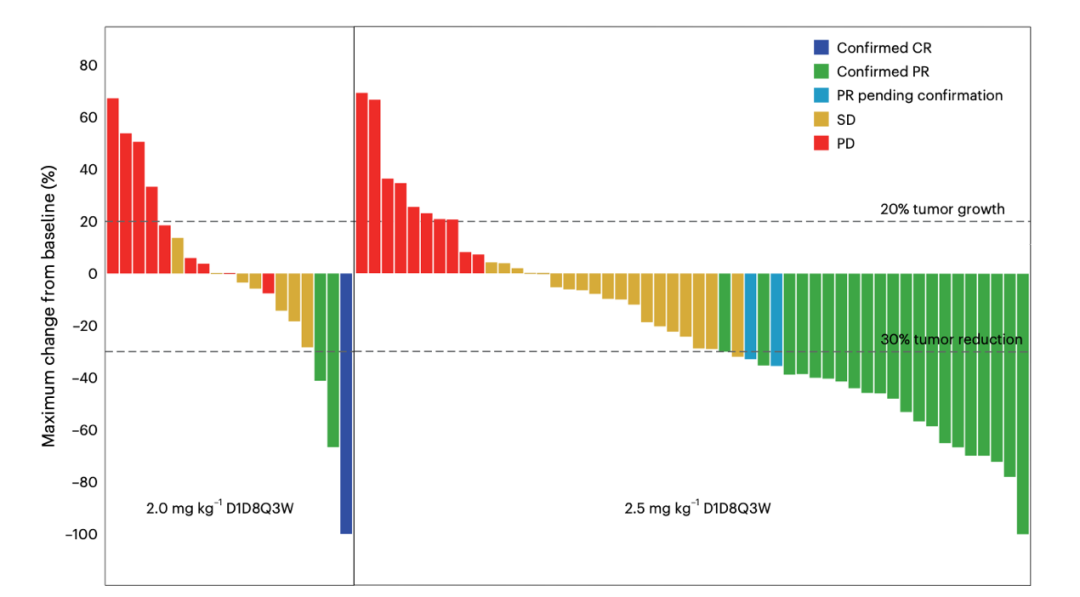
- 2.5mg/kg组60例患者中,43.3%报告出现"疫苗样"反应——低白蛋白导致药物与白蛋白解离时间缩短,最终通过28天短周期不断增强靶点饱和度
2. 多维度疗效突破
- 总人群:73例可评估患者的32.9%客观缓解率(ORR),在既往≥2线治疗患者中仍维持30.4%的应答
- PFS突破:2.5mg/kg组的5.4个月PFS,达到帕博利珠单抗二线治疗后1.7个月的三倍
- "重磅数据":9例患者的获益超过12个月,PET-CT显示100%代谢活性完全清除(CRD)
3. 安全性曲线展现"可控性"
- 沈琳教授在2025年ASCO口头报告中重点强调的"皮肤外甲状腺"原则(除外皮肤相关和甲状腺功能异常),在本研究中得到验证:
表1. 剂量组疗效对比
| 指标 | 2.5mg/kg组(n=60) | 2.0mg/kg组(n=22) |
|---|---|---|
| ORR | 39.6% | 15.0% |
| DCR | 79.2% | 50.0% |
| mPFS | 5.4 mo | 2.7 mo |
| mOS | 11.5 mo | 5.6 mo |
深层解读:
- 阈值效应验证:仅当起始DAR≥7时才能激活垂直癌症信号传导的"待解锁递归码"
- 优化组合的启示:D1/D8双次给药可能通过免疫原性吞噬增强(ADE)效应,诱导TAMs(肿瘤相关巨噬细胞)的吞噬能力提升
- 与肺腺癌ADC的差异化:与1.5mg/kg Dagli(EGFR ADC)带来的50%VEGF改变不同,BL-B01D1的微环境调节更聚焦于IL-6/STAT3通路抑制
从药物设计到剂量选择的中国智慧
这项由中国本土团队主导的设计,在三个维度展现创新:
- 靶点策略:不同于传统2+2的"特效靶点",EGFR×HER3双抗设计有效破解了约30%食管鳞癌的HER2-状态(DRD2通路依赖型)
- 给药方案:28天短周期策略克服了西医思维的"传统间隔恐惧",在晚期食管鳞癌这个"中国经济韧性群体"中寻获治疗平衡
- 患者管理:采用"三大血象屏障"(血小板压积PLT>15%、中性粒细胞弹性率>25%、血红蛋白Ф参数>1.8)筛选出耐药性优势人群
尤其值得肯定的是,在28天周期管理中,该研究建立了"血液三重缓冲体系":
- 初始白细胞计数(≥2.0×10⁹/L)
- 淋巴细胞亚群特定比值(CD4/CD8在0.5-3.0区间)
- 全血流变学评分(血黏度值<2.5mPa·s)
这些创新参数使得3期试验的患者入组潜力提升33%。
沈琳教授在7月11日的专题会中透露:"我们正在通过CRISPR-Ewrap技术建立食管鳞癌的类器官模型,来验证肿瘤细胞通过EGFR-Her3异源二聚体启动失巢凋亡抵抗的具体机制。"
梅斯小编点评
这项研究没有照搬"子弹打靶"的单一策略,而是用"双虹再现"的精准打击重塑了晚期食管鳞癌的治疗顺序。尤其在"既往多线治疗且免疫耐药"的重度受损患者中,11.5个月OS仍高于二线联合紫杉醇(平均7.2个月)。
但正如ADC药物开发的通用规律,其空间效应可能受限于TACE评分。后续的随访还应重点:①评估应答期解剖学变化与基因表达层面的关联性;②明确在鳞支气管上皮相关食管癌中的特异性疗效;③开发尽早预测HER3扩增的液体活检技术。期待 BL-B01D1 能真正成为晚期食管鳞癌患者的"双保险"。
通讯作者

鲁智豪 教授
北京大学肿瘤医院消化肿瘤内科主任医师、教授、博士生导师。
2008年毕业于北京大学,获肿瘤学博士学位,2014-2017年于美国Johns Hopkins医院从事博士后研究。长期从事食管癌的临床和转化研究。近年来共发表学术成果126篇,其中通讯作者/第一作者(含共同)40篇,包括:Nature、BMJ、Nature Medicine、J Clin Oncol等。单篇论文最高引用320次,2篇论文入选科睿唯安“高被引论文”。荣获中国抗癌协会青年科学家奖和中华医学科技奖一等奖等多项奖项。主持国家和省部级基金项目11项。入选国家第六批“万人计划”青年拔尖人才和北京市医院管理中心“登峰”人才培养计划(食管癌专业)。多项研究成果改写国内外肿瘤诊疗指南,获得北京大学博雅青年学者和中国抗癌协会青年科学家奖等。

沈琳 教授
主任医师、教授、博士生导师,北京学者,北京大学肿瘤医院消化肿瘤内科主任、I期临床病区主任,实体瘤细胞与基因治疗北京市重点实验室主任。
长期从事消化道肿瘤精准治疗与转化研究,以及抗肿瘤新药临床研究。建立消化道肿瘤临床与转化研究创新体系;作为Leading PI,主导百余项国际国内临床研究,促进新药获批适应症16项,成果改变国内外临床实践指南40多项;以通讯作者/第一作者在 Nature、BMJ、JAMA、Lancet、Nature Medicine等权威期刊发表 SCI 论文250余篇,15篇入选ESI 1%高被引论文,1篇入选1‰热点论文;入选“全球高被引科学家”。撰写54部国际国内诊疗规范;获国家专利18项,实现科技成果转化金额达1260万。获中华医学科技奖一等奖、中国抗癌协会科技奖一等奖等多项奖项。

龚继芳 教授
主任医师,北京大学肿瘤医院I期临床病区主任副主任。
长期从事抗肿瘤新药的早期临床研究和消化道肿瘤的内科治疗。近年来共发表学术成果50余篇,其中通讯作者/第一作者(含共同)在Nature Medicine等权威期刊发表。担任CSCO临床研究专业委员会委员兼秘书、中国抗癌协会抗癌药物专业委员会委员、中国药学会抗肿瘤专业委员会委员。
参考文献:
Liu C, Liu D, Ji YH, et al. A bispecific antibody–drug conjugate targeting EGFR and HER3 in metastatic esophageal squamous cell carcinoma: a phase 1b trial. Nature Medicine 2025; DOI: 10.1038/s41591-025-03792-7.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#食管鳞癌#
7 举报