Circ Res 杭州医学院梁广/应华忠团队揭示PRL2调控AMPK去磷酸化在心肌肥厚中的关键作用
2025-02-15 论道心血管 论道心血管 发表于陕西省
该研究首次揭示了蛋白酪氨酸磷酸酶PRL2在心肌肥厚中的关键调控机制。
病理性心肌肥厚(Pathological cardiac hypertrophy)及其引发的心力衰竭(Heart failure, HF)是一种复杂的多维度疾病综合征,涉及分子、代谢和机械层面的多重重塑过程,最终导致心脏进入失代偿状态。尽管近年来心力衰竭的循证治疗取得了一定进展,但心衰患者的再住院率和心脏不良事件发生率仍居高不下,这一现状凸显了寻找新型治疗靶点以实现有效药物干预的迫切需求。在心力衰竭的病理进程中,蛋白翻译后修饰,特别是磷酸化修饰,发挥着至关重要的调控作用。其中,蛋白酪氨酸磷酸酶(Protein tyrosine phosphatases, PTPs)通过其去磷酸化修饰功能,精确调控着功能蛋白的活性、亚细胞定位以及蛋白复合物的形成,进而影响细胞生理过程。研究表明,PTPs在癌症、免疫缺陷和心血管疾病等多种病理状态的发生与发展中扮演着重要角色。然而,PTPs在病理性心肌肥厚中的具体作用机制仍是一个亟待阐明的科学问题。
2025年2月14日,杭州医学院梁广教授研究团队与应华忠课题组合作,在心血管疾病领域顶级期刊Circulation Research在线发表重要研究成果。研究论文题为“A phosphatase PRL2 in cardiomyocytes promotes mitochondrial dysfunction and cardiac hypertrophy via directly removing T172 phosphorylation of AMPKα2”,首次揭示了蛋白酪氨酸磷酸酶PRL2在心肌肥厚中的关键调控机制。该研究创新性地发现了AMPK调控的新机制,PRL2能够直接结合AMPKα2并特异性去磷酸化其T172位点,这一分子事件导致心肌细胞线粒体功能障碍,进而诱导病理性心肌肥厚的发生。这一突破性发现不仅阐明了PRL2-AMPKα2信号轴在心肌肥厚中的分子调控机制,更为心力衰竭的防治提供了新的理论依据和潜在治疗靶点,具有重要的临床转化价值。

研究人员基于课题组前期血管紧张素Ⅱ (Ang Ⅱ)诱导肥厚心组织的转录组测序(RNA-sequence)数据,对107个PTPs家族成员的表达水平进行了分析,发现PRL2表达显著上调。这个现象在主动脉缩窄(TAC)诱导的心脏肥大小鼠模型以及HF患者中得到了进一步验证。利用PRL2基因全身性敲除小鼠(PRL2-/-),构建Ang Ⅱ及TAC诱导的病理性心肌肥厚小鼠模型,研究人员发现PRL2缺失有效预防了Ang II或TAC诱导的小鼠心脏功能障碍、肥大和纤维化(图1)。
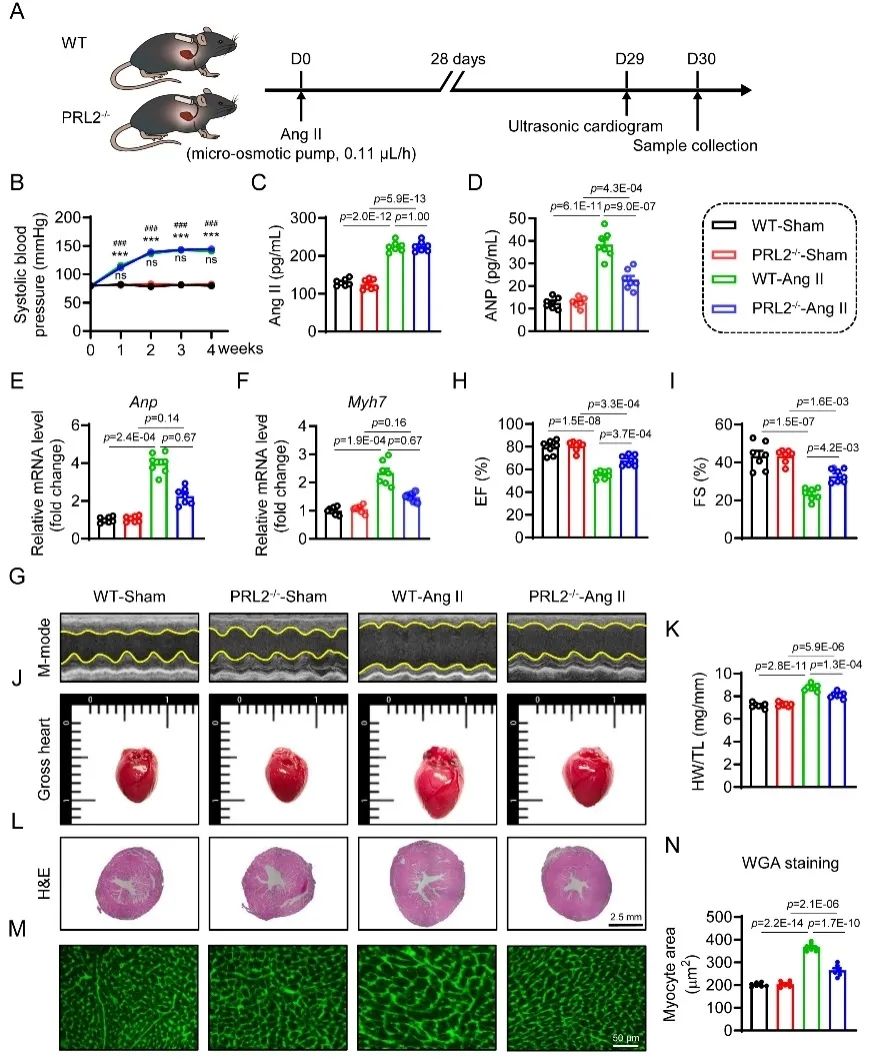
图1. PRL2缺失改善Ang II诱导的小鼠心功能不全和心肌肥厚
蛋白磷酸酶通过调控下游通路磷酸化,参与了多种细胞内重要的信号转导过程,与细胞的生物学过程密切相关。为了研究磷酸酶PRL2可能调控的下游信号通路,研究人员利用生物信息学分析手段,对Ang Ⅱ灌注的野生型小鼠和PRL2-/-小鼠的心肌组织进行了RNA-sequence分析。通过GSEA富集、GO富集等分析方式,研究人员发现PRL2对AMPK活性及下游脂质代谢和线粒体功能具有负性调节作用。分子生物学实验进一步证实PRL2通过介导AMPK信号通路,对心肌细胞的脂质代谢和线粒体氧呼吸具有重要调节作用。
为了明确PRL2调控AMPK去磷酸化的潜在分子机制,研究人员通过液相质谱-串联质谱(LC-MS/MS)、免疫共沉淀(Co-IP)、生物膜干涉技术(BLI)等实验进一步确认PRL2与AMPKα2 CTD结构域结合,并通过C46酶活位点去磷酸化AMPKT172,进而诱导心肌细胞能量代谢障碍和心肌肥厚(图2)。
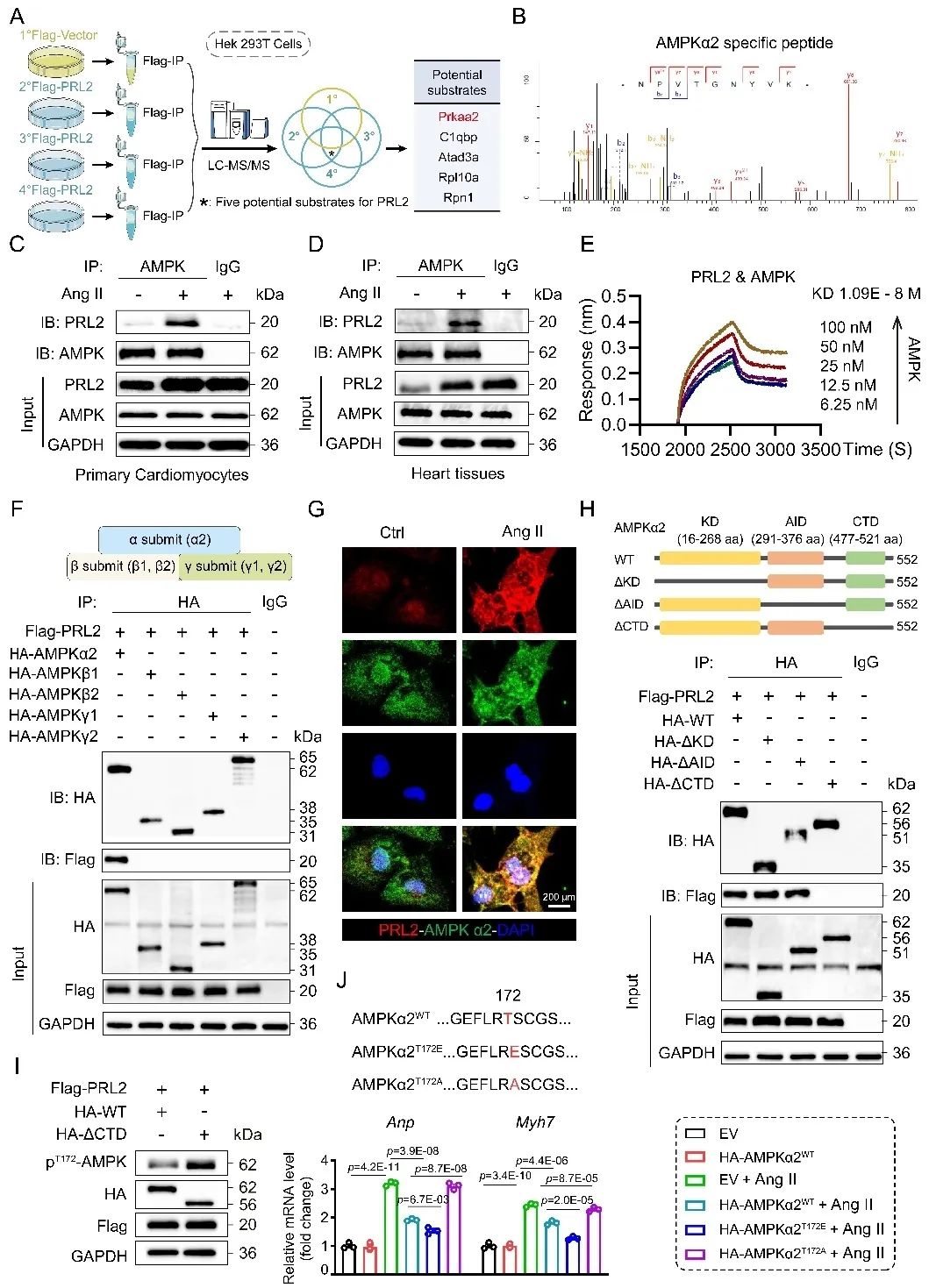
图2. 实验验证AMPKα2作为PRL2的底物
综上所述,该工作揭示了PRL2通过调控AMPKα2T172的去磷酸化,直接介导心肌细胞线粒体功能障碍及病理性心肌肥厚的发生机制(图3)。该研究首次发现PRL2缺失对病理性心脏肥厚具有保护作用,这一突破性发现为心力衰竭的防治提供了新的理论依据。更为重要的是,PRL2作为调控AMPK的磷酸酶在心脏病理进程中发挥关键作用,提示激活AMPK的新途径。从药物研发的角度来看,与直接激活AMPK相比,开发具有高成药性的小分子PRL2抑制剂或将是一条更为便捷的研发路径。针对PRL2的药物抑制或基因治疗有望成为治疗心力衰竭的潜在新策略。
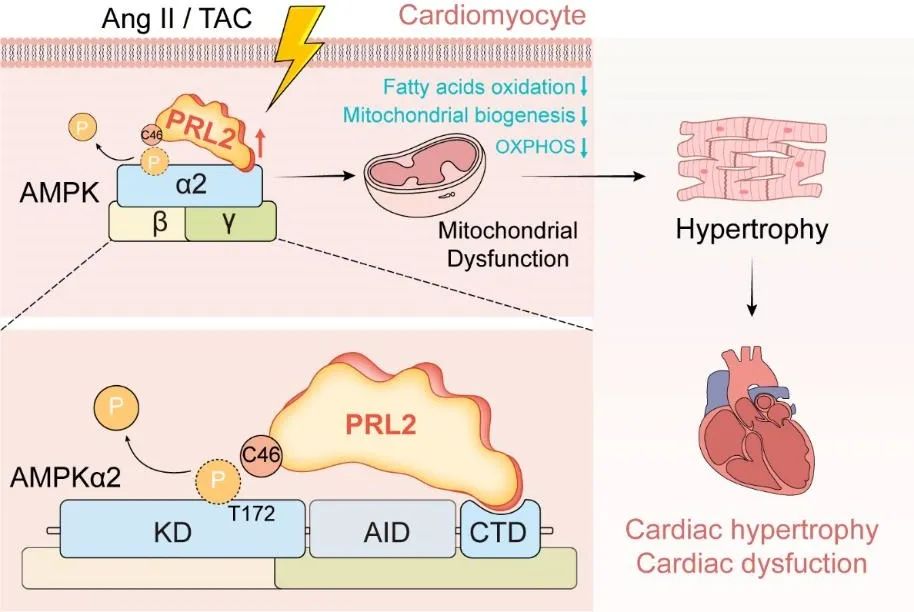
图3. 研究机制图
杭州医学院梁广研究员为本论文末位通讯作者,应华忠研究员为共同通讯作者,副研究员韩雪和石巧娟为文章并列第一作者。该研究获得国家自然科学基金项目以及浙江省自然科学基金资助。
原文链接:
https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.124.325262
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#心肌肥厚# #PRL2#
27 举报