赵妍敏/黄河/胡晓霞/莫晓冬教授等探索TP53变异和胚系突变对AML/MDS异基因干细胞移植结局的影响
昨天 聊聊血液 聊聊血液 发表于上海
鉴于 TP53 突变的临床和生物学异质性,国内学者开展了一项多中心回顾性研究,旨在描述胚系和体细胞 TP53突变之间的差异,以完善疾病轨迹和优化移植策略。
TP53突变
TP53突变骨髓增生异常综合征(MDS)和急性髓系白血病(AML)通常具有复杂的细胞遗传学异常,并且对强化疗耐药。异基因造血干细胞移植(allo-HSCT)是目前唯一可能治愈TP53突变MDS和AML的方法,但关于胚系与体细胞TP53突变在allo-HSCT下的结局差异尚不清楚,且不同突变域TP53突变的预后影响也尚未明确,错义突变与截短突变的影响以及多打击TP53状态的预后意义也存在争议。
鉴于 TP53 突变的临床和生物学异质性,国内学者开展了一项多中心回顾性研究,旨在描述胚系和体细胞 TP53突变之间的差异,以完善疾病轨迹和优化移植策略。研究结果近日发表于《Leukemia》,共同通讯作者为浙江大学医学院附属第一医院赵妍敏教授和黄河教授、上海交通大学医学院附属瑞金医院胡晓霞教授、北京大学人民医院莫晓冬教授。共同第一作者为浙江大学医学院附属第一医院的赵叶千博士、施继敏教授,郑大附属第一医院的曹伟杰教授,华中科技大学附属同济医院的曹阳教授,宁波大学附属人民医院的陆滢教授。

研究方法&结果
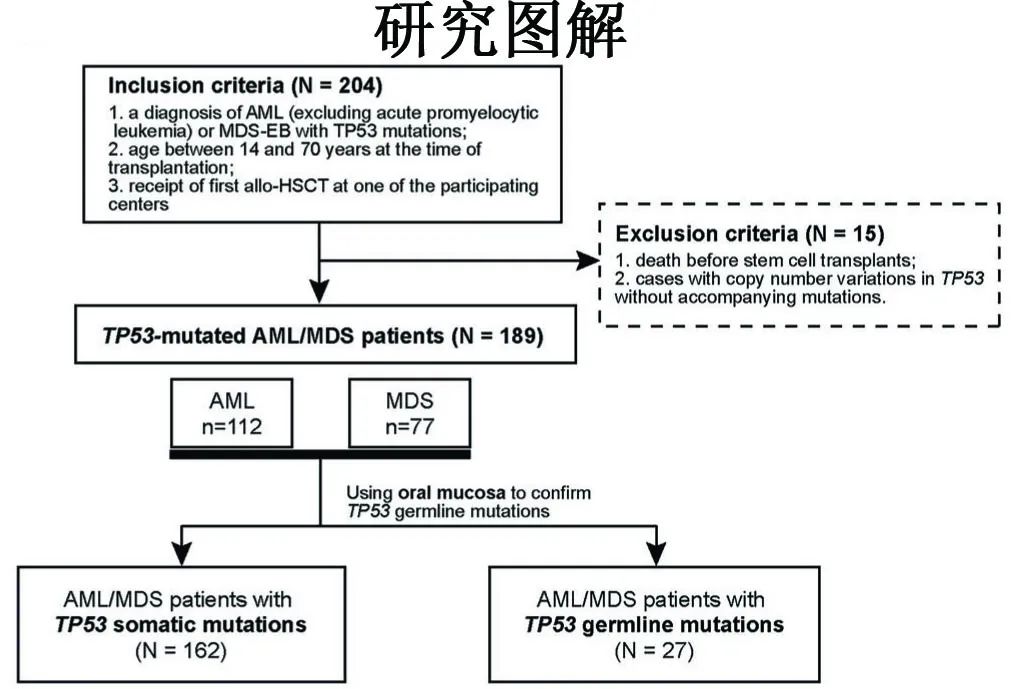
研究方法:该研究是一项多中心回顾性研究,分析了2016年9月至2024年4月期间在10家中心接受allo-HSCT的TP53突变的AML/MDS患者。纳入标准包括诊断为AML(排除急性早幼粒细胞白血病)或MDS-EB伴TP53突变,移植时年龄在14至70岁之间,并在研究的中心接受首次allo-HSCT;排除标准包括移植前死亡和TP53拷贝数变异但无突变。体细胞突变通过二代测序(NGS)识别,胚系TP53变异通过口腔黏膜检测确认。主要终点为总生存率(OS),次要终点包括无事件生存率(EFS)、累积复发率(CIR)和非复发死亡率(NRM)。
患者群体:共回顾了204例TP53突变AML/MDS患者,其中189例符合条件并纳入分析。86%(162/189)的患者携带体细胞TP53突变,14%(27/189)携带胚系TP53突变。
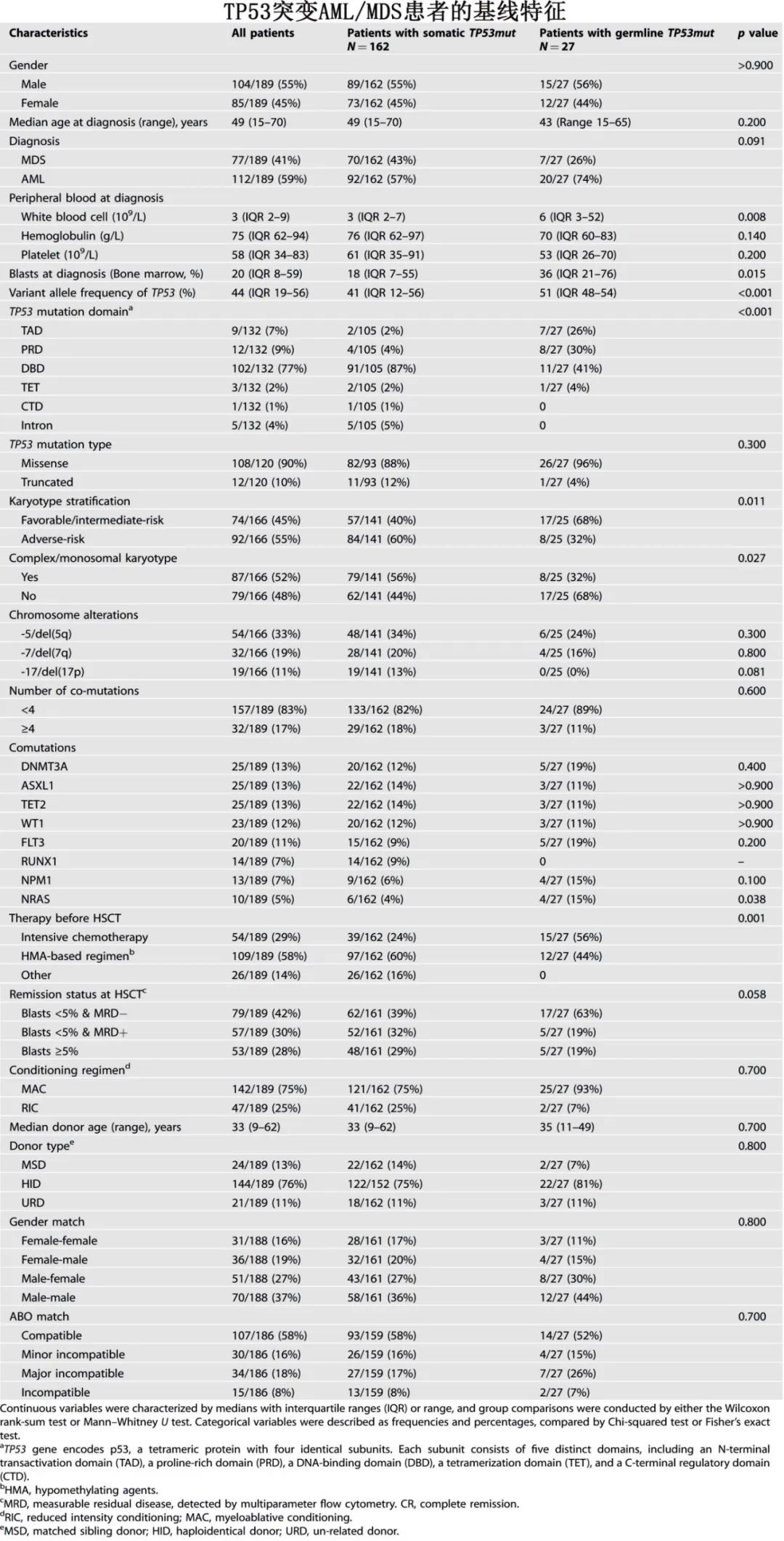
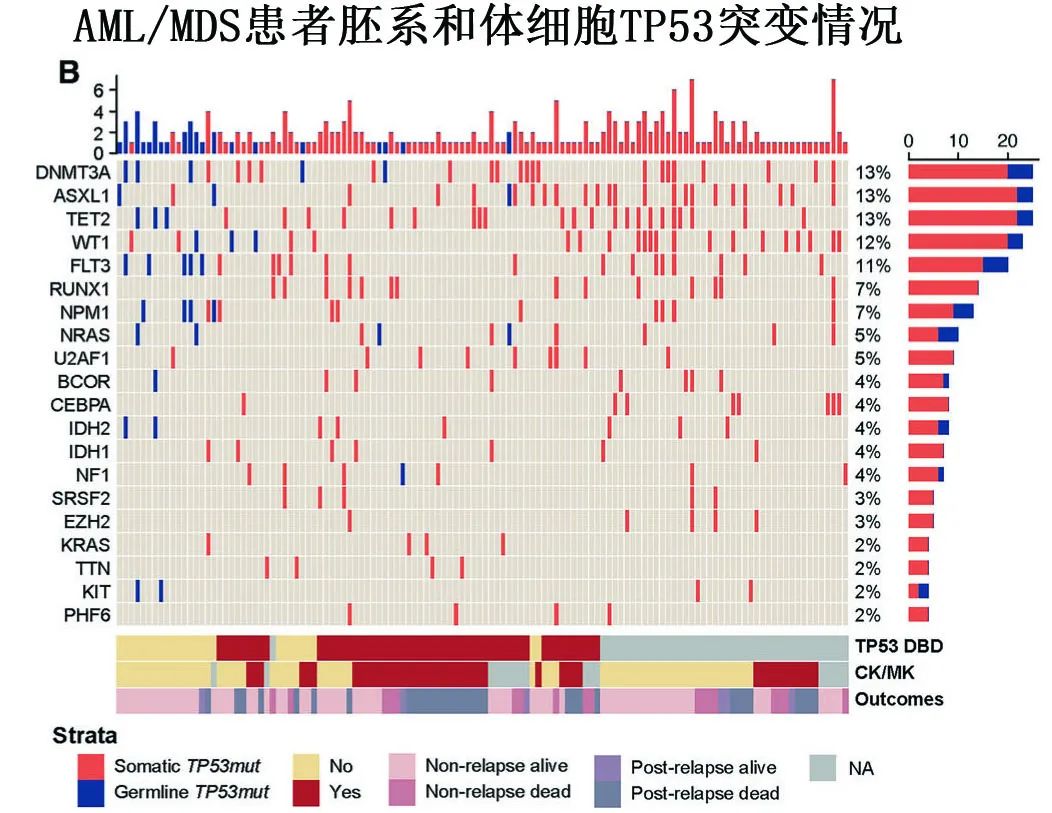
突变特征:体细胞突变患者较胚系突变患者更常携带DNA结合域(DBD)突变 (87% vs. 41%,p < 0.001),而错义突变vs.截短突变的分布相似 (88% vs. 96%,p=0.300)。热点变异也有差异:体细胞突变患者以R248、Y220、R175、R273、C242为主,而胚系突变患者以V31、P72(不包括P72R SNP)、R175为主。在胚系突变患者中,NRAS突变共突变频率显著高于体细胞突变患者(15% vs. 4%,p=0.038),而 RUNX1 突变仅在体细胞突变患者中观察到,在胚系突变患者中不存在。细胞遗传学方面,复杂核型/单体核型 (CK/MK) 在体细胞突变患者中更普遍 (56% vs. 32%,p=0.027)。胚系突变患者中不存在 Chr17 改变,但其存在于13%的体细胞病例中,而-5/del(5q) 和-7/del(7q) 频率相当。此外,两组间基线移植特征相当,包括预处理方案、供者类型、ABO相容性和性别匹配。
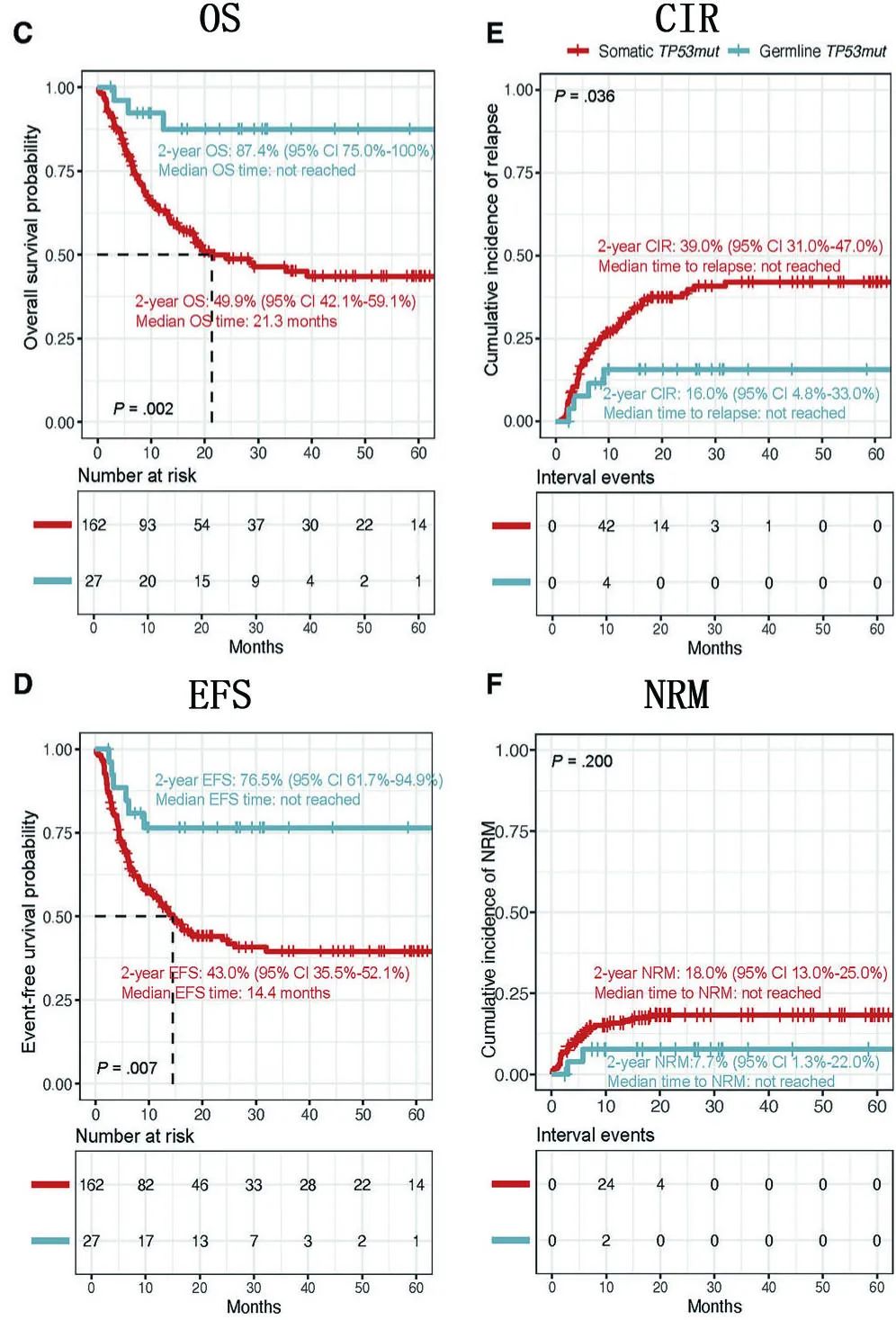
移植结局:胚系TP53突变患者的2年OS(87.4% vs. 49.9%, p=0.002)、EFS(76.5% vs. 43.0%,p=0.007)显著优于体细胞突变患者,CIR也更低(19.0% vs. 39.0%, p=0.036),但NRM差异不显著(7.7% vs.18.0%, p=0.200)。胚系突变患者的中位OS和EFS均未达到,而体细胞突变患者的中位OS为21.3个月,EFS为14.4个月。
不同亚组的结局:在年龄在50岁以下、有错义突变、接受 MAC 方案或接受单倍体相合移植的亚组中,与体细胞突变患者相比,胚系TP53突变患者表现出更好的结局。
突变特征的影响:DNA结合域(DBD)内突变患者的结局显著差于DBD外突变患者(2年OS:41.7% vs 86.2%,p<0.001;EFS:33.0% vs 78.5%,p<0.001;CIR:50.0% vs 15.0%,p<0.001)。而TP53等位基因状态(多打击vs单打击,根据ICC 2022)、突变类型(错义突变与截短突变)以及共突变的数量对移植后结局的影响不显著。与无CK/MK的患者相比,CK/MK显著恶化TP53突变AML/MDS患者的移植后结局(OS:36.0% vs 73.0%,p<0.001;EFS:28.0% vs 65.5%,p<0.001;CIR:58.0% vs 20.0%,p<0.001)。然而在具有CK/MK的患者中,胚系和体细胞TP53突变之间未观察到显著差异。
疾病特征的影响: MDS患者的2年OS和EFS显著短于AML患者(OS:44.6% vs 62.3% ,p=0.027;EFS:41.7% vs 52.2% ,p=0.043)。移植前达到骨髓原始细胞<5%且多参数流式细胞术(MFC)微小残留病(MRD)阴性的患者与其他组相比,预后最佳(p<0.001)。在体细胞突变患者中也观察到了这种现象,而MRD对胚系TP53突变患者的预后影响有限。对于AML患者,达到骨髓原始细胞<5%且MFC-MRD阴性的患者预后最佳,而骨髓原始细胞≥5%的患者预后最差。相比之下,无论移植时是否达到缓解或MRD状态,MDS-EB患者的预后相似。移植策略方面,减低强度预处理(RIC)和高龄与显著更差的结局相关,而供者型和性别匹配对结局没有显著影响。
多变量分析:在多变量分析中,体细胞TP53突变与胚系突变相比,与较差的OS独立相关(HR 3.0,95% CI 1.0–10.5,p=0.049),CK/MK也是独立的不良预后因素(OS:HR 2.6,95% CI 1.5–4.6,p<0.001;EFS:HR 2.7,95% CI 1.6–4.4,p<0.001;CIR:HR 3.4,95% CI 1.9–6.1,p<0.001)。

总结
胚系TP53突变和体细胞TP53突变患者在突变特征、共突变和细胞遗传学特征上存在显著差异。胚系TP53突变AML/MDS患者在接受allo-HSCT后的结局显著优于体细胞TP53突变患者,CK/MK是TP53突变的AML/MDS患者移植后结局的独立不良预测因素。TP53突变的DBD对预后有显著的负面影响,而TP53的等位基因状态(多打击与单打击)、突变类型(错义与截短)和共突变数量对移植后结局的影响不显著。
该研究强调了胚系和体细胞 TP53 突变 AML/MDS 之间的生物学和临床差异,强调了个体化风险分层的必要性。需要进一步的研究来阐明潜在的机制,并为这些不同的亚组制定靶向治疗策略。
参考文献
Zhao, Y., Cao, W., Shi, J. et al. Impact of TP53 variants and germline mutations on allogeneic stem cell transplantation outcomes in acute myeloid leukemia and myelodysplastic neoplasms. Leukemia (2025). https://doi.org/10.1038/s41375-025-02672-w

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#TP53突变# #AML/MDS#
2 举报