肝细胞癌(HCC)是中国常见的恶性肿瘤,严重威胁人民的生命和健康。近年来,免疫生物治疗给HCC的治疗提供了新的选择。细胞免疫治疗、肿瘤疫苗、溶瘤病毒以及免疫检查点抑制剂等多样化的新兴免疫生物治疗技术也逐步向临床应用推进。为此,肝癌在线邀您共享北京大学人民医院陈红松教授关于肝癌免疫治疗研究进展的精彩内容。
一、肝癌与免疫治疗现状
目前,肝癌的全球发病率和死亡率仍处高位,也是中国常见的恶性肿瘤,其病死率在所有恶性肿瘤中位居第二,发病率在所有恶性肿瘤中位居第四。免疫治疗已成为当今抗肿瘤治疗策略的新热点。新型肿瘤免疫治疗包括免疫检查点抗体、CAR-T细胞治疗、TCR-T细胞治疗和新生抗原疫苗。
随着近年肿瘤免疫学理论的发展及新技术的突破,基于“肿瘤免疫循环”的理论,并结合免疫多组学研究手段,使得整体评估并可视化展示实体瘤的免疫微环境成为可能。肿瘤免疫循环是描述抗肿瘤免疫应答的模式图,将抗肿瘤免疫应答分为以下七个步骤:
①肿瘤细胞释放抗原;
②肿瘤抗原呈递;
③T细胞激活;
④T细胞向肿瘤组织迁移;
⑤肿瘤组织T细胞浸润;
⑥特异性识别肿瘤细胞;
⑦通过免疫作用杀死肿瘤细胞。
采用八个维度评估抗肿瘤免疫应答,包括:T细胞免疫、肿瘤新生抗原负荷、致敏及活化、趋化及浸润、识别肿瘤细胞、抑制细胞、免疫检查点分子表达、抑制分子表达。
根据免疫循环参数,HCC免疫循环可以分为两型:“冷肿瘤免疫循环”和“热肿瘤免疫循环”(图1)。“冷肿瘤免疫循环”的HCC患者,抗原递呈功能低下,免疫细胞浸润较少,缺乏肿瘤特异性T细胞。“热肿瘤免疫循环”的HCC者,免疫细胞浸润较多,新生抗原负荷较高,但抗肿瘤免疫整体属于高度抑制状态,耗竭型T细胞较多。HCC的免疫治疗应针对上述不同患者类型,制定不同的个体化治疗策略。
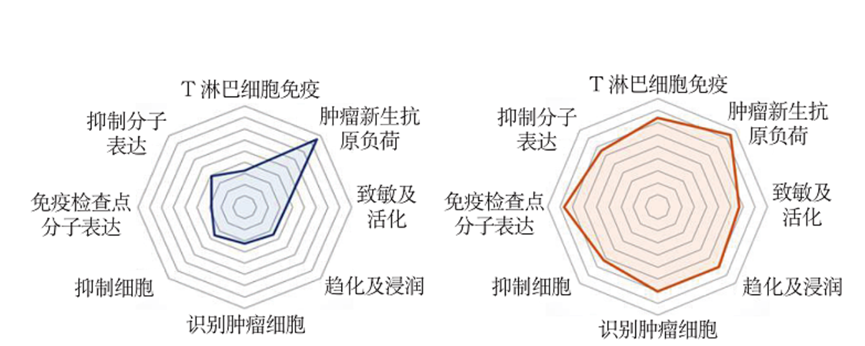
图1.“冷肿瘤免疫循环”和“热肿瘤免疫循环”模式图
对于“冷肿瘤免疫循环”的HCC患者,可以采用过继性细胞疗法(CIK、TIL、CAR-T、TCR-T等)或肿瘤抗原疫苗(新生抗原)。
“热肿瘤免疫循环”的HCC患者,由于免疫细胞浸润较多,新生抗原负荷较高,但耗竭型T淋巴细胞较多,可以采用免疫检查点抑制剂(ICIs)通过阻断免疫抑制效应,进而恢复T淋巴细胞的杀伤活性。
二、新型免疫治疗在肝癌上的应用
1. 免疫检查点抑制剂
以程序性死亡配体 1(PD-L1)/程序性死亡受体 1(PD-1)抗体为代表的ICIs药物,虽在多种实体瘤中的临床试验结果令人鼓舞,但HCC的临床试验结果表明,单药免疫治疗并未能显著改善患者的总体生存率。免疫联合治疗方案在HCC治疗中初见曙光。
CheckMate-040研究结果[1]首次证实了纳武利尤单抗(PD-1抗体)联合伊匹木单抗(CTLA-4抗体)能为既往接受过索拉非尼治疗的晚期HCC患者带来显著获益,客观应答率为32%。
IMbrave150临床试验结果表明[2],在既往未接受过全身性治疗的不可切除的HCC患者中,阿替利珠单克隆抗体联合贝伐珠单抗治疗组的总生存期和无进展生存期结局显著优于索拉非尼组,联合治疗将中位无进展生存期延长到6.8个月。同时,联合治疗组死亡风险降低了42%;12个月时的总生存率在索拉非尼组为54.6%,联合治疗组提高到67.2%。
III期临床试验HIMALAYA结果显示[3]度伐利尤单抗联合曲美木单抗(STRIDE方案)显著提高了患者三年生存率。与索拉非尼组(n=389)相比,度伐利尤单抗联合曲美木单抗方案(n=393)使患者的死亡风险降低了22%。两组的中位总生存期(OS)为16.4个月和13.8个月,达到了研究的主要终点。STRIDE组接近三分之一(31%)的患者生存期超过3年,而对照组(索拉非尼)为20%。在NCCN HCC指南2023版中也提出,对于高肿瘤突变负荷型肿瘤,纳武利尤单抗(PD-1抗体)+伊匹木单抗(CTLA-4抗体)可用于治疗对标准治疗耐药或无标准治疗方案的患者,证据等级为2B类。
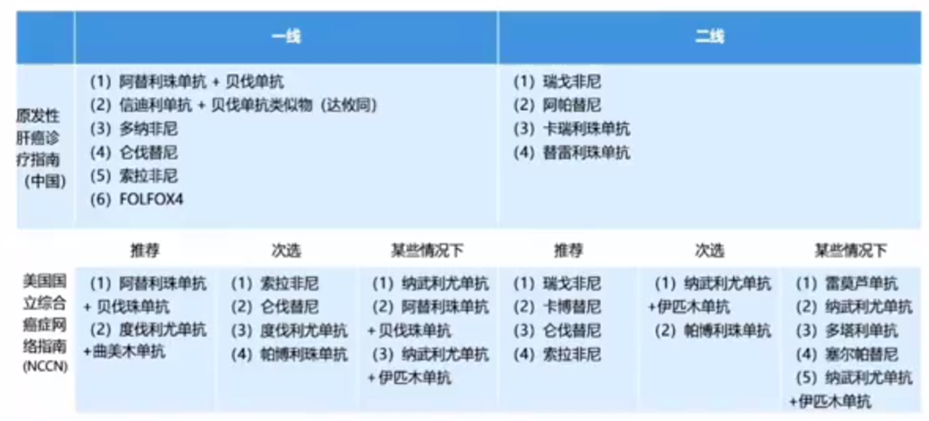
表1. HCC系统性治疗指南方案
2. ICIs免疫相关的不良事件(irAEs)
随着ICIs的临床应用,免疫相关不良反应逐渐引起大家关注,主要是ICIs导致的重要器官的免疫性炎症。在ICIs免疫治疗中,最常受到影响的是皮肤、胃肠道、肺、肝和内分泌器官等;最常见的任何级别irAEs是皮肤(79,47%)、肝胆(24,14.3%)和内分泌(16,9.5%);最常见的≥3级irAEs是肝胆(12,7.1%)、胃肠(5,3.0%)和肺炎(4,2.4%)。CTLA-4抑制剂所引起的irAEs明显高于PD-1/PD-L1抑制剂所引起的irAEs。
在接受PD-1抗体治疗的晚期HCC患者中,发生严重irAEs(3-5级)的比例约为20%-50%。接受PD-1抗体治疗的患者发生严重irAEs的比例约为10-20%,而接受CTLA-4抗体治疗的患者发生严重irAEs的比例约25%。ICIs联合用药会引起协同免疫毒性,PD-1抗体和CTLA-4抗体联用所引起的严重irAEs的比例约为50%。
3. irAEs的发生与肝癌ICIs疗效之间的关系
与无irAEs患者相比,出现任何级别irAEs患者的中位无进展生存期(PFS)和总生存期(OS)更长。与≥3级irAEs患者相比,出现1/2级irAEs患者的中位PFS和OS更长。在使用ICIs治疗的晚期HCC患者中,出现irAEs可能是一个潜在的预后标志物。
4. CAR-T治疗
2020年,全球首个靶向GPC3 CAR-T细胞治疗HCC的临床试验[4]取得了较好的效果。结果显示13例受试者中2例获得部分缓解(PR);3年、1年、6个月生存率分别为10.5%、42.0%和50.3%;中位生存时间(OS)为278天(95%CI:48,615天)。
5. TCR-T治疗
靶向AFP突变抗原的TCR-T I期临床实验结果显示,接受最高剂量的4名肝癌患者中有1名患者获得完全应答,这位患者在治疗前外周血AFP水平很高,经治疗后明显下降并恢复正常。
6. 新生抗原
新生抗原是指肿瘤细胞中因基因突变等事件编码出的正常组织中不存在的抗原多肽。新生抗原特异性和免疫原性更好,可诱导更强的抗肿瘤免疫应答。肝癌属于中位体细胞突变负荷肿瘤,肝癌体细胞突变负荷及其产生的新生抗原负荷与患者生存期相关,携带TP53新生抗原的肝癌患者总生存期更长,免疫评分更高,CTL浸润程度、免疫细胞溶细胞活性(CYT)评分更高。HBV相关肝癌中可能存在更多新生抗原,这些间接证据表明新生抗原在HCC治疗中有较好的前景。肝癌新生抗原临床研究尚在起步阶段,本研究团队发现HCC患者的外周血中存在可识别来源于ENTPD6和ALG1突变的T细胞。
中山大学附属第一医院的团队使用新生抗原负载的DC疫苗和过继性T细胞等联合免疫治疗方式,用于预防接受了根治性切除术或射频消融的10例肝癌患者肿瘤复发。研究发现,对治疗产生免疫反应的患者无病生存期显著延长;71.4%的患者在治疗后2年内没有复发,并且这些治疗措施也具有良好的安全性。
三、肝癌联合免疫治疗策略和挑战
1. 突破HCC微环境的免疫抑制
HCC属于高度免疫抑制型肿瘤,超过半数HCC患者的抗肿瘤免疫分型符合“冷肿瘤免疫循环”特征。针对这类HCC者,需要通过过继性细胞免疫疗法直接输注经体外活化处理的免疫细胞(CAR-T;TCR-T),同时联合其他治疗方案将“冷肿瘤免疫循环”变为“热肿瘤免疫循环”,难点在于CAR-T和TCR-T的制备。
2. 提高特异性免疫识别
新生抗原的免疫治疗表现出巨大潜力,HCC可能是一种适合新生抗原免疫治疗的肿瘤。我国HBV感染是HCC发生的最主要原因,HBV相关肝癌具有独特的基因突变模式,HBV整合频率高,产生大量的新生抗原。难点在于新生抗原的筛选鉴定。
3. 增强抗肿瘤免疫效应剂
IMbrave150研究的成功是晚期HCC治疗的重大突破,打破了晚期HCC一线治疗的僵局,同时展现了联合免疫治疗,特别是分子靶向药物与免疫检查点抑制剂联用的广阔前景。此外,有可能在此基础上再加入新生抗原的联用提供高免疫原性靶标,联合高杀伤活性T细胞,与血管生成抑制,多方面增强抗肿瘤免疫效应。
参考文献
[1] El-Khoueiry A B, Sangro B, Yau T, et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial[J]. Lancet, 2017, 389(10088): 2492-2502.
[2] Finn R S, Qin S, Ikeda M, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma[J]. N Engl J Med, 2020, 382(20): 1894-1905.
[3] Kudo M. Durvalumab plus tremelimumab in unresectable hepatocellular carcinoma[J]. Hepatobiliary Surg Nutr, 2022, 11(4): 592-596.
[4] Shi D, Shi Y, Kaseb A O, et al. Chimeric Antigen Receptor-Glypican-3 T-Cell Therapy for Advanced Hepatocellular Carcinoma: Results of Phase I Trials[J]. Clin Cancer Res, 2020, 26(15): 3979-3989.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肝癌# #免疫治疗#
41 举报