暨南大学薛巍/朱静宜ACS Materials Letters:三重钙离子超载策略联合光热用于肿瘤归巢治疗
2025-06-14 BioMed科技 BioMed科技 发表于上海
暨南大学团队开发 CMD 纳米颗粒,以癌细胞膜包裹负载姜黄素的无定形碳酸钙,借光热效应、姜黄素调控及酸响应释钙三重机制致 Ca²⁺超载,实现高效肿瘤靶向杀伤。
钙离子(Ca2+)作为第二信使,在生理过程中起关键作用,但细胞内Ca2+过载会引发线粒体功能障碍和细胞死亡,这让Ca2+过载成为一种有前景的癌症治疗策略。近年来,光控增强Ca2+过载策略取得显著进展,然而,这些策略主要依赖于纳米颗粒增强的通透性和滞留(EPR)效应,以在肿瘤组织内实现被动靶向。这种被动靶向机制往往导致纳米颗粒在肿瘤部位的积累不理想,无法充分发挥其治疗潜力。因此,迫切需要开发一种方法,既能促进纳米颗粒(NPs)高效递送至肿瘤组织,又能引发细胞内Ca2+水平显著且持续的升高。

论文发表截图
近日,暨南大学薛巍教授和朱静宜副教授团队在《ACS Materials Letters》上发表题为“Photothermal Amplification of Calcium Ion Overload for Tumor Homing Therapy”的论文。该研究用嵌有DiR的癌细胞膜包裹负载有姜黄素(Cur)的无定形碳酸钙纳米颗粒CMD。CMD纳米颗粒在实现同源靶向的同时,还可通过三种机制协同增强Ca2+过载:一是通过DiR实现光热效应的同时打开TRPV1通道,促进Ca2+内流;二是姜黄素(Cur)的特异性Ca2+调控双机制;三是无定形碳酸钙的酸响应解离释放Ca2+,三者协同作用,显著提升肿瘤细胞内Ca2+浓度,诱导细胞凋亡,实现高效肿瘤归巢治疗。
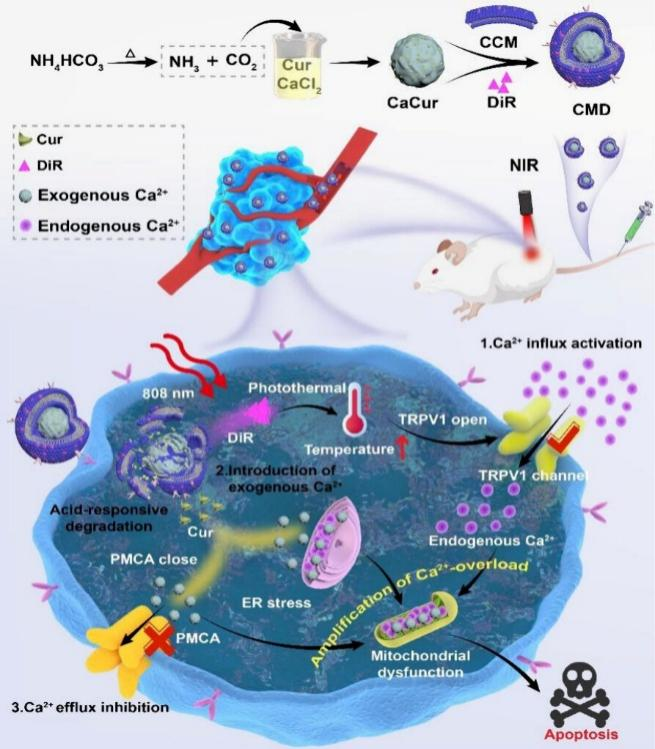
摘要图:CMD纳米颗粒在肿瘤部位对肿瘤细胞杀伤示意图。
主要内容:
研究人员使用4T1癌细胞对负载有姜黄素(Cur)的无定形碳酸钙纳米颗粒(CaCur)进行表面修饰得到CMD纳米药物递送系统。TEM(图A)的图像显示,CaCur纳米颗粒直径约100 nm,且呈现单分散状态,DLS粒径约为122 nm(图C)。XRD、TGA、FTIR、XPS和UV-Vis(图E-I)表明了CaCur的成功制备。TEM、Zeta电位、SDS-PAGE、HRTEM和元素映射分析(图B、D、J&K)表明癌细胞膜成功包覆且膜蛋白完整保留。
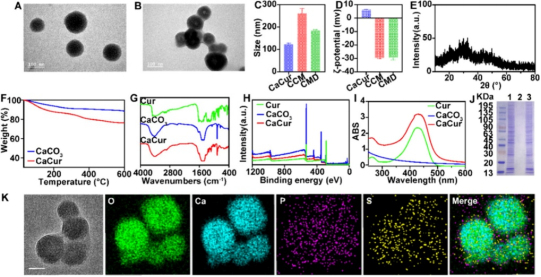
图一:CaCur及CMD表征。
体外细胞毒性实验的结果(图二A、B&D)表明CMD在暗条件下表现出较低的细胞毒性,在808 nm激光照射下对4T1细胞表现出显著的毒性,且这种毒性具有pH依赖性,在酸性环境下毒性增强。进一步机制研究表明,CMD纳米颗粒在808 nm激光照射下可显著升高细胞内Ca2+浓度,这可能是由于光热效应导致TRPV1通道开放,促进Ca2+内流(图二C&E)。此外,JC-1线粒体膜电位检测结果显示,CMD纳米颗粒在激光照射下可显著降低线粒体膜电位,进而诱导细胞凋亡。CLSM(图二G)和流式细胞仪(图二H)检测结果显示,4T1细胞膜的修饰赋予了CMD强大的同源靶向能力。
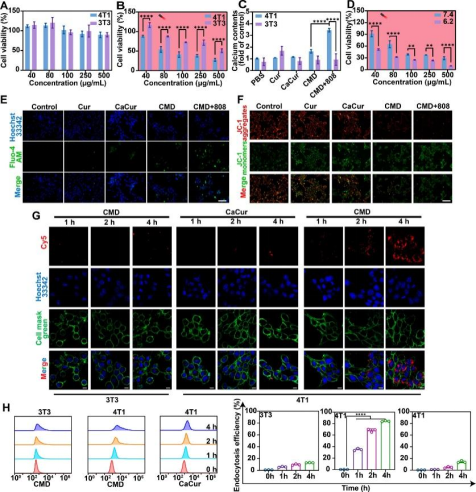
图二:CMD体外钙离子超载作用及同源靶向检测。
在体内,通过小动物活体成像系统对尾静脉注射游离DiR和CMD的小鼠进行了检查,结果显示CMD在小鼠肿瘤部位的聚集显著高于游离DiR,证实了其高效的肿瘤靶向性(图三A-F)。进一步的体内抗肿瘤实验表明,CMD在不对机体各正常组织和器官造成明显伤害的前提下,通过钙离子超载策略实现了对肿瘤生长的抑制,并且在光热治疗进一步实现Ca2+超载和直接杀伤肿瘤细胞的作用下,CMD展现出了强大的肿瘤杀伤能力并实现了肿瘤的明显消除(图四B-E)。且组织学分析显示肿瘤细胞凋亡显著,其他主要器官未见明显损伤,表明CMD纳米药物递送系统在体内具有高效抗肿瘤作用及良好的生物安全性(图四F-H)。
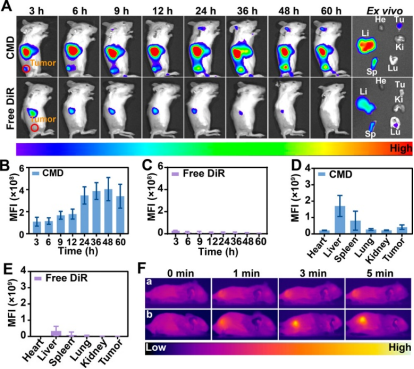
图三:CMD体内同源靶向实验。
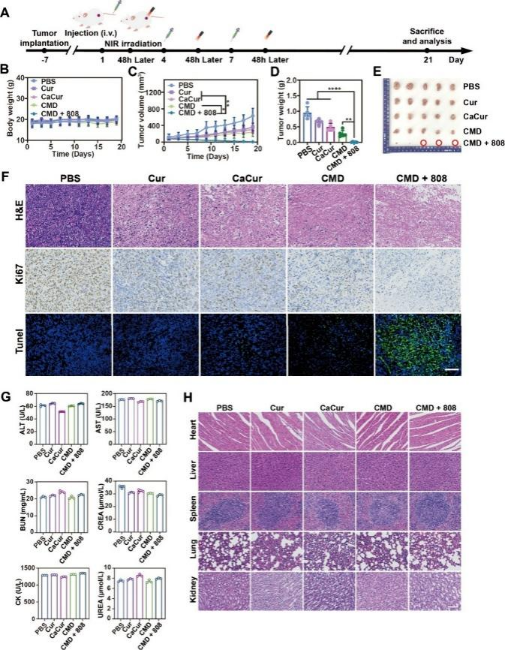
图四:CMD体内抗肿瘤效果,免疫荧光检测、血液生化分析及组织切片。
本文要点:
1.本研究通过三重Ca2+超载策略实现肿瘤细胞内Ca2+显著和持续的超载。荧光染料DiR在808 nm的激光照射下可以激活TRPV1通道,促进细胞外Ca2+内流;Cur是一种天然多酚化合物,可以通过促进内质网中Ca2+释放到细胞质中,并抑制细胞质中的Ca2+通过质膜上的Ca2+通道将Ca2+外排到细胞外空间,从而实现Ca2+超载;碳酸钙能够响应肿瘤微酸性微环境实现降解,并释放出大量的外源性Ca2+引起细胞内Ca2+超载。
2.本研究通过共同超声将癌细胞膜包被在载有Cur的无定形碳酸钙上,实现了纳米颗粒的仿生伪装。纳米颗粒借助癌细胞膜固有的同源靶向能力和逃避免疫清除能力,可以通过主动靶向和逃避免疫细胞清除来增加肿瘤部位的递送效率,显著提升了其在肿瘤组织中的靶向性和滞留时间,提高了纳米颗粒的肿瘤治疗效果。
原文链接:
https://pubs.acs.org/doi/10.1021/acsmaterialslett.5c00461
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#肿瘤治疗# #Ca²⁺超载#
20 举报