311例胰腺导管腺癌液体活检:转移性 vs 局限性阳性率差异大,可用药突变检出率超五成
2025-07-12 苏州绘真医学 苏州绘真医学 发表于上海
单中心研究显示,液体活检在胰腺导管腺癌中,转移性病例阳性率 81.2%,局限性 52.4%,转移性中 KRAS 突变与更差生存期相关,且可检出治疗靶向突变。
液体活检(LB)在胰腺导管腺癌(PDAC)中的临床应用价值尚未得到充分研究。本单中心纳入311例PDAC患者,进行非肿瘤组织先验(non-tumor tissue informed )液体活检检测,结果显示:转移性病例中液体活检阳性率为81.2%(N=186),局限性病例中为52.4%(N=43)。在转移性病例中,KRAS突变检出率为64.6%(N=148),而局限性病例中为16%(N=13)。液体活检阳性(尤其是检出KRAS突变)与转移性PDAC患者更差的总生存期(OS)相关(中位生存期14.5个月 vs. 31.3个月,HR=2.7,95%CI=1.7-4.3,P<0.0001)。在接受组织活检的患者亚组中,转移性病例中的KRAS和TP53突变阳性一致性率分别为63%和68%,但在局限性病例中,这一比例分别仅为7%(KRAS)和33%(TP53)。在41例接受系列液体活检的患者中,25%的患者在初始检测阴性后转为阳性。液体活检在58.5%的PDAC患者中检出了可用于治疗的靶向突变,且与总生存期相关。
研究背景
约90%的PDAC存在KRAS突变,其中包括35%的KRAS G12D、30%的KRAS G12V、15%的KRAS G12R以及1-2%的KRAS G12C。KRAS G12C抑制剂在PDAC中显示出疗效,且多种KRAS抑制剂正处于临床研发阶段。研究者此前通过组织检测报告了KRAS突变与PDAC预后的关系,发现该突变与更差的OS相关。液体活检(LB)在PDAC中的应用前景广阔。在术后监测的PDAC患者中,通过肿瘤先验分析(tumor-informed)全外显子测序(WES)检测到的循环肿瘤DNA(ctDNA)阳性率为29.48%。目前,关于非肿瘤组织先验分析的液体活检检测的真实世界数据较少。
研究结果
研究者分析了2018年至2023年在MD安德森癌症中心接受院内非肿瘤组织先验分析ctDNA检测的311例PDAC患者。其中73%(N=229)为转移性疾病。中位随访时间为34.9个月,中位总生存期为22.5个月(95%CI=19.2-25.8)。确诊时的中位年龄为64.9岁。在转移性病例中,液体活检阳性率为81.2%(N=186),在局限性病例中为52.4%(N=43)。在转移性疾病中,KRAS突变检出率为64.6%(N=148),其次是TP53(57.6%,N=132,图1-A)。然而,在局限性疾病中,检出率最高的突变是TP53(28%,N=23),其次是KRAS(16%,N=13)(图1-B)。局限性疾病的中位变异等位基因频率(VAF)显著低于转移性疾病,中位数(四分位距)分别为0.29(0.53)和0.88(3.78)(P<0.001图1-C)。根据OncoKB治疗证据等级分类,在所有受检患者中,液体活检检出可干预突变的比例为58.5%(N=182),其中2级占3.9%(N=12)、3A级占44.1%(N=137)、3B级占4.8%(N=15)、4级占5.8%(N=18)(图1-D)。在接受组织活检的患者亚组(n=116)中,转移性疾病的阳性一致性率为:KRAS突变为63%(n=50/80)、TP53突变为68%(n=43/63)、SMAD4为26%(n=5/19)、CDKN2A为80%(n=8/10)。局限性疾病的阳性一致性率较低,KRAS突变为7%(n=2/27),TP53突变为33%(n=7/21)。
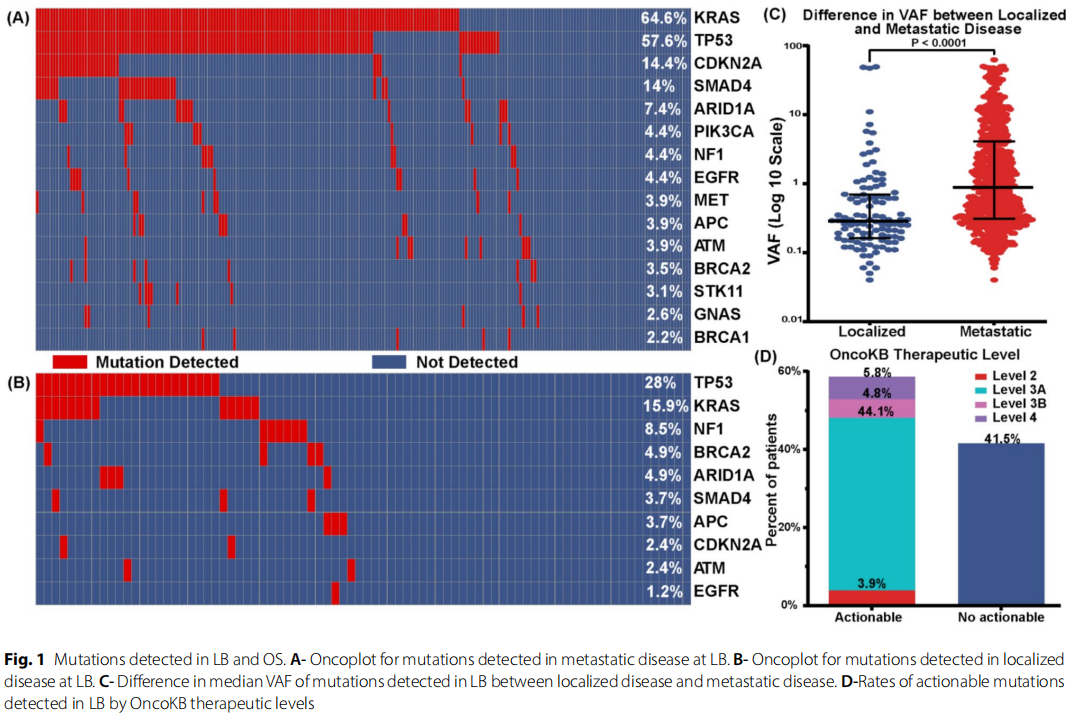
图1
在转移性疾病中,液体活检阳性与更差的OS相关(HR=2.1,95%CI=1.3-3.3,P=0.0015)(图2-A)。而在局限性疾病中,OS的差异无统计学意义(HR=1.3,95%CI=0.72-2.5,P=0.36;图2-B)。对转移性病例OS的单变量COX回归分析显示,KRAS突变(HR=2.8,95%CI=1.9-4,P<0.001)、TP53突变(HR=2.19,95%CI=1.6-3.1,P<0.001)和CDKN2A突变(HR=1.85,95%CI=1.2-2.9,P=0.006)均与更差的OS相关(图2-C-D)。在转移性疾病中,液体活检检出KRAS突变与更差的OS相关(中位生存期14.5个月 vs. 31.3个月,HR=2.7,95%CI=1.7-4.3,P<0.001;图2-E),但在局限性疾病中,OS的差异无统计学意义。值得注意的是,在通过肿瘤组织检测已确认存在KRAS突变的转移性病例中,液体活检检出KRAS突变与更差的OS相关(HR=2.57,95%CI=1.42-4.63,P=0.002;图2-F)。检出频率最高的KRAS突变是KRAS G12D(N=66,41%),其次是KRAS G12V(N=58,36%,图2-G)。在液体活检阳性的患者中,检出KRAS G12D和KRAS Q61突变与更差的OS相关(图2-H),这与研究者此前通过组织检测获得的结果一致。
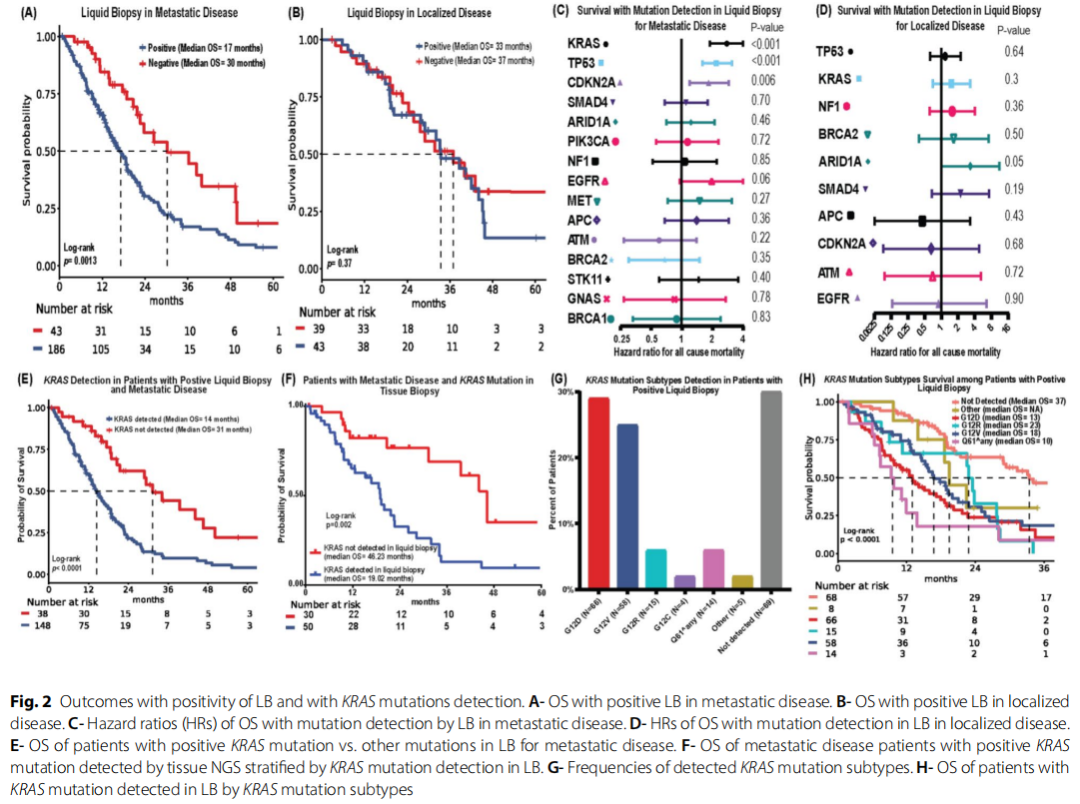
图2
在41例接受多次液体活检的患者中,25%的患者初始ctDNA检测为阴性,随后转为阳性。22例初始检测阳性的患者在后续检测中均未转为阴性。在35例接受系统治疗的患者中,突变检出数量增多的患者(n=16)较突变检出数量减少的患者(n=3)有更差的OS趋势(中位OS为22.9个月vs 26.4个月;HR = 2.1, 95%CI= 0.48-15.02, P = 0.37)。KRAS VAF增加的患者(n=18,中位OS=18.7个月)或TP53 VAF增加的患者(n=13,中位OS=22.9个月),与KRAS VAF减少的患者(n=8,中位OS=44.8个月;HR=2.02,95%CI=0.73-5.59,P=0.18)或TP53 VAF减少的患者(n=4,中位OS=34个月;HR=1.95,95%CI=0.54-7.04,P=0.31,图S2-D-F)相比,有总生存期更差的趋势。
结论
研究者发现,在PDAC的转移性病例中,液体活检阳性率为81.2%(N=186),在局限性病例中为52.4%(N=43)。在转移性疾病患者中,KRAS突变检出率为64.6%(N=148),而在局限性疾病患者中仅为16%(N=13)(图1)。液体活检检出任何突变均与转移性PDAC患者更差的OS相关(图2)。此外,KRAS突变(尤其是KRAS G12D和KRAS Q61)与更差的OS相关(图2)。
参考文献:
Yousef M, Yousef A, Hurd MW, et al. KRAS mutation detection by liquid biopsy for pancreatic ductal adenocarcinoma. J Hematol Oncol. 2025;18(1):44. Published 2025 Apr 17. doi:10.1186/s13045-025-01696-0

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#胰腺导管腺癌# #液体活检#
12 举报