【ASCO教育文集】血液系统癌前状态(MGUS、MBL和CH)的诊断、风险分层、临床意义和管理
7小时前 聊聊血液 聊聊血液 发表于上海
《ASCO Educational Book》近日发表文章,阐述了MGUS、MBL和CH的诊断、风险分层、临床意义和管理。
血液系统癌前状态(Precursor Hematologic Conditions)包括意义未明的单克隆丙种球蛋白病(MGUS)、单克隆B细胞淋巴细胞增多症(MBL)和克隆性造血(CH),它们以浆细胞、淋巴细胞或髓系细胞的克隆性增殖为特征,但尚未达到活动性血液恶性肿瘤的诊断标准,因此被认为是癌前病变。这些癌前病变的诊断通常是在常规实验室检查中偶然发现的,例如,因球蛋白水平升高而诊断为MGUS或冒烟型多发性骨髓瘤(SMM),或因外周血淋巴细胞计数升高而识别出MBL。CH的诊断需要对外周血或骨髓进行下一代测序(NGS),以识别造血细胞中体细胞基因改变的克隆性扩增。流行病学研究表明,这些前驱疾病相对常见,并且随着年龄的增长而增加,50岁以上人群中MGUS的患病率为3%-4%,成人中MBL的患病率为3% - 17%,50岁以上人群中CH的患病率为10%。
评估前驱疾病患者进展为明确疾病的风险对于确定管理策略至关重要。通常,这些患者的进展风险相当低,或者潜伏期相当长,因此目前的标准治疗是观察等待。为了更好地明确患者的进展风险,已经为MGUS/SMM、MBL和CH开发了各种风险分层系统或风险计算器。目前正在进行临床研究,以探讨对进展为活动性血液恶性肿瘤风险最高的患者进行早期干预的作用。
《ASCO Educational Book》近日发表文章,阐述了MGUS、MBL和CH的诊断、风险分层、临床意义和管理。

MGUS和SMM
在浆细胞疾病的谱系中,MGUS和SMM被认为是活动性多发性骨髓瘤的前驱浆细胞疾病(PCD)。MGUS和SMM的特征是存在涉及IgG、IgA、IgM免疫球蛋白重链的单克隆蛋白,或更罕见的IgD或IgE,以及/或异常的血清游离κ或λ轻链(FLC)比值,但没有器官损伤或骨髓瘤定义事件。具体来说,MGUS的定义是单克隆蛋白<3g/dL,克隆性骨髓浆细胞(BMPC)<10%;而SMM的定义是骨髓BMPC受累为10%-59%,血清游离轻链比值<100。在极少数情况下,单克隆丙种球蛋白病不符合活动性多发性骨髓瘤的标准,但会导致影响神经、肾脏或皮肤等器官的临床显著症状,这种情况被称为具有临床意义的单克隆丙种球蛋白病。
流行病学
MGUS在50岁以上人群中的患病率为3%,70岁以上为5%,85岁以上为9%。SMM在40岁以上人群中的患病率为0.5%。通过MGUS亚型分层可以更好地预测患者可能患上的血液恶性肿瘤。非IgM型MGUS可能以每年1%的速度进展为多发性骨髓瘤或淀粉样变性病。然而,IgM型MGUS可能以每年1.5%的速度进展为淋巴浆细胞淋巴瘤(或罕见的IgM型多发性骨髓瘤)。因此,大多数MGUS患者永远不会进展。相比之下,SMM的进展风险更高,根据大型队列研究,其进展风险约为每年10%。然而,准确判断患者是长期处于前驱疾病稳定状态,还是处于进展状态,仍存在挑战。为了评估个体的进展风险,已经开发了多种MGUS和SMM的风险分层系统。
风险分层
MGUS的风险分层包括梅奥模型,该模型根据M蛋白大小、亚型和FLC比值将患者分为不同的风险组(图1)。SMM的风险评估包括PETHEMA风险评分,该评分根据异常免疫表型的BMPC和免疫麻痹不全(immunoparesis)对患者进行分层。梅奥20/2/20 SMM风险模型使用BMPC%>20、M蛋白>2 g/dL和FLC比值>20,将SMM患者分为三组,其在前两年的进展风险范围为6.2%到44.2%。国际骨髓瘤工作组(IMWG)SMM风险评分在2018年梅奥模型的基础上,纳入了荧光原位杂交(FISH)细胞遗传学标记物t(4;14)、t(14;16)、1q获得和13q缺失,以进一步明确患者的进展风险。2018年梅奥模型和IMWG风险评分常用于SMM临床试验设计。但这些分层方法受限于诊断时的一次性测量,没有纳入动态变化。此外主要依赖于肿瘤负荷来确定进展风险,导致识别肿瘤负荷低但会进展的患者较为困难。
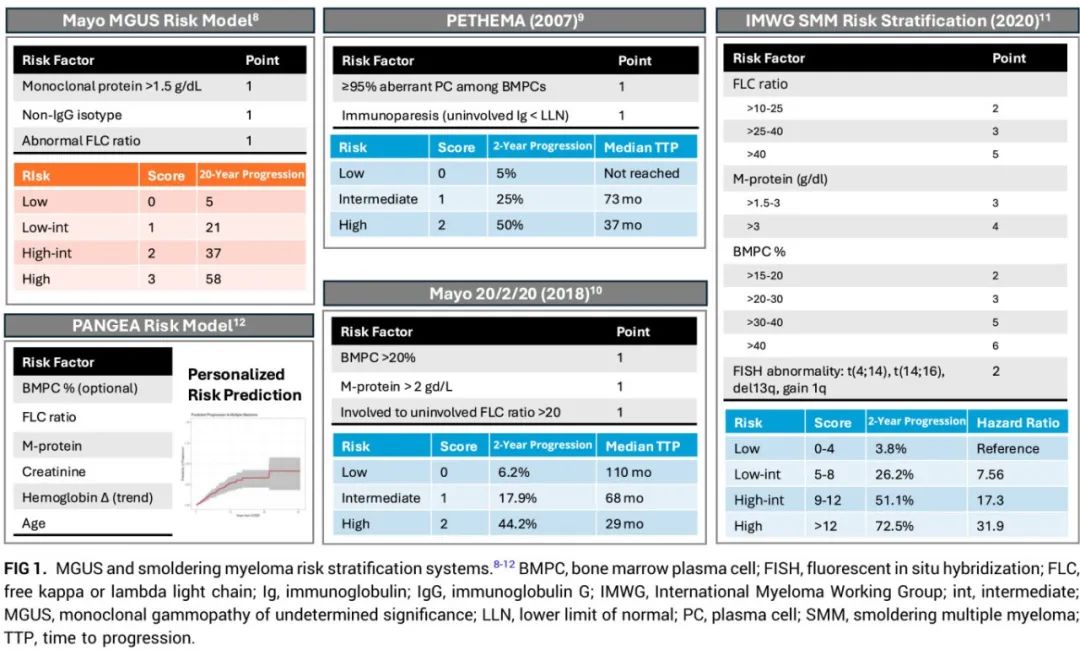
更近期的风险模型旨在提高预测进展风险的准确性。PANGEA(Personalized Progression Prediction in Patients with MGUS or SMM)模型纳入年龄、M蛋白、FLC比值、肌酐、随时间变化的血红蛋白趋势以及BMPC%,尽管BMPC%对于风险预测并非必要。与20/2/20模型相比,PANGEA模型无论是否包含BMPC%,都通过C统计量显示出对进展的更好预测。PANGEA 2.0进一步完善了预测模型,纳入M蛋白、FLC比值和肌酐的动态变化,以及血红蛋白。
肿瘤内在的基因组特征和骨髓微环境也影响MGUS和SMM进展为多发性骨髓瘤的风险。全基因组测序(WGS)研究表明,进展者与非进展者SMM患者的突变特征有显著差异,进展者具有更高的DNA损伤、更高的突变负荷,并且常常存在NRAS、BRAF、FAM46C和ATM等基因的突变。利用MGUS/SMM、正常和多发性骨髓瘤患者的WGS数据,研究人员开发了一种类似多发性骨髓瘤的评分,通过比较多发性骨髓瘤驱动因子(如RAS突变、MYC、1q获得、1p缺失)的数量与MGUS/SMM富集的基因组事件(如MAF和MAFB易位)的数量,该评分与进展为MM的风险增加相关。
筛查
目前不推荐对单克隆丙种球蛋白病进行常规筛查。目前正在进行两项筛查研究。iStopMM研究是一项基于人群的MGUS筛查研究,纳入冰岛≥40岁居民,如果有异常的M蛋白或异常的FLC结果,则被随机分配到三个组别:无接触组、按照当前指南进行监测组、强化随访组,主要终点是评估总生存期。iStopMM研究为浆细胞癌前状态提供了宝贵的见解,包括一个预测MGUS患者骨髓浆细胞(BMPC)>10%可能性的多变量模型,有助于决定是否进行骨髓活检。此外,基于iStopMM队列,还开发了针对慢性肾脏病(CKD)患者和肾功能正常人群的血清游离轻链(FLC)参考范围,该范围根据估算肾小球滤过率(eGFR)和年龄进行调整。回顾性研究报告了与MGUS相关的几种疾病,包括自身免疫性疾病、内分泌疾病、神经病变和肾脏疾病。然而,鉴于MGUS在人群中的高患病率,区分偶然发生与真正的疾病关联非常重要。明尼苏达州奥姆斯特德县的一项基于人群的研究对17398名患者进行了调查,结果显示MGUS与75种先前相关疾病中的14种有显著关联,包括某些神经病变、髋部骨折和骨质疏松症。在iStopMM研究中,与筛查发现的MGUS患者相比,临床诊断的MGUS患者中风湿病、内分泌疾病、血液病、肾脏和肝脏合并症的患病率显著更高,表明之前报告的疾病关联可能存在选择偏差。
PROMISE(Predicting Progression of Developing Myeloma in aHigh-Risk Screened Population)研究在美国开展,旨在建立MGUS和SMM患者的队列,这些患者是非洲裔美国人或有浆细胞疾病(PCD)一级亲属,并确定疾病进展的临床、基因组学、表观遗传学和免疫学预测因子。
新技术的发展进一步提高了我们检测副蛋白和研究浆细胞前驱疾病基因组学及免疫学特征的能力。在PROMISE队列中应用基质辅助激光解吸电离-飞行时间质谱法,能够在免疫固定检测水平以下(<0.2 g/dL)检测到单克隆丙种球蛋白病,这种病称为单克隆丙种球蛋白病潜能未定(monoclonal gammopathy of indeterminate potential ,MGIP),在高危个体中占11%,与死亡率增加和合并症的可能性增加有关。然而,MGIP进展为其他浆细胞疾病的潜力尚未明确,需要进一步随访。目前,骨髓活检仍然是用于诊断和评估PCD的基因组学及蛋白表达特征的方法;然而这是一种侵入性程序,采样常常不够理想,尤其是在疾病负担较低的情况下,疾病分布呈斑片状。因此,通过外周血采样分离循环肿瘤细胞(CTC)作为一种较少侵入性的方法,可以避免骨髓采样的常见挑战,从而获得有价值的信息。MinimuMM-seq是一种用于分离CTC的技术,可与全基因组测序(WGS)相结合,显示出CTC和BMPC基因组特征之间高度一致。
监测和管理
前驱PCD的管理标准为密切观察,MGUS患者每6-12个月随访一次,SMM患者每3-6个月随访一次。按照目前的标准,干预通常用于发展为符合活动性骨髓瘤的器官损伤的患者。活动性MM的治疗取得了显著进展,出现了许多新药,包括单克隆抗体、蛋白酶体抑制剂和免疫调节剂。这些联合疗法不仅显著改善了治疗效果,而且耐受性良好,允许持续治疗直至疾病进展。对于复发和难治性骨髓瘤患者,T细胞重定向疗法,包括CAR-T细胞和双特异性抗体已获批准,显示出前所未有的反应深度和改善的生存率。因此,这些疗法目前正在早期疾病状态下进行研究,包括新诊断多发性骨髓瘤。
在高危SMM中进行早期干预的研究很多,目标是预防明显的骨髓瘤及其相关的发病率。以往的三期试验显示,来那度胺联合地塞米松与观察相比,可改善无进展生存期(PFS)。最近,三期AQUIILA试验研究了在高危SMM中使用单药达雷妥尤单抗与积极监测相比;达雷妥尤单抗使用3年,总缓解率为63.5%,完全缓解率为8.8%,5年PFS率为63.1%。重要的是,早期使用达雷妥尤单抗干预也观察到总生存期的获益。
然而,由于在MM治疗中使用三药和四药疗法相比两药疗法具有更强的疗效,因此仍存在一个问题:在SMM中使用联合方案是否能获得更好的缓解率、改善缓解深度,甚至实现治愈。因此正在进行和以往开展的使用这些联合疗法的研究均显示出有希望的疗效。
最后,T细胞重定向疗法在复发难治性MM中显示出巨大的益处,目前正在进行的研究正在评估这些药物在高危SMM中的作用。这尤其值得研究,因为癌前状态下免疫系统功能更为健全,这些疗法的疗效可能会进一步增强。初步结果显示,在这一高危患者人群中,微小残留病(MRD)阴性率很高。但还需要更长时间的随访和随机研究,以全面评估这些新疗法在SMM中的疗效、持久性和安全性,从而更好地权衡长期获益与潜在毒性。
MBL
MBL是一种癌前状态,其特征是外周血中存在克隆性B细胞。MBL在20世纪90年代报道,当时一系列在危险废物场所附近的横断面环境健康研究发现了40岁以上成人中表达CD5和CD19的MBL病例。MBL的诊断现在需要在没有血细胞减少症、淋巴结病或可归因于克隆性B细胞的器官受累(这些指标用于SLL/CLL的诊断)的情况下,存在少于5×10⁹个/L的单克隆B细胞克隆。因此,MBL通常是在其他健康且无症状的成年人的常规血液检查中偶然诊断出来的。
流行病学
美国和欧洲的研究估计,成人中MBL的患病率为3%-17%。发病率报告的差异至少部分是由于不同研究中使用的诊断检测的灵敏度不同。使用多色流式细胞术可以提高灵敏度,并能够检测到更小的B细胞群体。
多个因素与MBL的发病风险增加有关。与CLL一样,年龄是MBL发病的最强风险因素之一。几项基于人群的研究表明,随着年龄的增长,任何亚型的MBL的患病率都会增加。例如,在一项研究中,40-59岁成年人中MBL的患病率为2.1%,而60-89岁成年人中为5.0%。另一项基于意大利的人群研究显示,40-49岁成年人中MBL的患病率为6%,50-59岁成年人中为19%,60-69岁成年人中为37%。MBL在男性中更为常见。与CLL类似,遗传易感性在MBL的发病和发病机制中起着重要作用。在有CLL患者的家庭中,MBL的患病率会增加。在一项针对CLL患者家庭的前瞻性研究中,一级亲属(占研究人群的92%)和二级亲属中MBL的患病率为22%。在另一项英国研究中,CLL家庭中有一例或以上CLL患者的成员中,MBL的检出率为13.5%。其他研究表明,在40岁以上的成人中,MBL的患病率为17%-18%,他们是一级亲属中的CLL患者。年龄和性别在家族性病例中MBL的发病风险中仍起着重要作用,到90岁时发展为MBL的概率为61%。在有偶发CLL的家族中,MBL的风险也会增加,因为一项研究报告称,在40岁以上的成人(散发性 CLL 患者的一级亲属)中,MBL的患病率为15.6%。在有偶发性和家族性CLL的家族中,MBL的相似患病率表明,克隆性B细胞扩增的风险增加不仅限于家族性病例,任何一级亲属中有CLL病史都可能与MBL的风险有关。一些已知与CLL易感性相关的单核苷酸多态性也在MBL中被发现。最后,人群和数据库研究将肺炎感染与MBL风险增加联系起来,而肺炎和流感疫苗接种与MBL风险降低有关。需要进一步的数据来了解这些变量之间的关系。
诊断和分类
MBL通常是在常规血液检查、评估其他疾病或轻度淋巴细胞增多的检查中偶然诊断出来的。Marti等人提出的诊断标准要求在外周血中检测到单克隆B细胞群体,总体κ:λ游离轻链比值>3:1或<3:1,或>25%的B细胞缺乏或表达低水平的表面免疫球蛋白或疾病特异性免疫表型。这些克隆必须在3个月的时间内持续存在。这些标准排除了患者有淋巴结病、器官肿大、自身免疫/感染性疾病、B淋巴细胞计数>5×10⁹/L,或其他诊断为B淋巴增殖性疾病的特征的情况。通过流式细胞术分析确认克隆性B淋巴细胞的持续存在,并表达CD19、CD5和CD23,以及CD20、CD79b、FMC7和表面免疫球蛋白的弱表达,可以确认诊断。如果B细胞淋巴细胞增多与血细胞减少症或淋巴结病有关,则诊断为CLL/SLL,而非MBL。
基于免疫表型特征可以将MBL进一步分类。CLL样表型MBL的特征是典型的CLL表型,即CD5阳性、CD23阳性,以及CD20、CD79b和表面免疫球蛋白的弱表达。典型的CLL样表型是MBL中最常见的表型。非典型CLL样表型MBL也有CD5和CD23表达,但与典型的CLL样表型相比,CD20强表达。非CLL样MBL的特征是CD20和CD79b以及表面免疫球蛋白的强表达,CD5表达阴性,CD23表达可变。WHO诊断标准的第五版列出MBL的三种亚型,总结于BOX1。组织学MBL通常是CLL样单克隆B细胞浸润的偶然淋巴结发现,没有增殖中心,也没有淋巴结病或器官肿大,通常伴有外周血中MBL。

人群和临床研究发现,在CLL样MBL病例中,绝对淋巴细胞计数呈双峰分布:<0.5×10⁹/L和>0.5×10⁹/L。尽管表型相似,但低计数MBL(<0.5×10⁹/L)具有更多的克隆内异质性,并且通常与良好的预后特征有关。大多数病例(70%)具有突变的免疫球蛋白重链可变区(IGHV),很少有表达CLL特异性立体型IGHV序列,表明许多低计数MBL病例并不一定代表CLL的前白血病阶段。高计数MBL在生物学上更类似于CLL;然而与0期CLL相比,其具有更高危遗传特征(包括del11q、del17p和TP53突变)的患病率较低。尽管IGHV同源性在高计数MBL和0期CLL之间相似,但高计数MBL的淋巴细胞增加显著较低,与0期CLL相比治疗时间更长。
预后和临床意义
绝对淋巴细胞计数<1-2×10⁹/L的MBL患者很少出现进行性淋巴细胞增多,很少需要任何CLL治疗。除了来自高危CLL家族的患者外,进展风险与高计数MBL相似;高计数MBL以每年1%的速度进展为CLL;更高的淋巴细胞计数与进展为CLL的更高风险有关。在CLL中研究了表观遗传学特征,以评估进展风险和治疗时间。Abdelbaki等人将这些表型应用于MBL个体,并确定高风险免疫球蛋白表观遗传学λ轻链可变3 - 21重排特征(ELCLV3 - 21)是中等表型患者的负面预后工具,独立于其他预后值,如IGHV突变状态。与CLL中ELCLV3 - 21低危个体相比,MBL中ELCLV3 - 21高危个体的至治疗时间和总生存期明显更短。
高计数MBL与感染风险增加、因感染住院以及对疫苗接种反应不佳有关。尽管其病程缓慢,进展为CLL的风险较低,但低计数MBL在前瞻性队列中与感染发病率更高有关,8年感染发病率为23%,而健康对照组为11%。MBL患者还面临患恶性肿瘤的风险增加。一项大型队列研究发现,低计数和高计数MBL患者患血液恶性肿瘤的发病率都有所增加。高计数MBL还与患非血液恶性肿瘤的风险更高有关。
监测
MBL的管理通常需要个体化考虑。具有CLL样高计数MBL的个体应监测进行性淋巴细胞增多、淋巴结病、血细胞减少症或自身免疫性疾病,这些可能表明CLL的进展和可能需要治疗;可以通过每6个月至1年进行一次常规病史、体格检查和外周血细胞计数来完成。可根据需要进行影像学检查,但不常规用于监测。低计数MBL患者可以通过血液学家或初级保健提供者每年进行一次血液计数来监测。如果家族中有家族性CLL病史,测试和监测的频率可能需要增加。所有MBL患者都应遵循与年龄相关的癌症筛查指南,并接受与年龄相关的疫苗接种。对于非典型或非CLL样MBL患者,建议初步检查包括FISH(包括t[11:14]/CCND1重排)和横断面成像,以评估淋巴结病,以排除套细胞淋巴瘤、边缘区淋巴瘤或其他非霍奇金淋巴瘤。这些并非基于强有力的证据,病例应在个体化的基础上进行治疗。
潜能未定的CH
CH指在没有已知血液恶性肿瘤的个体中可检测到的获得性体细胞突变。潜能未定的克隆性造血(CHIP)通常定义为在外周血或骨髓中存在获得性突变,这些突变通常发生在髓系驱动基因中,变异等位基因频率(VAF)≥2%,并且没有血液恶性肿瘤,也没有任何血细胞减少症。CH突变发生在细胞层级结构中的早期祖细胞中,因此髓系和淋巴系细胞都携带这些突变。根据使用的测序深度,CH在现有文献中的患病率有所不同。早期在大型人群数据集中使用全基因组测序(WGS)或全外显子测序的研究显示,50岁以上个体的患病率约为10%,但随着测序深度的增加,老年人的估计患病率达到25%。随着年龄的增长,CH的患病率更高,且在生物学男性、吸烟者、具有生殖细胞倾向状态以及接受过化疗/放疗的个体中更为常见。相比之下,WHO定义的意义未明的克隆性血细胞减少症(CCUS)指在髓系驱动基因中存在VAF≥2%的突变(或在男性中X连锁基因突变为≥4%),加上持续的血细胞减少症(>4个月),并且不符合髓系肿瘤(MN)的诊断标准。
CH中最常见的突变始于参与表观遗传修饰的基因,例如DNMT3A、TET2和ASXL1,其他突变则作为后期获得性突变,有时会导致MN。从CHIP进展到MN的风险估计为每年1%,而CCUS患者的进展风险通常在10年内约为80%。基因组不稳定性以及随后获得的额外突变和协同异常随时间积累,导致MN风险增加。特别是当TET2存在时,CH还会增加心血管风险和死亡率,这是由于加速的动脉粥样硬化,其还与心力衰竭(射血分数保留型)、心肌梗死、房颤和缺血性中风有关。此外,CH还与多种慢性疾病的发生有关,包括实体瘤风险和死亡率、自身免疫性疾病、骨质疏松症和CKD。这些疾病的共同病理生理学可能是炎症性,不仅影响多种慢性疾病,还促进克隆进展。慢性炎症状态促进CH的发展,使具有CH的细胞具有生存优势。此外,CH突变可以诱导炎症体复合体NLRP3的信号传导。在体外模型和体内研究中,已经证明在促炎条件下,携带CH突变的细胞具有生长优势,这些研究显示,携带CH突变的个体中促炎细胞因子(如IL - 6、IL - 1β、TNF - α、IL - 18等)水平增加。此外,在TET2和DNMT3A基因敲除小鼠中抑制促炎信号传导,可以逆转白血病前期增殖。
CH是de novo MN的风险因素
多项人群研究已经确定了进展为髓系恶性肿瘤的突变特异性差异风险,其中TP53、IDH1/IDH2、剪接体突变以及DNMT3A和TET2突变的风险最高。此外,在 AML/骨髓增生异常综合征 (MDS) 发生之前,通常会观察到连续随访中的扩增克隆以及获得性突变复杂性,追踪这些克隆突变具有巨大的临床和研究意义。在没有克隆生长的额外压力(如化疗)的健康个体中,总体生长率估计为每年5%,一些研究表明中位倍增时间为7年。然而,某些突变(如TET2、ASXL1、PPM1D和SF3B1)通常每年的生长率约为10%,最高生长率出现在携带SRSF2、PTPN11和U2AF1突变的个体中。已知 TET2 在生命后期存在与衰老相关的扩增,而DNMT3A突变通常在个体一生中保持不变。
预测CH和CCUS患者的MN风险
在实践中,不建议在健康且没有已知血细胞减少症的个体中筛查这些突变。在实践中,大多数患者通常是在血细胞减少症和MDS的检查过程中发现的,或者在实体瘤的血液生殖细胞检测中发现。目前,一些机构已经设立了CHIP诊所,专门用于监测未来髓系肿瘤的风险,并可能进行早期干预。由于预测未来风险具有临床价值,因此已经开发了几种评分系统。在目前使用的三个评分系统中,MN预测计算器和CHRS(CH Risk Score)计算器是基于相对健康的人群数据集。CHRS计算器使用年龄、特定突变、VAF、CBC参数(RDW和MCV)以及血细胞减少症的存在/缺失来预测进展(低、中、高)。MN预测计算器除了血液和突变参数外,还包括某些血清化学变量(包括胆固醇、维生素D等),并给出个体化的多种MN的累积风险评分。除了这两个评分系统外,克隆性血细胞减少症风险评分也可用,该评分源自基于医院的多机构数据集,纳入血小板计数、突变类型(剪接体)和突变数量,以专门预测从CCUS到MDS/AML的进展,将患者分为低、中、高危,髓系肿瘤的2年累积发病率为6.4%、14.1%和37.2%。需要注意的是,这些预测评分不适用于有其他恶性肿瘤病史或可能接受过化疗/放疗的患者,因为这些评分通常是从非癌症人群中得出的。尽管如此,这些评分系统还是可以帮助医生向患者告知风险,从而减轻不必要的随访,并且可能有助于仅在极高危人群中指导早期干预工作。
除了这些评分标准外,其他生物学过程也会改变克隆动态,并可能影响进展风险。尽管CH突变是单核苷酸变异,但镶嵌性染色体异常(mCAs)是较大的结构变异,可能与大约16%的CH参与者共同发生,尤其是在具有TP53、TET2、JAK2、SF3B1和U2AF1突变的克隆复杂和高VAF CH中。与单独存在mCA和CH相比,mCAs已知与髓系恶性肿瘤的风险更高。炎症细胞因子也有涉及。最近的数据还表明,某些血浆蛋白质组学可以增强对髓系癌症风险的预测评分。此外,表观遗传老化和端粒长度也可以改变CH突变的生长速度。
CH是治疗相关MN的风险因素
CH增加治疗相关MN的风险,因为化疗和放疗作为应激因素会导致预先存在的CH扩增,并且可能通过其他生物学过程进一步改变,包括生殖细胞风险、免疫失调和潜在炎症。一些研究估计,在随访10年后,CH患者的t-MN累积发病率为29%,而没有CH的患者为0%,其中接受自体移植的患者风险最高,这可能是由于累积暴露以及在自体移植后骨髓环境中突变CH干细胞的生长优势。
由于TP53和PPM1D突变通常在t-MN中富集(分别为50%和20%),因此在患有恶性肿瘤的患者中发现的TP53和PPM1D CH具有重要意义。TP53克隆通常在化疗前就存在,然后扩增,最常见的进展途径是获得额外的体细胞拷贝数变异。与TP53不同,PPM1D突变通常在t-MN肿瘤块中保持较低的VAF,并且通常不会在放疗情况下出现。含铂化疗与PPM1D和TP53突变均相关,而PARP抑制剂的使用与TP53突变t-MN风险增加有关。对于开始化疗治疗其他恶性肿瘤之前发现的CH,尚缺乏管理和指导,尤其具有挑战性,因为必须权衡未来髓系恶性肿瘤的风险与治愈当前非髓系治疗的可能性,以及省略某些化疗药物对治愈当前恶性肿瘤的长期影响。
CH和CCUS的治疗
尽管CH和CCUS的当前标准治疗是观察等待,但目前正在进行许多临床试验,大多针对CCUS,旨在预防进展或改善血细胞减少症。其中一些临床试验包括使用canakinumab、罗特西普、IDH抑制剂、抗坏血酸以及他汀类药物和二甲双胍。这些试验旨在利用生物学易感性来靶向炎症(例如canakinumab、他汀类药物)、衰老(二甲双胍)、代谢易感性(TET2 CH中的抗坏血酸)、特定突变靶向(IDH抑制剂),抑或基于早期MDS中观察到的血细胞减少症的改善(例如罗特西普)。这些试验的结果将有助于临床医生了解疾病进展是否可修正,以及在具有临床显著血细胞减少症的患者中改善血细胞减少症是否可行。
未来,创建经过验证的临床算法以进行筛查,包括多模式和多组学进展评分,对于预测个体的绝对风险至关重要。针对个体易感性的治疗是精准预防的重要一步。尽管已经尝试为CH试验建立终点,但这些也需要达成一致并标准化。此外,利用对早期CH事件的知识也将有助于更好地理解晚期疾病,如MDS和AML,因为这些是早期启动事件,可能驱动髓系生物学。
总结
血液系统癌前状态(MGUS、MBL和CHIP)相对常见,随着年龄增长而增加,并且各自具有独特的病理生物学特征。在处理患有癌前状态的患者时,关键问题是——患者是否会进展为活动性血液恶性肿瘤?
MBL是B淋巴增殖性疾病的前驱条件,特别是CLL/SLL,可以通过高计数和低计数MBL进行风险分层,显示出较低的进展率,但仍对免疫和感染风险有影响。浆细胞癌前状态MGUS和SMM在进展风险上表现出异质性,从低危MGUS的每年1%或更低到高危SMM的2年内44%。纳入遗传学和动态实验室趋势正在导致更好的风险评估工具。最近,AQUILLA研究在高危SMM患者中显示出总生存期的获益,这为在高危人群中进一步完善早期干预的作用打开了大门。CH是髓系恶性肿瘤的前驱条件,表现出较长的潜伏期,恶性转化受突变类型、VAF、克隆生长以及生物学过程(如衰老、端粒长度、炎症、生殖细胞风险)和外部压力(如化疗和放疗)的影响。风险评分系统已经建立,以基于血细胞减少症和突变来了解个体的风险。目前的标准治疗是观察等待,但许多临床试验正在进行中,以阻止进展或改善细胞减少症。在治疗实体瘤时,如果偶然发现CH,是否省略化疗/放疗的决定也应该是个体化和知情的。
参考文献
Yuxin Liu et al. Precursor Hematologic Conditions: Diagnosis, Risk Stratification, Clinical Implications, and Management. Am Soc Clin Oncol Educ Book 45, e473650(2025). DOI:10.1200/EDBK-25-473650
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#血液系统癌前状态#
3 举报