双相型恶性胸膜间皮瘤对标准治疗反应不一,NGS检出BRAF V600E突变获益靶向治疗
2025-07-19 苏州绘真医学 苏州绘真医学 发表于上海
本病例支持在MPM中进行下一代测序分析,尤其是在观察到新型不一致应答模式的情况下。
恶性胸膜间皮瘤(MPM)的治疗进展一直有限。纳武利尤单抗联合伊匹木单抗的免疫联合疗法是晚期MPM的一线治疗选择,通常用于肉瘤样或双相型MPM患者。本文报告一例双相型MPM患者,其在接受纳武利尤单抗联合伊匹木单抗一线治疗时表现出独特的应答模式:胸膜和纵隔病灶反应迅速,但骨/软组织病灶却快速进展并并发病理性脊髓压迫。进展期骨转移灶的病理检查显示为纯上皮样组织学特征,无任何肉瘤样分化证据。该标本的下一代测序显示存在BRAF V600E突变,患者随后接受达拉非尼联合曲美替尼治疗,所有病灶(包括骨骼)均实现持续的临床和影像学缓解。本病例支持在MPM中进行下一代测序分析,尤其是在观察到新型不一致应答模式的情况下。
背 景
恶性胸膜间皮瘤(MPM)的治疗长期缺乏创新,CheckMate 743三期试验结果促成了免疫检查点抑制剂(ICIs)纳武利尤单抗(抗程序性细胞死亡蛋白-1[抗PD-1])联合伊匹木单抗(抗CTLA4)(nivo/ipi)用于晚期恶性胸膜间皮瘤一线治疗的批准,这是该领域十多年来的首次批准。尽管在所有MPM组织学亚型中均观察到疗效,但在非上皮样组织学中获益最为显著,nivo/ipi组的中位总生存期(OS)为 18.1 个月,而化疗组为 8.8 个月(风险比[HR] = 0.74,95%置信区间[CI]:0.60–0.91)。虽然在非小细胞肺癌等其他肿瘤类型中更常见,但在MPM中很少发现具有有效靶向治疗的可干预驱动突变。本文报告一例晚期双相型MPM患者,对nivo/ipi表现出混合反应:肉瘤样组织学成分完全缓解,而上皮样成分快速进展。对进展后的上皮样标本进行下一代测序(NGS)发现致病性BRAF V600E突变。患者接受达拉非尼联合曲美替尼治疗,截至本报告撰写时疾病持续缓解。
病 例
患者男,56 岁,无既往病史记录,但有明确职业暴露史——作为当地地铁系统隧道检查员有石棉接触史。该患者因咳嗽、腰痛和腹痛首次就诊于急诊科。2023 年 10 月 28 日胸部计算机断层扫描(CT)血管造影显示左侧大量胸腔积液延伸至肺尖,左下叶几乎完全实变,左下叶 6 cm肿块,左肺门 4 cm肿块伴纵隔淋巴结肿大及胸膜结节。2023 年 11 月 9 日,患者接受左侧电视胸腔镜手术,行全肺胸膜剥脱术、纤维蛋白沉积物清除术,并放置胸膜引流管需每日引流。左侧胸膜肿块病理结果显示为恶性上皮性肿瘤,含 70% 梭形细胞和 30% 上皮样细胞成分,符合双相型恶性胸膜间皮瘤(MPM)。2023 年 11 月 29 日后续正电子发射断层扫描成像确认疾病进展,表现为广泛左侧胸膜受累、双侧纵隔淋巴结肿大、肾上腺及散在骨病变(图1A)。
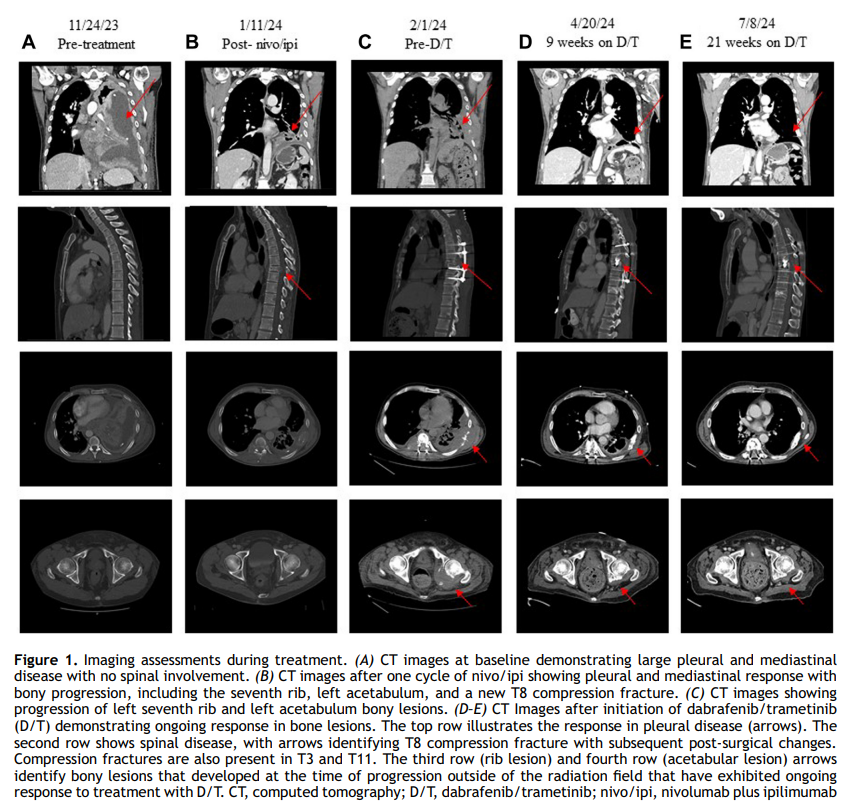
▲图1 治疗期间的影像学评估
患者于 2023 年 12 月 4 日开始接受纳武利尤单抗联合伊匹木单抗(nivo/ipi)免疫检查点抑制剂治疗,胸膜引流量初步改善。完成一个治疗周期后,患者出现腰痛、下肢麻木及无法行走。2024 年 1 月 10 日脊柱磁共振成像显示T8急性压缩性骨折伴脊髓压迫,以及多发新增脊柱转移灶。2024 年 1 月 11 日计算机断层扫描确认大量新增骨转移灶,同时胸膜结节、纵隔淋巴结肿大及胸腔积液几乎消退(图1B和图2)。患者随后于 2024 年 1 月 12 日接受急诊椎板切除术。病理结果显示为符合恶性胸膜间皮瘤上皮样亚型的恶性上皮性肿瘤(未见肉瘤样组织学成分)。2024 年 1 月 25 日,患者出现T3节段复发性恶性脊髓压迫,需再次行椎板切除术。2024年2月1日术后复查计算机断层扫描显示骨转移病灶负荷加重,包括广泛脊柱、骨盆及肋骨骨转移(图1C)。鉴于疾病进展速度,患者接受了T4-L2节段姑息性放疗及一个周期的卡铂联合培美曲塞化疗(图2)。
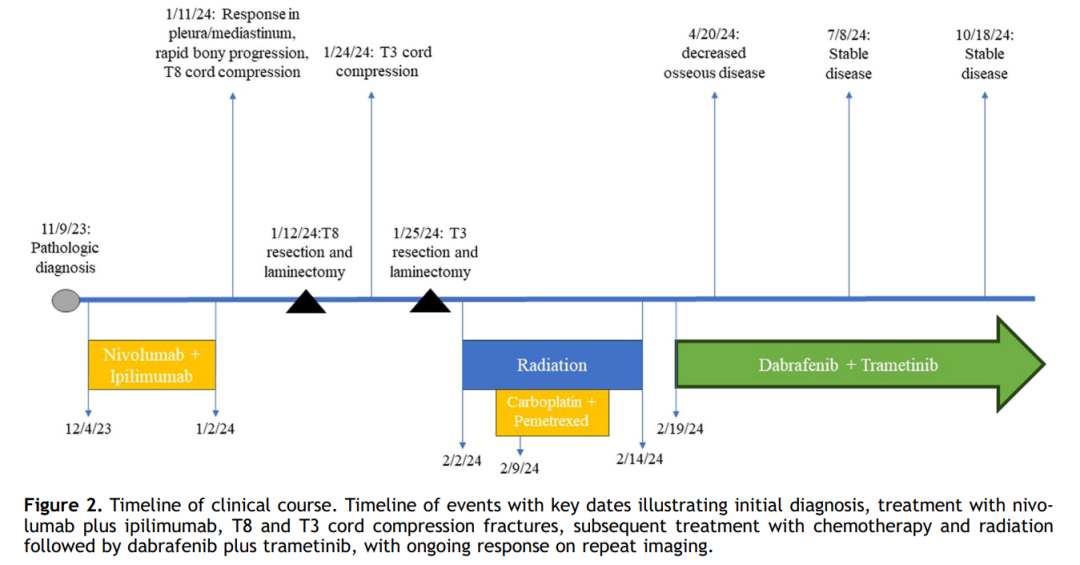
▲图2 临床病程时间线
与此同时,对T8椎板切除术标本的软组织成分进行了下一代测序(NGS)检测,发现致病性BRAF V600E突变。鉴于患者疾病快速进展且功能状态下降,加之BRAF V600E靶向治疗可能带来的快速应答潜力,决定放弃进一步的含铂双药化疗,并于 2024 年 2 月 19 日开始达拉非尼联合曲美替尼治疗。2024 年 4 月 20 日至 2024 年 10 月 18 日的监测影像学检查显示骨转移病灶改善且疾病持续控制,截至本病例提交时未报告疾病进展(图1D、E及图2)。
讨 论
本文描述了一例双相型恶性胸膜间皮瘤(MPM)对免疫检查点抑制剂(ICI)治疗表现出不一致反应的病例。据我们所知,这是首例展示对ICI治疗极端差异性反应模式的病例:进展的上皮样MPM成分中随后检测出致病性BRAF V600E突变(诊断时未行NGS检测),且对达拉非尼/曲美替尼靶向治疗产生持久应答。
双相型MPM对ICI的反应模式数据有限。在CheckMate 743试验中,患者按疾病组织学类型(上皮样 vs 非上皮样)分层。非上皮样亚组似乎从ICI中获益更显著,总生存期(OS)风险比(HR)为 0.46(95%置信区间[CI]:0.31-0.68),而上皮样亚组OS HR为 0.86(95%CI:0.69-1.08)。本研究中双相型与肉瘤样组织学的OS和应答结局尚不明确。在本文病例中,观察到肉瘤样病灶对ICI反应良好,而上皮样病灶进展迅速。患者ICI治疗后的手术切除标本支持这一点——在所有进展部位均未发现肉瘤样组织学成分,仅见上皮样成分。
EGFR及其下游突变(包括KRAS和BRAF)在MPM中罕见但确实存在。针对这些突变的靶向治疗已在其他肿瘤中获批。一项研究在 77 例MPM组织学样本中发现 12% 存在EGFR及下游突变。其中BRAF V600E突变占 3.9%。MPM中更常见的突变包括BAP1、CDKN2A、NF2和MTAP。尽管其中一些变异的靶向治疗正在临床试验中研究,但目前尚无专门批准用于MPM的靶向治疗。
BRAF V600E改变已在多种肿瘤类型中被发现。NCI-MATCH篮子试验(子方案H)纳入BRAF V600E突变肿瘤患者,前瞻性给予达拉非尼/曲美替尼治疗。跨肿瘤类型观察到应答,客观缓解率为 38%。这些结果促成达拉非尼/曲美替尼获批用于BRAF V600E突变实体瘤(不限癌种)。此前有一例报告讨论了 1 例BRAF V600E突变MPM患者接受维莫非尼治疗并应答,但应答持续时间短暂(12 周)。本文病例同样报告了对靶向治疗的快速应答,但疾病控制持续超过 35 周,这可能与本病例使用BRAF/MEK联合治疗而非此前报告中的靶向BRAF单药治疗有关。
本病例突出了双相型MPM对一线ICI治疗的独特反应模式,并强调了NGS检测可用于治疗决策的可能场景。本研究的一个局限性是治疗开始前未行NGS检测,目前尚不清楚观察到的BRAF改变是新发(可能性更大)还是在ICI耐药情况下获得的。
本病例展示了双相型MPM对ICI的新型不一致反应,并强调了NGS在确定有效治疗策略中的潜在价值。未来需要进一步研究双相型与肉瘤样MPM对ICI的差异反应模式,这可能为这些患者的治疗决策提供更多帮助。
我司实体瘤全外显子组基因检测、实体瘤1299基因检测、实体瘤272基因检测PLUS版(NGS方法学),均涵盖BRAF基因,预测可能获益的靶向、免疫及化疗药物,评估肿瘤遗传风险。
基因
参考文献:
Wilkins O, Omogbehin A, Bergquist PJ, Kim C, Liu SV, Reuss JE. Discordant Response to Nivolumab Plus Ipilimumab and Identification of BRAF V600E Mutation in Biphasic Malignant Pleural Mesothelioma: Case Report. JTO Clin Res Rep. 2025 Feb 28;6(5):100820. doi: 10.1016/j.jtocrr.2025.100820. PMID: 40225956; PMCID: PMC11986214.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言



















#恶性胸膜间皮瘤# #MPM#
4 举报