Neuron:我国科学家发现小鼠脑出血在单细胞分辨率下的时空转录组图谱
2025-07-24 Selene MedSci原创 发表于上海
脑出血是一种死亡率很高的流行疾病。这项研究在 ICH 后生成了小鼠大脑的单细胞分辨率时空转录组图谱,促进了对脑细胞对脑出血后损伤的局部和整体反应的理解。
脑出血(ICH)是中风的一种,死亡率高达 50%。ICH患者的预后往往不利。这主要归因于响应ICH而发生的原发性和继发性损伤机制之间错综复杂的相互作用。
脑出血引起的脑组织损伤是一个多方面的过程,包括初始出血、血肿扩张、脑水肿和损伤相关事件。小胶质细胞 (MGL) 的即时反应有助于破坏血脑屏障 (BBB),引发脑水肿的发展。神经炎症和免疫反应的持续性决定了继发性脑损伤的严重程度,进而对 ICH 患者的预后产生不利影响。激活的 MGL 释放的促炎介质招募并激活外周免疫细胞,导致一系列炎症反应。这些早期炎症反应对于血肿清除至关重要。然而,持续的炎症会损害神经元的存活。除了这些炎症反应外,ICH 还引发内源性保护机制,包括抗炎、抗兴奋、抗氧化和神经营养反应。
目前人们对决定 ICH 预后的血肿周围区域的细胞相互作用知之甚少。空间转录组学是一种强大且公正的工具,能够识别血肿附近以及更偏远的大脑区域的细胞和分子改变。
7月9日,郑州大学王建教授在Neuron(IF=15)在线发表了题为“Spatiotemporal transcriptomic maps of mouse intracerebral hemorrhage at single-cell resolution”的研究,采用了亚细胞分辨率空间转录组学技术Stereo-seq。确定了血肿内部和周围的空间分级基因表达模式,研究结果表明不同细胞类型和空间域的不同分子反应。星形胶质细胞(ACs)早期分泌伤口愈合相关因子,后期与脂质代谢相关的基因高度表达。ICH 诱导纹状体 AC 中潜在神经源性程序的激活和指示休眠神经干细胞在更远端的大脑区域转变为活跃状态的基因的表达。第 7 天后,ICH 诱导了皮层中即刻早期基因 (IEG) 的激活。该研究结果为 ICH 触发的时空病理生理过程提供了新的见解,强调了在该领域持续研究的重要性。

将胶原酶注射到纹状体中诱导小鼠ICH,使用空间转录组学分析,绘制了ICH后3、6和12小时以及第1、3、7、14和28天的区域基因表达图谱。采用 Stereo-seq 在这些切片中捕获亚细胞水平的转录本。本研究分析了 26 种主要细胞类型和 100 个衍生亚类,促进了对 ICH 诱导脑损伤细胞景观的理解。这种详细的时空分析为非物质遗症引起的损伤机制和相关基因提供了新的见解,这将有助于开发针对特定病理或再生过程的新治疗方法。
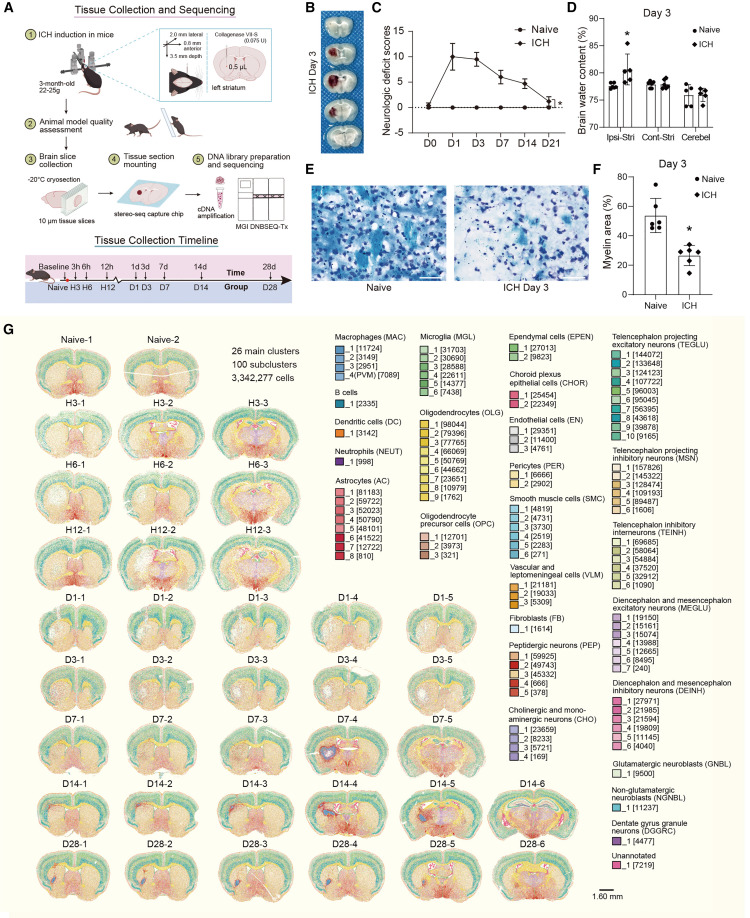
图1.小鼠ICH在单细胞分辨率下的时空转录组图谱
研究表征了病变和周围组织,确定了 ICH 后多个时间点的广泛细胞及其分子反应。前三天观察到病变区域存在兴奋性神经元,高浓度的谷氨酸可能诱导编码谷氨酸转运蛋白 (Slc17a7) 的基因表达增加,导致它们被注释为兴奋性神经元,病变附近观察到少量干细胞相关细胞类型,包括 OPC、非谷氨酸能神经母细胞和 EPEN,表明环境适度再生。OLGs在7天后重新填充病灶周围区域,并随着时间的推移持续存在,这与病灶周围髓鞘的修复有关。从第 7 天到第 28 天,病变区域几乎完全没有神经元,这凸显了由于神经元丢失和 ICH 后神经元网络再生能力有限而带来的挑战。
该研究确定了一系列复杂的过程,包括编码警报素分子的基因的早期高表达、伤口愈合因子的分泌、外周免疫细胞的募集以及ICH病变内各种细胞类型的增殖。这些过程随后是血肿吞噬作用、细胞外基质产生以及 ICH 后 14 至 28 天之间免疫反应的变化。后期的特征是抗原呈递、免疫球蛋白产生和B细胞活化,以及脂质积累和泡沫细胞的形成。鉴于泡沫细胞会导致慢性炎症环境,靶向泡沫细胞或防止脂质超载可以帮助 ICH 后的大脑修复和恢复。炎症环境促进了各种脂质过氧化途径,增加了低密度脂蛋白氧化的可能性,随后诱导了 B 细胞活化。
研究表明,抗氧化基因Gpx1和Selenop在病灶核心内的免疫细胞中表达,这些抗氧化基因的表达可以保护病变附近的细胞免受铁死亡。编码促进病变边界轴突再生和髓鞘修复的蛋白质的几个基因的表达增加,包括Nfasc、Sirt2,CNP和Plxbn3。这一发现表明大脑在导致广泛神经元死亡的损伤后具有自我修复的固有反应。在ICH后第7、14和28天观察到AP-1 / IEG的激活,IEG 的激活调节突触可塑性并促进神经回路重塑,这意味着 ICH 后可能会发生广泛的神经重塑。而衰老过程中的慢性 AP-1 激活会促进人类 tau 蛋白的病理和变性。
AC、MGL 和 OLG 显示激活特征,表现出急性诱导随后衰减的模式。在 ICH 的早期阶段,AC 表现出保护特性;然而,在后期阶段,它们获得了与神经毒性相关的分子特征。值得注意的是,与缺血性中风类似,纹状体 AC 通过激活潜在的神经源性程序来对 ICH 做出反应,从而导致它们转化为神经母细胞。
最后,使用人类死后 ICH 脑组织,证明在实验 ICH 模型和人脑中,AC 都会急性上调Ptx3和Tgm1。相比之下,小鼠和人类之间对ICH有反应的AC中C3表达的时间特征不同,因此人纹状体AC在ICH后的急性期就已经上调了C3,这可能是由于与胶原酶诱导的出血相比,脑动脉破裂引起的组织损伤进展更快。总体而言,本研究中生成的空间转录组数据提供了宝贵的资源,将有助于回答有关脑细胞对 ICH 反应的许多问题。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言



















#脑出血# #脑细胞变化# #时空转录组# #出血后损伤#
11 举报