论文解读|Xunde Xian教授团队揭示ApoL1风险等位基因在高脂饮食诱导的动脉粥样硬化中的加速作用
2025-04-10 Genes and Diseases Genes and Diseases 发表于陕西省
该研究首次揭示了ApoL1风险等位基因G2在高脂饮食诱导的动脉粥样硬化中的加速作用,为理解ApoL1在心血管疾病中的潜在机制提供了新的视角。
Apolipoprotein L1(ApoL1)是一种仅在人类、大猩猩和绿猴中表达的蛋白质,主要由肝脏合成并整合到高密度脂蛋白(HDL)中,在炎症和抗锥虫感染中发挥有益作用。除了中性等位基因ApoL1 G0外,人类还存在两种与肾脏疾病高度相关的ApoL1风险等位基因:ApoL1 G1和ApoL1 G2。尽管已有研究探讨了ApoL1风险等位基因与肾脏疾病的关系,但其与动脉粥样硬化性心血管疾病的关系仍不清楚。以往的研究多使用转基因小鼠模型,但由于小鼠对动脉粥样硬化的抵抗性,这些模型并未用于研究ApoL1与动脉粥样硬化的关系。近年来,研究发现LDLR基因敲除的仓鼠(LDLR−/−)能够模拟家族性高胆固醇血症,为研究人类动脉粥样硬化提供了理想的动物模型。
北京大学的Xunde Xian教授团队在本刊发表了题为“ApoL1 risk allele accelerates high-fat diet-induced atherosclerosis in LDLR−/− hamsters”的研究快讯。该研究首次揭示了ApoL1风险等位基因G2在高脂饮食诱导的动脉粥样硬化中的加速作用,为理解ApoL1在心血管疾病中的潜在机制提供了新的视角。
01 研究方法
研究团队利用基因表达数据库(GEO,GSE40231)分析了冠心病患者动脉粥样硬化和非动脉粥样硬化动脉壁中ApoL1的mRNA表达水平,构建了肝脏特异性腺相关病毒8(AAV8)载体,分别表达ApoL1 G0和ApoL1 G2,并以AAV8-Null作为阴性对照,研究ApoL1在动脉粥样硬化中的作用。实验使用LDLR−/−仓鼠模型,分别在标准饮食和高脂饮食条件下检测ApoL1表达对血脂、肾脏、肝脏和动脉粥样硬化病变的影响。
02 研究结果
ApoL1在冠心病患者动脉粥样硬化动脉壁中显著上调,提示ApoL1可能与动脉粥样硬化心血管疾病相关(图1A)。表达ApoL1 G2的仓鼠在标准饮食条件下表现出更高的血浆总胆固醇、HDL胆固醇和非HDL胆固醇水平,而高脂饮食条件下,ApoL1 G0和ApoL1 G2处理组的血浆总胆固醇和非HDL胆固醇显著降低,且两组间无统计学差异(图1B、D)。组织学分析显示,ApoL1 G0表达导致肾脏中更多的脂质积累和肾小球及系膜面积增加,而ApoL1 G2表达则在肝脏中引起炎症细胞浸润增加、细胞凋亡和CD68表达上调,但不影响纤维化(图1E)。在高脂饮食诱导下,ApoL1 G2处理的仓鼠在主动脉和主动脉根部显示出更多的动脉粥样硬化病变,表现为CD68和单核细胞趋化蛋白1(MCP1)表达增加,而平滑肌肌动蛋白(αSMA)表达减少,表明ApoL1 G2通过增强局部血管炎症促进动脉粥样硬化的发展,且这一过程独立于血浆脂质水平(图1F)。
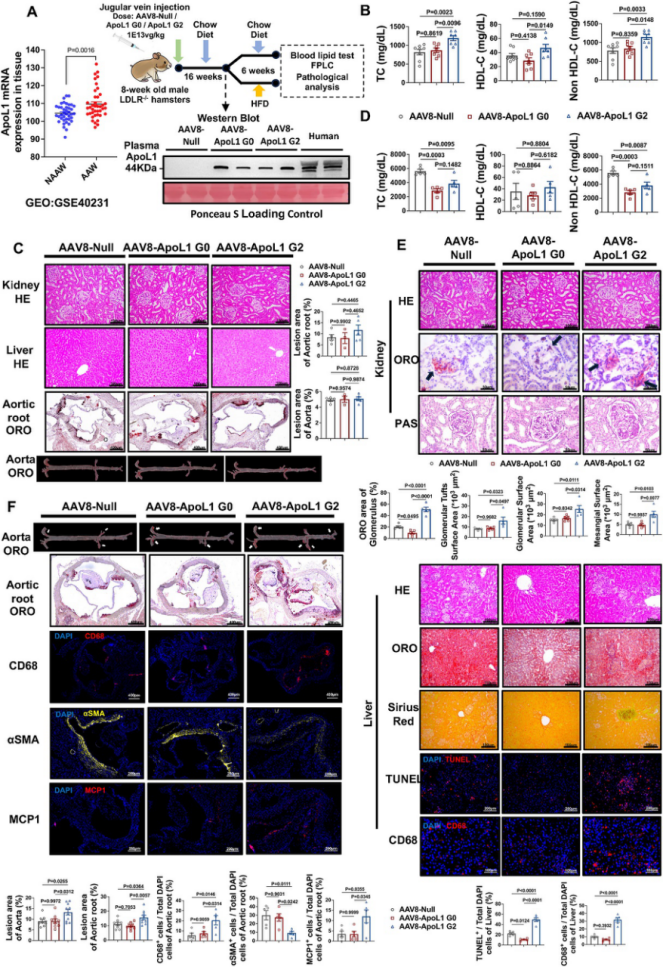
图 1 肝脏ApoL1风险等位基因G2表达对组织稳态和动脉粥样硬化的不利影响
03 研究结论
本研究首次发现,肝脏中表达ApoL1 G2本身对动脉粥样硬化的发展并无直接负面影响;然而,在高脂饮食诱导的高脂血症背景下,ApoL1 G表达显著加剧了饮食诱导的动脉粥样硬化,并伴随肾脏和肝脏损伤。这些结果支持ApoL1风险等位基因在高脂血症背景下增加动脉粥样硬化心血管疾病风险的观点,并提示纠正ApoL1风险等位基因可能是治疗人类动脉粥样硬化的一种潜在方法。
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304224001764
引用这篇文章:
Xu Y, Zhang W, Guo J, et al. ApoL1 risk allele accelerates high-fat diet-induced atherosclerosis in LDLR-/- hamsters. Genes Dis. 2025;12(2):101379.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#动脉粥样硬化# #高脂饮食#
27