Nature:比专家更专业!基于超百万数据的深度学习模型EchoNext,可从心电图中高效、准确识别多种心脏病
13小时前 测序中国 测序中国 发表于上海
研究开发出深度学习模型 EchoNext,用超百万份心律和影像记录训练,能精准检测多种结构性心脏病,性能稳定且优于医生,还公开数据助力研究。
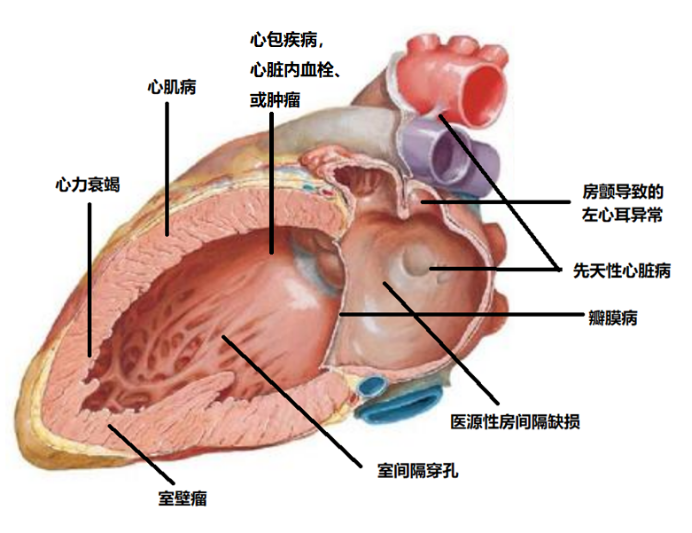
结构性心脏病(SHD)是一种日益增长的流行病,包括瓣膜性心脏病(VHD)、左右心衰竭、肺动脉高压和左心室肥厚等,影响着全球数百万人。尽管早期诊断可降低死亡率、减少成本并改善生活质量,但由于SHD症状不典型或出现较晚,常用传统影像学检测方法(如超声心动图)受成本、专业技能等限制,SHD早期诊断面临严重挑战。结构性心脏病,
近年来,人工智能(AI),特别是深度学习在利用常规十二导联心电图(ECG)检测特定心脏疾病(如主动脉瓣狭窄、心功能不全、心室肥厚)方面展现出潜力。通过将多种相关SHD组合成一个“复合预测目标”,AI-ECG模型可以利用更高的总患病率来提高预测精度且无需额外成本,但现有模型通常存在性能稳定性不足、数据和模型专有性等,难以比较和广泛验证其普适性。
近日,美国纽约长老会医院(NYP)、哥伦比亚大学等研究团队在Nature上发表了一项题为“Detecting structural heart disease from electrocardiograms using AI”文章。研究团队利用大型多样化医疗系统的超100万份心律和影像记录,开发了可检测多种SHD的深度学习模型——EchoNext。该模型在内、外部验证中诊断准确性均较高,在对照评估中表现甚至优于心脏科医生;在不同医疗环境以及不同种族/族裔群体中性能稳定。前瞻性临床试验显示,EchoNext能成功检出未确诊的SHD病例,证实了其在大规模扩大SHD筛查可及性上的潜力。

研究团队采用多中心回顾性队列设计,首先从8家NYP附属医院中收集了2008-2022年间的临床数据,涵盖230,318名患者的1,245,273份ECG-超声心动图配对数据;将数据按患者水平划分为训练集、验证集和测试集。SHD被定义为左心室射血分数降低、中重度瓣膜病变等多种心脏结构病变的复合指标,依据超声心动图结果及临床公认临界值进行判定。

图1. 模型开发:NYP多中心队列推导
基于上述数据集,研究团队训练了卷积神经网络模型EchoNext,该模型结合心电图轨迹与7项标准临床参数(如年龄、心率等)预测SHD。在内部测试集中,EchoNext性能优异且校准良好,AUROC达85.2%、AUPRC达78.5%、诊断比值比12.8。作为多任务模型,EchoNext除预测复合SHD外,还能同时预测每种单独疾病,其中在右心室功能障碍(AUROC 91%)和左心室收缩功能障碍(90%)上表现最佳,而对左心室壁厚度(77%)、主动脉瓣反流(78%)等表现稍弱。
进一步评估显示,EchoNext在不同医院、不同临床场景(急诊、住院、门诊)及不同种族/族裔、性别患者中表现稳定,无显著性能差异,仅在年轻人群中识别能力略优,体现了其广泛适用性。
外部验证于三家独立医疗中心(西达赛奈医学中心、蒙特利尔心脏研究所、加州大学旧金山分校)进行,涉及超27,000名患者。尽管这些机构中SHD患病率更高,模型AUROC仍保持在78–80%,AUPRC 为 77.7%-80.4%,显示出良好的跨中心通用性。

图2. 多任务EchoNext性能
为评估EchoNext模型在真实世界环境中的泛化能力,研究团队将对84,875名未做过超声心动图的患者进行测试。随访发现,18%的患者后续接受了首次超声心动图,其中38%新诊断为SHD。在该随访群体中,EchoNext表现稳健,AUROC为 83%、AUPRC为81%;当风险阈值为0.6时,27%被划为高风险,阳性预测值(PPV)为74%、灵敏度53%。特别地,在未接受检查的69,781患者中,模型识别出5%为高风险。
研究团队还比较了EchoNext与心脏科医生检测SHD的性能,使用3,200份ECG进行评估,共有13位医生参加。结果显示,EchoNext的准确性为77.3%、敏感性72.6%、特异性80.7%,且在临床正常与异常ECG上表现一致;而医生准确性为64.0%,在提供AI结果辅助后准确性提升至69.2%,仍低于模型单独性能。
研究团队还开展了一项前瞻性临床试验DISCOVERY,招募了100名无既往心脏影像检查的患者。使用前期模型ValveNet进行分层时,高危组SHD检出率达53%,显著高于中危组(19%)。使用 EchoNext 进行回顾性风险分层时,高危组SHD患病率73%、中危组28%、低危组仅6%,表明该模型风险分层能力更优。

图3. EchoNext在回顾性验证、与心脏病专家比较、临床试验等的性能
最后,为促进领域发展,研究团队公开了一个大型注释ECG数据集,包含36,286名患者(来自哥伦比亚大学欧文医学中心)的10万份ECG,涵盖患者ECG 波形、人口统计学信息、ECG特定表格数据及对应的超声心动图标签。基于此数据训练了一个轻量化模型Columbia mini-model(AUROC 82.0%),并同步发布模型权重与预处理代码,为后续研究提供基准。

图4. 公开数据及迷你模型
综上所述,该研究首次建立能同时检测多种SHD的通用EchoNext模型,突破了传统SHD筛查局限,展现出跨人群、跨场景的稳定检测性能,且准确性优于人类专家。前瞻性验证结果及数据公开举措,为 AI辅助心电图筛查的规模化应用奠定基础,有望推动心血管疾病早期诊断与干预,对改善公共健康具有重要意义。
参考原文:
https://www.nature.com/articles/s41586-025-09227-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#结构性心脏病# #深度学习#
1 举报