【论着】| 放疗中启动了模型体积与自主功能神经关系的研究
2025-01-01 中国癌症杂志 中国癌症杂志 发表于陕西省
本研究通过分析胸部肿瘤患者放疗前后的短程HRV,初步明确放疗对心脏自主神经功能的影响,探索胸部放疗的剂量学因素与心脏AD发生的关系。
[摘要] 背景与目的:晚期癌症患者心脏自主神经功能紊乱(autonomic dysfunction,AD)的发生率为65%~80%,AD导致的头晕、心悸及疲乏等神经衰弱症状,即使充分休息也难以缓解,严重影响患者的生存质量。同时,心血管自主神经系统对心率、心肌功能和心肌血流具有重要调节作用,AD会增加患者心血管疾病的发病率和死亡风险。AD不仅是一种功能状态,而且可能是整体心肌病变的早期标志。研究显示,在调整年龄、性别和心血管危险因素后,先前的辐射暴露与静息心率增高及运动后心率恢复异常等AD表现相关,但是目前放疗对心脏自主神经功能影响的相关研究尚少,具体的损伤效应及损伤发生的剂量阈值尚不明确。本研究通过对比放疗前后的心率变异性(heart rate variability,HRV)分析参数差异,探讨胸部放疗对恶性肿瘤患者心脏自主神经功能的影响,通过对比病例组和对照组间的剂量学差异,探索发生AD的剂量学相关危险因素,为优化放疗方案的剂量分布提供理论依据,以期改善患者的预后和减少并发症的发生。方法:前瞻性收集2023年2月—2023年12月华北理工大学附属医院放疗科收治的行胸部放疗的恶性肿瘤患者。纳入标准:① 经病理学检查证实为恶性肿瘤(肺癌、乳腺癌或食管癌)患者;② 有放疗适应证;③ 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分;④ 心电图、心脏彩超等检查无明显异常;⑤ 患者知情同意并签署同意书。排除标准:① 曾接受过胸部放疗;② 治疗前自觉明显心悸、胸闷和胸痛的患者;③ 合并糖尿病、心脏病等严重基础疾病;④ 目前正在使用抗心律失常药物;⑤ 不能耐受放疗以及随访过程中失访或脱失者。采用HRV分析评估放疗后自主神经功能的变化情况,将出现AD的患者纳入病例组,其余患者纳入对照组,采用单因素和多因素logistic回归分析方法探索胸部放疗后发生AD的剂量学相关危险因素和心脏限量。本研究经华北理工大学附属医院伦理委员会批准(伦理编号:20230228020)。结果:本研究共收集到符合本研究条件的胸部肿瘤患者89例,其中有41例(46%)患者放疗后发生了心脏AD,病例组心脏最高受照剂量(Dmax)(6 273.500 cGy vs 4 675.900 cGy,P<0.001)、心脏平均受照剂量(Dmean)(1 513.700 cGy vs 452.050 cGy,P<0.001)和心脏受到5 Gy以上剂量照射的体积占心脏总体积的百分比(V5)(49.000% vs 21.250%,P<0.001)、V20(30.500% vs 7.300%,P<0.001)、V30(18.700% vs 3.600%,P<0.001)、V40(10.900% vs 1.500%,P<0.001)明显高于对照组,多因素logistic回归分析结果显示,心脏V30是心脏AD发生的独立危险因素[OR(95% CI)=1.583(1.093~2.291),P=0.015],心脏V30能预测放射性心脏损伤的发生,曲线下面积为0.788,且17.1%是心脏V30预测心脏AD发生的最佳截断值。结论:胸部放疗后,心脏AD患者的心脏照射剂量体积明显高于对照组患者,当心脏V30高于17.1%时,患者发生心脏AD的风险明显升高。
[关键词] 胸部放疗;恶性肿瘤;心脏自主神经功能;心率变异性;心脏损伤
[Abstract] Background and purpose: The incidence of autonomic dysfunction (AD) in patients with advanced cancer is approximately 65%-80%. The neurasthenic symptoms such as dizziness, palpitations and fatigue caused by AD are difficult to alleviate even with sufficient rest, seriously affecting the patients’ quality of life. Meanwhile, the cardiovascular autonomic nervous system plays a significant regulatory role in heart rate, myocardial function and myocardial blood flow. AD increases the morbidity and mortality risk of cardiovascular diseases in patients. AD is not only a functional state but might also be an early sign of overall myocardial lesion. Research indicates that after adjusting for age, gender and cardiovascular risk factors, previous radiation exposure is associated with AD manifestations such as increased resting heart rate and abnormal heart rate recovery after exercise. However, there are currently few relevant studies on the effect of radiotherapy on cardiac autonomic function, and the specific injury effects and dose threshold of injury occurrence remain unclear. This study aimed to explore the impact of thoracic radiotherapy on the cardiac autonomic function of patients with malignant tumors by comparing the differences in heart rate variability (HRV) analysis parameters before and after radiotherapy, and to explore the dosimetric risk factors for the occurrence of AD by comparing the dosimetry between the case group and the control group, providing a theoretical basis for optimizing the dose distribution of radiotherapy regimens in order to improve patient prognosis and reduce the occurrence of complications. Methods: We prospectively collected data of patients with malignant tumors who underwent thoracic radiotherapy in the Radiotherapy Department of the Affiliated Hospital of North China University of Science and Technology from February 2023 to December 2023. Inclusion criteria: ① Patients who were pathologically confirmed to have malignant tumors (lung cancer breast cancer or esophageal cancer); ② patients with radiation therapy indications as recommended by the guidelines; ③ patients with an ECOG score of 0-1; ④ patients with no significant abnormalities in electrocardiogram and echocardiography results. Exclusion criteria: ① previously received chest radiotherapy; ② patients with obvious palpitation, chest tightness and chest pain before treatment; ③ diabetes, heart disease and other serious underlying diseases; ④ anti-arrhythmic drugs are currently being used; ⑤ patients who cannot tolerate radiotherapy and who were lost or lost during follow-up. HRV analysis was used to evaluate changes in autonomic nerve function after radiotherapy. Patients with AD were included in the case group, and the remaining patients were included in the control group. Univariate and multivariate logistic regression analysis methods were used to explore the dosimetric risk factors and cardiac dose limitations for the occurrence of AD after thoracic radiotherapy. This study was approved by the ethics committee of Affiliated Hospital of North China University of Science and Technology (ethics number: 20230228020). Results: A total of 89 patients with thoracic tumors meeting the study criteria were enrolled in the study. Among them, 41 (46%) patients experienced cardiac AD after radiotherapy. The cardiac Dmax (6 273.500 cGy vs 4 675.900 cGy, P<0.001), cardiac Dmean (1513.700 cGy vs 452.050 cGy, P<0.001), cardiac V5 (49.000% vs 21.250%, P<0.001), V20 (30.500% vs 7.300%, P<0.001), V30 (18.700% vs 3.600%, P<0.001) and V40 (10.900% vs 1.500%, P<0.001) were significantly higher in the case group than in the control group. The results of multivariate logistic regression analysis showed that cardiac V30 was an independent risk factor for the occurrence of cardiac AD[OR (95% CI)=1.583 (1.093-2.291), P=0.015]. Cardiac V30 could predict the occurrence of radiation-induced cardiac injury with an area under the curve of 0.788, and 17.1% was the optimal cut-off value of cardiac V30 for predicting the occurrence of cardiac AD. Conclusion: After thoracic radiotherapy, the cardiac irradiation dose-volume was significantly higher in patients with cardiac AD than in the control group. When cardiac V30 was higher than 17.1%, the risk of cardiac AD in patients significantly increased.
[Key words] Thoracic radiotherapy; Malignant tumor; Cardiac autonomic function; Heart rate variability; Heart injuries
2020年全球癌症统计数据[1]显示,全球新发癌症病例数约1 930万例,胸部恶性肿瘤约占1/4,其中约52.3%的患者需要接受放疗。放疗作为胸部肿瘤地标准治疗手段,在治疗肿瘤的同时会不可避免地损伤心脏表面的自主神经,导致心脏自主神经功能紊乱(autonomic dysfunction,AD),出现头晕、心悸及疲乏等症状,从而降低患者的生存质量[2];同时,心脏调节功能障碍,还会增加心律失常及猝死的风险[3]。目前,心率变异性(heart rate variability,HRV)分析是评价心脏自主神经功能的国际通用定量指标,但针对胸部放疗患者的HRV分析的临床研究尚少,心脏AD的剂量阈值尚不明确。本研究通过分析胸部肿瘤患者放疗前后的短程HRV,初步明确放疗对心脏自主神经功能的影响,探索胸部放疗的剂量学因素与心脏AD发生的关系。
1 资料和方法
1.1 一般资料
连续前瞻性收集2023年2月—2023年12月在华北理工大学附属医院放疗科接受胸部放疗并符合纳入和排除标准的恶性肿瘤患者。纳入标准:①经病理学检查证实为恶性肿瘤(肺癌、乳腺癌或食管癌)患者;② 有放疗适应证;③ 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分;④ 心电图、心脏彩超等检查无明显异常;⑤ 患者知情同意并签署同意书。排除标准:① 曾接受过胸部放疗;②治疗前自觉明显心悸、胸闷和胸痛的患者;③合并糖尿病、心脏病等严重基础疾病;④ 目前正在使用抗心律失常药物;⑤ 不能耐受放疗以及随访过程中失访或脱失者。收集所有入组患者的基本资料,包括年龄、性别、肿瘤类型、吸烟史、饮酒史和临床治疗情况。本研究经华北理工大学附属医院伦理委员会批准(伦理编号:20230228020),所有患者或家属均知情并自愿签署知情同意书。
1.2 放疗
采用美国Varian公司直线加速器(6 MV X线)对所有纳入患者进行放疗,肺癌、食管癌和乳腺癌患者在根治术后采用常规分割方式进行照射,单次剂量1.8~2.0 Gy,放疗总剂量50.0~60.0 Gy;乳腺癌保乳术后患者采用大分割方式照射,单次剂量2.65 Gy,放疗总剂量53.00 Gy。患者采用仰卧位,肺癌和食管癌患者使用热塑膜固定,乳腺癌患者使用乳腺托架固定,进行CT模拟定位后图像传至Varian Eclipse系统,勾画肿瘤靶区和危及器官,制订放疗计划并进行计划验证。
1.3 HRV分析
使用心电记录器(购自北京麦迪克斯科技有限公司,型号为MAEG-200型)对所有患者分别于第1次放疗前和最后1次放疗后进行5 min静息心电监测。患者测量前24 h内不饮酒、不喝浓茶和咖啡,测量前1 h内不能剧烈运动,测量时采取仰卧位,测量中保持平静呼吸。将采集到的窦性心搏的心室搏动间距(RR间期)时间序列信号,按时间顺序或心搏顺序排列成RR间期的数值,进行HRV分析。
1.4 观察指标
1.4.1 HRV分析参数
① 时域参数:全部窦性心搏间期的标准差(standard deviation of NN intervals,SDNN)代表自主神经总体变异性,连续心搏间期的均方根差(root mean square of successive RR interval differences,RMSSD)反映迷走神经系统活性;② 频域参数:总功率(total power,TP,0.0~0.4 Hz)代表自主神经总体神经张力,高频功率(high frequency power,HF,0.15~0.50 Hz)反映迷走神经功能状态,低频功率(low frequency,LF,0.04~0.15 Hz)反映交感神经和迷走神经的功能状态,并以前者为主,LF/HF反映交感神经和迷走神经之间的平衡;③ 非线性参数(庞加莱图):散点图短轴(SD1)反映瞬时心率变化大小和迷走神经张力,散点图长轴(SD2)反映心率在长时间内变化的大小和自主神经总体张力,SD2/SD1反映交感神经和迷走神经之间的相互作用。
1.4.2 剂量学参数
采用剂量体积直方图(dose and volume histogram,DVH)收集胸部放疗总剂量、单次放疗剂量、心脏最低受照剂量(心脏Dmin)、心脏最高受照剂量(心脏Dmax)、心脏平均受照剂量(心脏Dmean)以及心脏受到5、20、30和40 Gy以上剂量照射的体积占心脏总体积的百分比(心脏V5、V20、V30和V40)。
1.5 病例组和对照组的确定
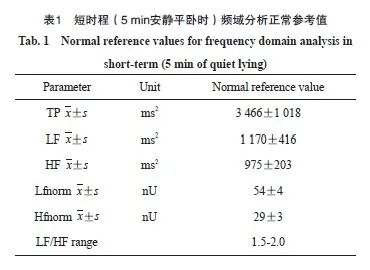
评价标准参照欧洲心血管病学会及北美心脏起搏和电生理学会提供的健康人的短程HRV参数(表1)[4],以及《内科学(第9版)》[5]对心血管神经症的诊断标准:① 心脏功能紊乱症状主要表现为心悸、气短、胸闷及胸痛;② AD症状为失眠、多梦、焦虑、食欲缺乏、头晕、耳鸣多汗、手足发冷、双手震颤、尿频、大便次数增多或便秘;③ 体格检查缺乏有重要病理学意义的阳性体征;④ 排除器质性心脏病。评估所有入组患者胸部放疗前的临床症状和HRV参数,将治疗前症状阴性、治疗后症状阳性或放疗后3项以上HRV参数[TP、LF或归一化LF(Lfnorm)、HF或归一化HF(Hfnorm)、LF/HF]出现异常的患者纳入病例组,其余入组患者作为对照组。
1.6 统计学处理
应用SPSS 26.0统计学软件对数据进行统计学分析。符合正态分布的计量资料以x±s表示,组间比较采用t检验;不符合正态分布计量资料,用M(Q1、Q3)表示,组间比较用Mann-Whitney检验。计数资料用百分数表示,计数资料组间比较用χ2检验。对心脏照射剂量体积参数(连续性变量:心脏Dmax、心脏Dmean和心脏V5、V20、V30、V40)进行单因素分析,将单因素分析中P<0.01的变量纳入logistic多因素分析以筛选危险因素(检验水准α=0.05),最后将独立危险因素行受试者工作特征(receiver operating characteristic,ROC)曲线分析。P<0.05为差异有统计学意义。
2 结 果
2.1 纳入患者的基本情况
共收集到符合纳入和排除标准的胸部放疗患者89例,其中男性40例,女性49例,平均年龄为(60.21±11.49)岁;其中肺癌患者32例,食管癌患者15例,乳腺癌患者42例。纳入的89例患者中,发生短程HRV分析指标异常的41例患者为病例组,其余的48例患者为对照组。患者纳入流程图见图1。
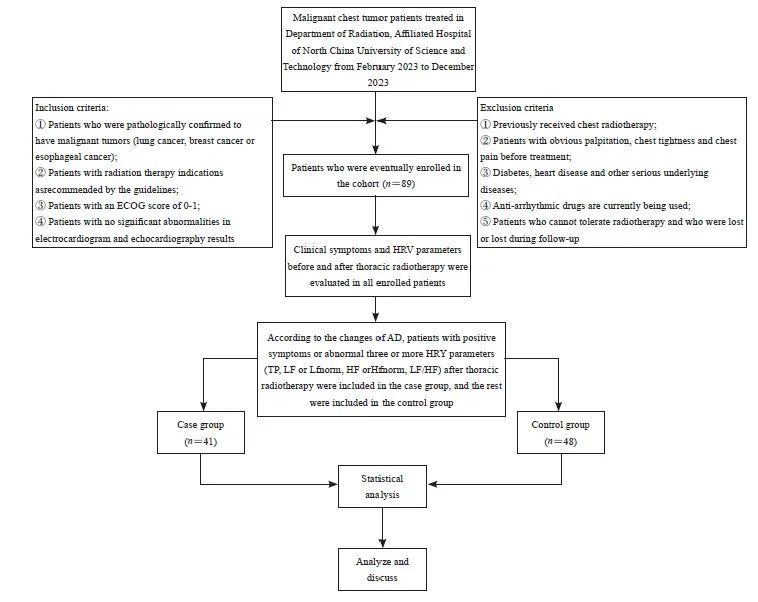
图1 患者纳入流程图
Fig. 1 Patient inclusion flowchart
2.2 两组患者基线资料的比较
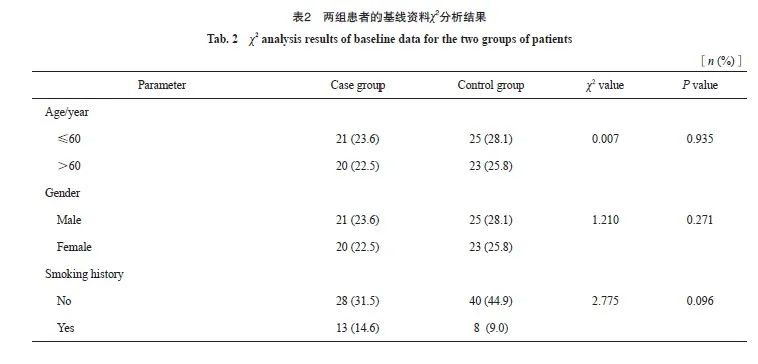
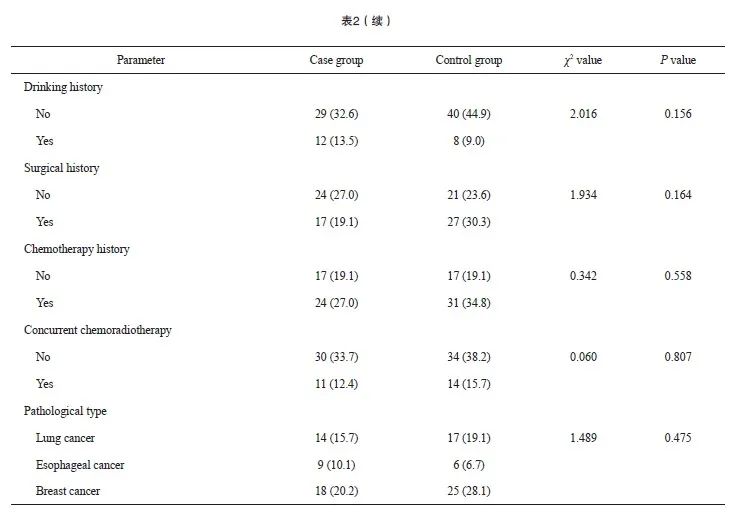
病例组和对照组患者的年龄、性别、吸烟史、饮酒史、手术史、化疗史、病理学类型及是否同步放化疗等基线资料的差异均无统计学意义(P>0.05,表2),具有可比性。
2.3 两组患者的HRV指标在放疗前后的比较
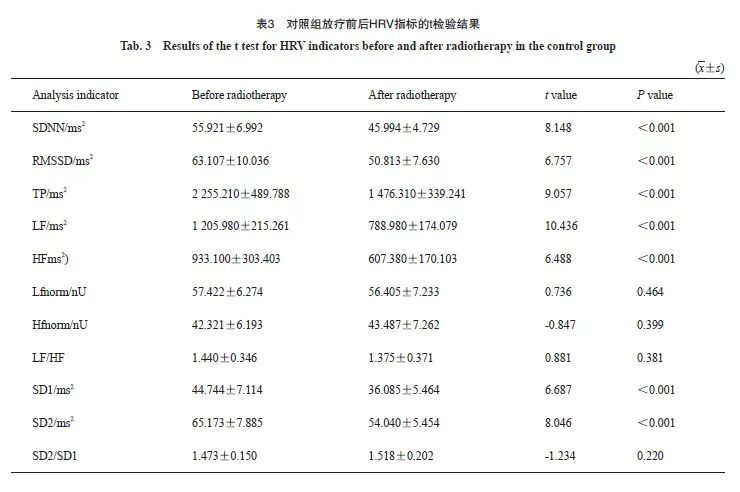
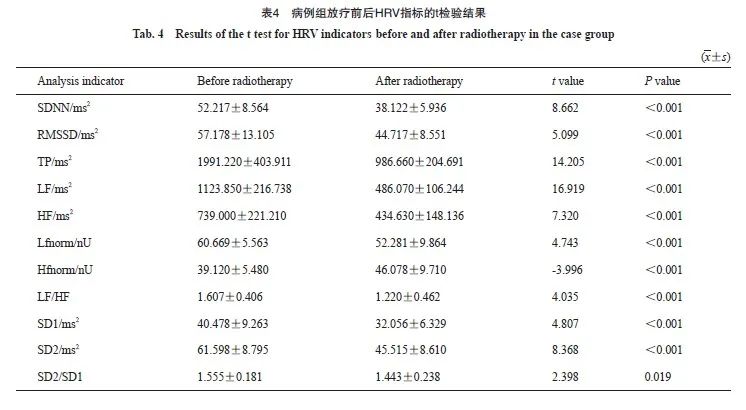
对照组患者在放疗后SDNN、RMSSD、TP、LF、HF、SD1、SD2均下降,差异有统计学意义(P<0.05,表3);病例组放疗后SDNN、RMSSD、TP、LF、HF、Lfnorm、Hfnorm、LF/HF、SD1、SD2、SD2/SD1均下降,差异有统计学意义(P<0.05,表4)。两组患者放疗后SDNN、RMSSD、TP、LF、HF、SD1、SD2均有变化,但病例组Lfnorm、Hfnorm、LF/HF、 SD2/SD1也发生了变化。
2.4 两组患者剂量学参数的比较
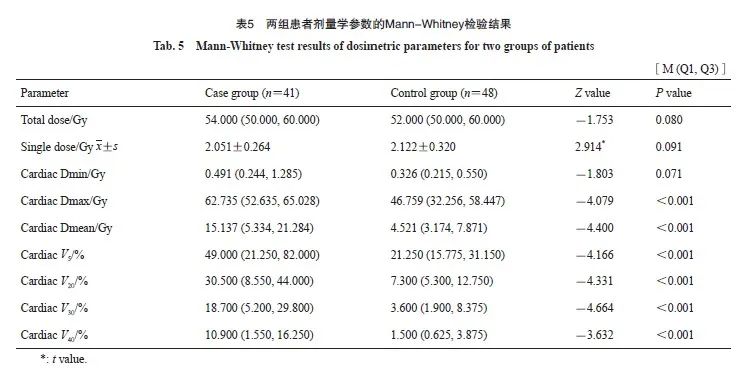
对两组患者的胸部放疗总剂量、心脏Dmin、心脏Dmax、心脏Dmean以及心脏V5、V20、V30、V40行Mann-Whitney检验,对单次放疗剂量行t检验,结果显示,两组的心脏Dmax、心脏Dmean和心脏V5、V20、V30、V40差异有统计学意义(P<0.05,表5)。
2.5 心脏AD的logistic回归多因素分析
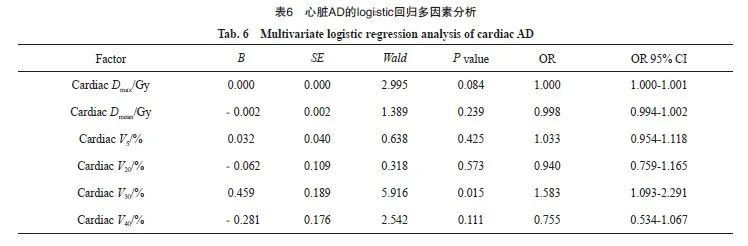
将以上单因素分析后P<0.01的因素(心脏Dmax、心脏Dmean和心脏V5、V20、V30、V40)通过SPSS 26.0软件行logistic回归多因素分析,结果显示,心脏V30是心脏AD的独立危险因素(表6)。
2.6 预测心脏AD的ROC曲线
ROC曲线的曲线下面积为0.788,心脏V30能预测放射性心脏损伤的发生,具有中等准确性(图2)。
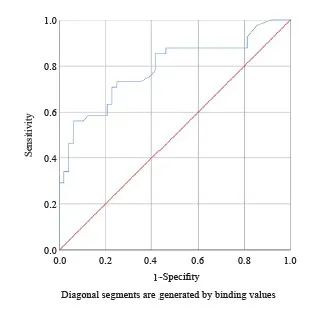
图2 心脏V30预测心脏AD的ROC曲线
Fig. 2 ROC curve of heart V30 for predicting cardiac AD
2.7 心脏V30预测心脏AD发生的最佳截断值
心脏V30的约登指数最大时的临界值为最佳截断值。当临界值为17.1%时,约登指数为0.498,较其他临界值大,其对应的灵敏度为0.561,特异度为0.938,因此17.1%为心脏V30预测心脏AD发生的最佳截断值。
3 讨 论
心脏AD可导致视力模糊、头晕、头痛、心悸、疲劳、晕厥和认知障碍等症状,降低患者的生存质量,而且与死亡风险增加相关[6-7]。Groarke等[8]研究发现,在调整年龄、性别和心血管危险因素后,先前的辐射暴露与静息心率增高及运动后心率恢复异常有关。同时Teng等[7]研究发现AD不仅是一种功能状态,而且是整体心肌病变的早期标志。但是目前没有针对心脏自主神经功能评估的血流动力学标准诊断策略,临床最常用的非侵入性量化评估方式是HRV,通过分析RR间期的差异和瞬时心率的微小变化,反映交感神经、迷走神经的张力以及两者之间的平衡状态[10]。本研究通过对比胸部放疗前后的HRV差异,发现AD与心脏受照剂量相关,当心脏V30大于17.1%时,发生AD的风险更高。
一项针对胸部放疗患者的小规模研究[11]发现,心脏辐射剂量与HRV参数变化呈负相关,心脏受到30 Gy以上照射剂量的体积越大,自主神经损伤越明显。Groarke等[12]研究也发现自主神经功能障碍的患病率随着放疗剂量和放疗时间的增加而增加。这与本研究结果一致,本研究中病例组患者的心脏Dmax、心脏Dmean和心脏V5、V20、V30、V40明显高于对照组。本研究发现当心脏V30大于17.1%时,即可能出现HRV分析参数的异常,包括时域参数SDNN、RMSSD的下降,频域参数TP、LF和HF的下降,非线性参数SD1、SD2的下降,提示心脏自主神经功能总张力、交感神经和迷走神经张力的降低,这与先前研究[13-14]的结果一致。但是关于胸部放疗后自主神经失衡情况的研究结果,与国内外其他学者的研究结果不一致,本研究发现病例组LF/HF在治疗后出现下降,提示自主神经平衡转向迷走神经优势;Wu等[14]研究发现胸部放疗前后LF/HF比值的变化差异无统计学意义;Hoca等[13]研究发现纵隔放疗后出现LF/HF比值的升高,提示自主神经平衡转向交感神经优势。这可能与LF/HF比值的临床意义一直存在争议有关,尽管传统的研究认为LF受到交感神经和迷走神经的共同影响,而且交感神经占主导地位[15-16];但是Thomas等[17]研究发现,LF并没有显示出对皮肤电活动(electrodermal activity,EDA,一种完全反映交感神经活性的标志物)的反应性,所以不能代表心脏交感神经调节能力,Billman[18-19]也不赞同LF/HF可以反映迷走神经和交感神经活动之间的平衡。因此,本研究结果目前只能说明当胸部放疗的心脏V30大于17.1%时可能会出现心脏自主神经功能总张力、交感神经和迷走神经张力的共同降低。
本研究仍存在一定局限性。首先,样本量较少,无法完全代表总体胸部放疗患者的自主神经功能变化情况;其次,本研究观察的是胸部放疗对自主神经功能的短期影响,长期影响需要随访进一步验证。
综上所述,胸部放疗与AD的发生相关,心脏Dmax、心脏Dmean和心脏V5、V20、V30、V40高,自主神经损伤越明显;当心脏受到30 Gy以上照射剂量占心脏总体积的百分比大于17.1%时,发生AD的风险更高。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
陈虹宇:提出研究方向,设计研究方案,实施研究过程,收集数据,分析数据,论文撰写和修订;
苏鹏宇:研究方案可行性分析,HRV参数的数据收集和分析;
罗文姿:研究数据收集和随访资料收集;
庞得全:论文框架审核,论文修改及指导;
王斐然:数据统计和分析,文献查阅和整理。
[参考文献]
[1]DELANEY G, JACOB S, FEATHERSTONE C, et al. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines[J]. Cancer, 2005, 104(6): 1129-1137.
[2]NESS K K, ARMSTRONG G T. Screening for cardiac autonomic dysfunction among Hodgkin lymphoma survivors treated with thoracic radiation[J]. J Am Coll Cardiol, 2015, 65(6): 584-585.
[3]SOUZA H C D, PHILBOIS S V, VEIGA A C, et al. Heart rate variability and cardiovascular fitness: What we know so far[J]. Vasc Health Risk Manag, 2021, 17: 701-711.
[4]Heart rate variability: standards of measurement, physiological interpretation and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology[J]. Circulation, 1996, 93(5): 1043-1065.
[5]葛均波. 内科学(第9版)[M]. 北京: 人民卫生出版社, 2018: 331-332.
GE J B. Internal Medicine (9th edition)[M]. Beijing: People’s Medical Publishing House, 2018: 331-332.
[6]KHANDELWAL E, TRIPATHI S, GUPTA A, et al. Profile of cardiovascular autonomic dysfunctions in breast cancer patients[J]. Cureus, 2023, 15(10): e46773.
[7]BEDI R, AHMAD A, HORBAL P, et al. Radiation-associated arrhythmias: putative pathophysiological mechanisms, prevalence, screening and management strategies[J]. Arrhythm Electrophysiol Rev, 2023, 12: e24.
[8]GROARKE J D, TANGUTURI V K, HAINER J, et al. Abnormal exercise response in long-term survivors of Hodgkin lymphoma treated with thoracic irradiation: evidence of cardiac autonomic dysfunction and impact on outcomes[J]. J Am Coll Cardiol, 2015, 65(6): 573-583.
[9]TENG A E, NOOR B, AJIJOLA O A, et al. Chemotherapy and radiation-associated cardiac autonomic dysfunction[J]. Curr Oncol Rep, 2021, 23(2): 14.
[10]郝丽荣, 张剑白, 解汝娟, 等. 心率变异性分析的检测指标及方法[J]. 中国地方病学杂志, 1994, 13(2): 96-98.
HAO L R, ZHANG J B, XIE R J, et al. Detection indicators and methods for heart rate variability analysis[J]. Chin J Endemiol, 1994, 13(2): 96-98.
[11]张凤琴, 梁保辉, 蔡汉飞, 等. 胸部放疗的辐射剂量与心率变异性的相关性[J]. 继续医学教育, 2021, 35(11): 121-123.
ZHANG F Q, LIANG B H, CAI H F, et al. Correlation between radiation dose and heart rate variability in chest radiotherapy[J]. Continuing Med Educ, 2021, 35(11): 121-123.
[12]GROARKE J D, MAHMOOD S S, PAYNE D, et al. Case-control study of heart rate abnormalities across the breast cancer survivorship continuum[J]. Cancer Med, 2019, 8(1): 447-454.
[13]HOCA A, YILDIZ M, OZYIGIT G. Evaluation of the effects of mediastinal radiation therapy on autonomic nervous system[J]. Med Oncol, 2012, 29(5): 3581-3586.
[14]WU S, GUAN W Z, ZHAO H, et al. Assessment of short-term effects of thoracic radiotherapy on the cardiovascular parasympathetic and sympathetic nervous systems[J]. Front Neurosci, 2023, 17: 1256067.
[15]HÉLISSEN O, KERMORGANT M, DÉJEAN S, et al. Autonomic nervous system adaptation and circadian rhythm disturbances of the cardiovascular system in a ground-based murine model of spaceflight[J]. Life, 2023, 13(3): 844.
[16]MONTANO N, PORTA A, COGLIATI C, et al. Heart rate variability explored in the frequency domain: a tool to investigate the link between heart and behavior[J]. Neurosci Biobehav Rev, 2009, 33(2): 71-80.
[17]THOMAS B L, CLAASSEN N, BECKER P, et al. Validity of commonly used heart rate variability markers of autonomic nervous system function[J]. Neuropsychobiology, 2019, 78(1): 14-26.
[18]BILLMAN G E. Heart rate variability-a historical perspective[J]. Front Physiol, 2011, 2: 86.
[19]BILLMAN G E. The LF/HF ratio does not accurately measure cardiac sympatho-vagal balance[J]. Front Physiol, 2013, 4: 26.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#胸部放疗# #心脏自主神经功能#
39 举报