IF:52.7!上海中医药大学,最新STTT:新型铁死亡诱导剂!
2025-07-09 BioMed科技 BioMed科技 发表于上海
本文通过体外和体内实验,系统地研究了ACE诱导结直肠癌细胞铁死亡的机制,并揭示了其通过双重靶向PCBP1/2和GPX4实现铁死亡诱导的分子机制。
铁死亡是一种依赖铁离子和脂质过氧化积累的调节性细胞死亡形式,与传统的细胞凋亡和坏死不同,其特征是细胞内铁离子水平升高和活性氧(ROS)水平升高。这种细胞死亡方式通过脂质过氧化作用来杀死细胞,而谷胱甘肽过氧化物酶4(GPX4)是其关键的防御酶。近年来,铁死亡诱导剂的研究取得了进展,但单一的GPX4抑制策略效果有限,因为细胞中存在多种抗氧化系统和代谢调控机制。因此,开发能够靶向多条通路的铁死亡诱导剂以提高治疗效果成为研究重点。
铁代谢在细胞中起着重要作用,多聚(C)结合蛋白(PCBP)家族中的PCBP1和PCBP2是铁分子伴侣蛋白,它们在铁的储存、利用和输出中发挥关键作用。PCBP1和PCBP2的高表达与多种肿瘤的迁移、侵袭和耐药性相关,尤其是在结直肠癌细胞中。结直肠癌(CRC)是全球常见的恶性肿瘤之一,占癌症相关死亡的约9.4%。尽管新型化疗药物、分子靶向药物和免疫疗法已被用于肿瘤治疗,但药物耐药性、复发和远处转移仍然是临床治疗结直肠癌的重大挑战。
上海市中药化学生物学前沿研究基地刘三宏、王群、海军军医大学张卫东和北京中医药大学林生等人筛选能够诱导结直肠癌细胞铁死亡的小分子药物,发现了一种名为acevaltrate(ACE)的天然产物,它能够通过靶向PCBP1/2和GPX4双重靶点,快速且强烈地诱导结直肠癌细胞的铁死亡。相关内容以“Acevaltrate as a novel ferroptosis inducer with dual targets of PCBP1/2 and GPX4 in colorectal cancer”为题发表在《Signal Transduction and Targeted Therapy volume》上。

【主要内容】
ACE的筛选与抗肿瘤活性评估
研究者从天然产物库中筛选了420种化合物,发现ACE对多种肿瘤细胞具有广谱的抗肿瘤活性,尤其是对结直肠癌细胞表现出显著的抑制效果,其半抑制浓度(IC50)在1.4-1.9 μM之间,而对正常肠道上皮细胞几乎无毒性。通过克隆形成实验和EdU实验,研究者发现ACE显著抑制了结直肠癌细胞的增殖能力。此外,流式细胞术结果显示ACE能够诱导细胞周期阻滞在G2/M期,并以浓度依赖的方式诱导细胞死亡。
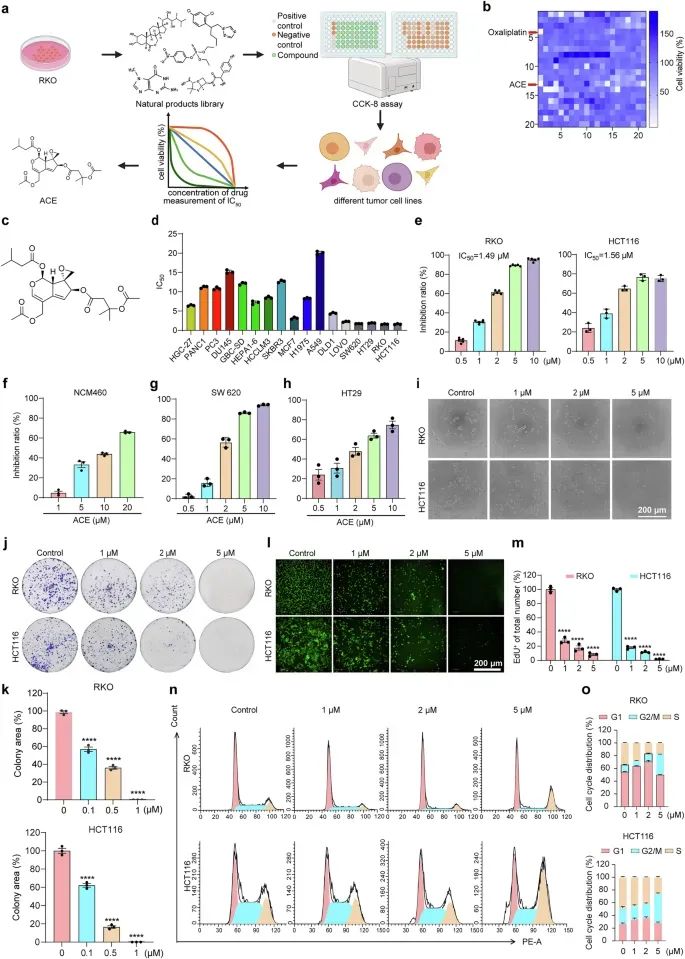
图1 ACE 抑制细胞迁移和耐药性
ACE诱导铁死亡的机制研究
通过多组学分析(蛋白质组学、转录组学和代谢组学),研究者发现ACE处理后,铁死亡相关基因显著富集,脂质过氧化标志物(如氧化的多不饱和脂肪酸)水平显著升高,表明ACE诱导了铁死亡。使用荧光探针(如BODIPY-C11和Liperflu)检测脂质过氧化水平,发现ACE比已知的铁死亡诱导剂(如RSL3和erastin)更强烈地促进脂质过氧化,并且这种效应可以通过铁螯合剂(如DFO)和脂质过氧化清除剂(如Lip-1)逆转。此外,ACE处理的细胞中丙二醛(MDA,脂质过氧化的产物)水平显著升高,表明脂质过氧化的积累。通过荧光探针(FerroOrange)和铁离子检测试剂盒,研究者发现ACE处理显著增加了细胞内铁离子(Fe2+)水平,并且这种增加是通过靶向PCBP1/2实现的。此外,ACE诱导的铁离子增加导致了活性氧(ROS)水平的显著升高,进而诱导细胞死亡。
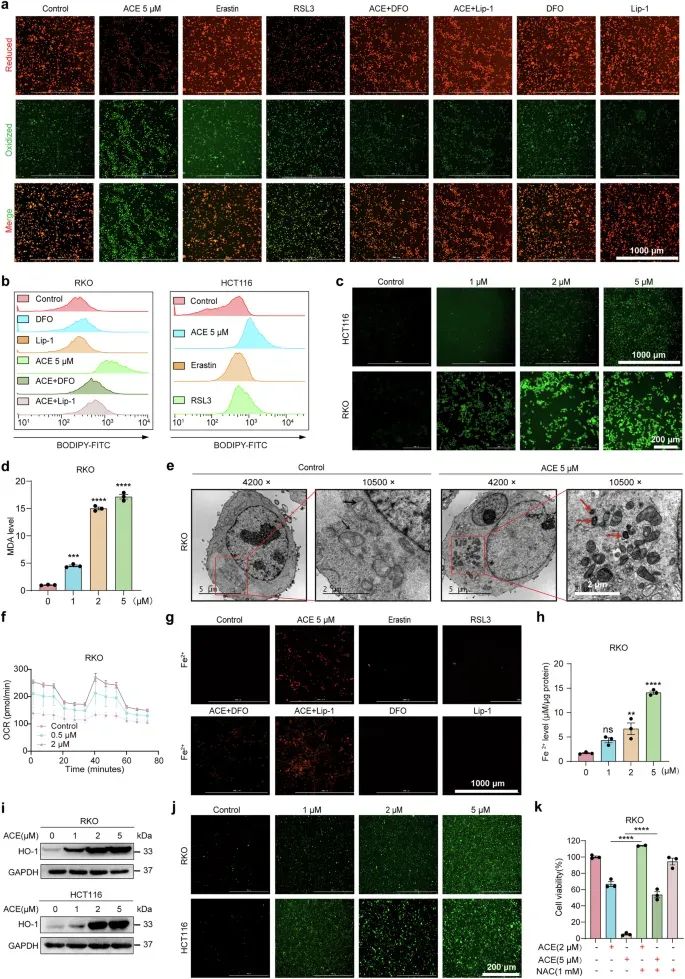
图2 ACE 通过灭活 GPX4 和积累 Fe2+ 来诱导铁死亡
ACE的双重靶点机制
研究者通过蛋白质组学和药物亲和力响应靶点稳定性(DARTS)技术,发现ACE能够直接结合并降解PCBP1/2,从而释放铁离子(Fe2+),进而促进脂质过氧化和铁死亡(。此外,通过分子对接模拟和微滴定热泳(MST)实验,研究者确认了ACE与PCBP1/2的直接结合,并发现Cys54是其可能的结合位点。
研究者发现ACE能够直接结合并抑制GPX4的酶活性,导致其通过泛素-蛋白酶体途径降解。通过分子对接模拟和MST实验,研究者确认了ACE与GPX4的直接结合,并发现硒代半胱氨酸(U46)是其可能的结合位点。
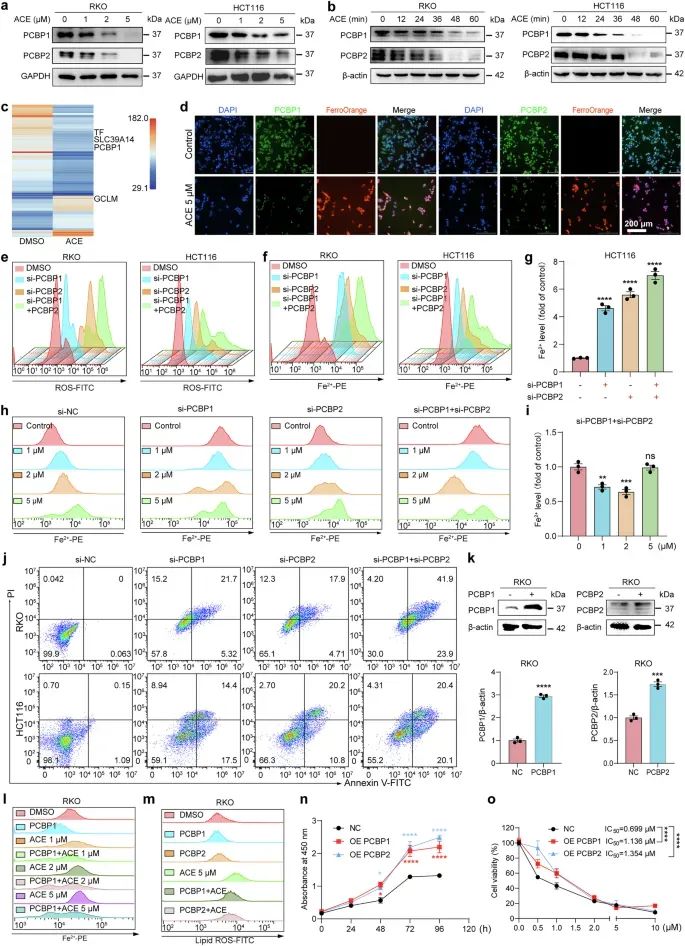
图3 PCBP1/2 介导 ACE 诱导的 Fe2+积累和铁死亡
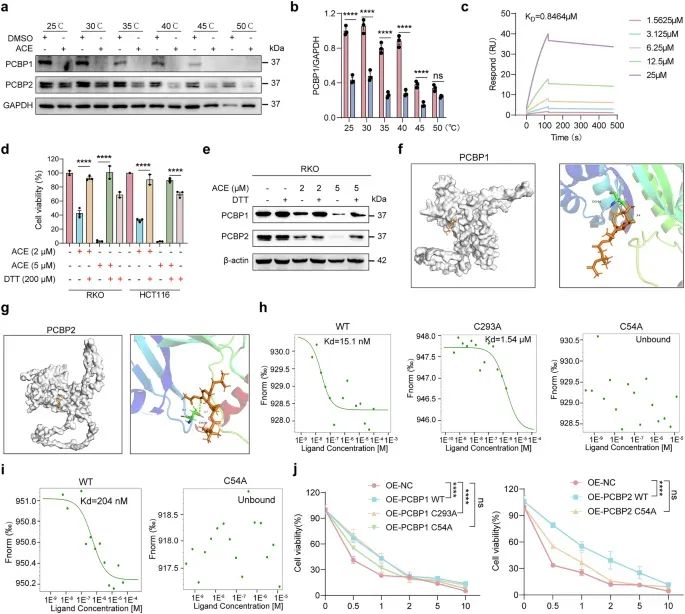
图4 ACE 直接与 PCBP1/2 结合
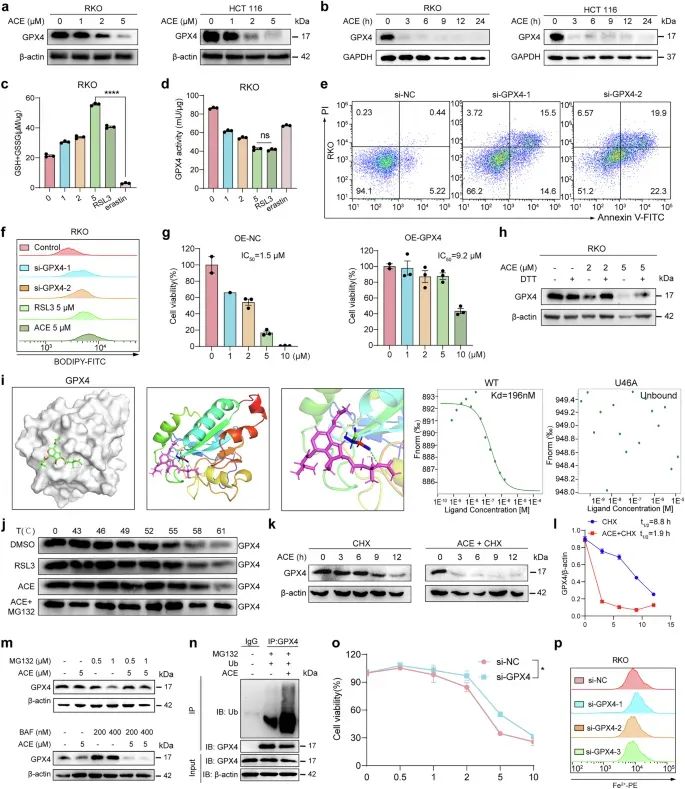
图5 ACE 诱导 GPX4 耗竭以治疗铁死亡
ACE的体内抗肿瘤效果
研究者通过在裸鼠中建立结直肠癌异种移植瘤模型,评估了ACE的体内抗肿瘤效果。结果显示,ACE以剂量依赖的方式显著抑制了肿瘤的生长,且未引起明显的体重下降或其他毒性反应。此外,肿瘤组织中的MDA和铁离子水平显著升高,表明ACE在体内诱导了铁死亡。研究者还比较了ACE与临床一线药物(如卡培他滨和TAS-102)以及已知的铁死亡诱导剂(如索拉非尼和青蒿素)的抗肿瘤效果。结果表明,ACE的抗肿瘤效果优于这些药物。
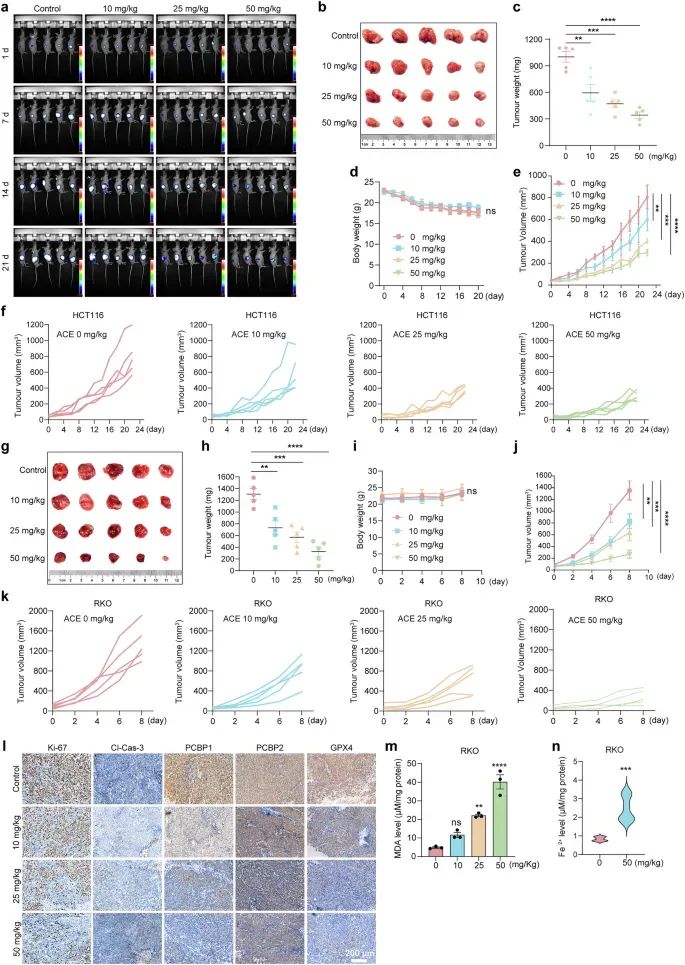
图6 ACE 在体内诱导铁死亡
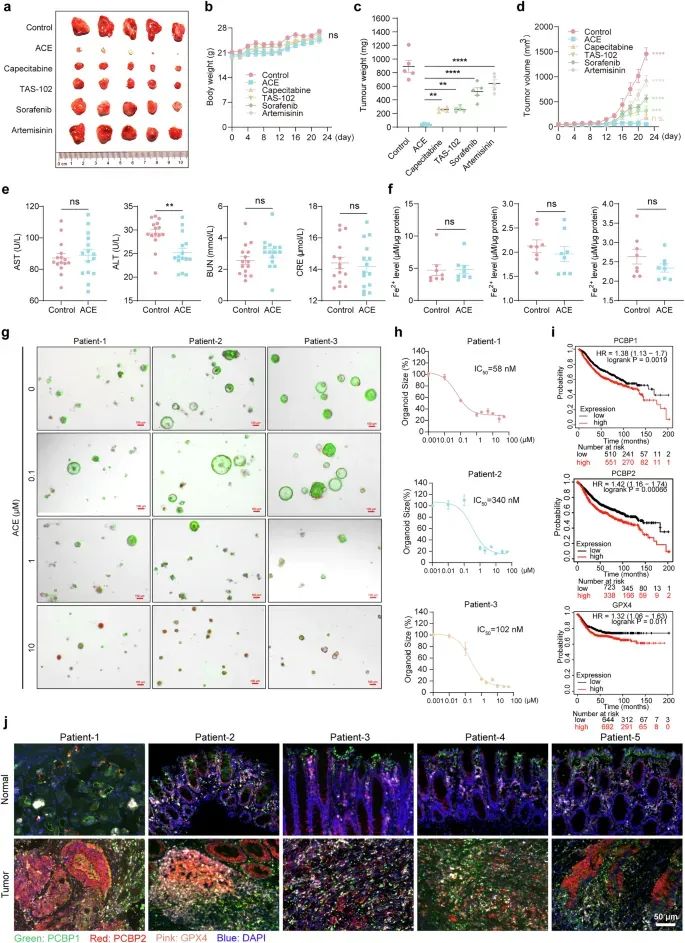
图7 靶向 PCBP1/2 作为肿瘤抑制的潜在策略
【全文总结】
本文通过体外和体内实验,系统地研究了ACE诱导结直肠癌细胞铁死亡的机制,并揭示了其通过双重靶向PCBP1/2和GPX4实现铁死亡诱导的分子机制。这些发现不仅为开发新型铁死亡诱导剂提供了理论依据,也为结直肠癌的临床治疗提供了新的策略和潜在的药物候选物。
原文链接:
https://doi.org/10.1038/s41392-025-02296-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#铁死亡#
11 举报