JIC | 最新综述:弥漫内生性脑桥胶质瘤DIPG的肿瘤免疫微环境
2025-07-05 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
该文全面根据最新研究全面概述DIPG的免疫状况,并提出了未来研究的潜在领域,以改善DIPG患者的治疗结果。
弥漫内生性脑桥胶质瘤(DIPG)是一种罕见但高度侵袭性的儿童癌症,主要影响5-7岁的儿童,是儿童癌症相关死亡的主要原因,其中位生存期不足12个月。作为弥漫性中线胶质瘤(DMG)的一个子集,DIPG位于桥脑,而桥脑是脑干中负责重要身体功能的关键结构,再加上DIPG的弥漫性和浸润性生长模式,使得手术切除不可行,姑息性放疗对生存的益处也微乎其微。当前,尽管在理解DIPG遗传学和生物学方面取得了重大进展,但对其肿瘤微环境(TME)知之甚少,而深入解析TME是开发有效免疫治疗策略的关键方面。
近日,来自比利时鲁汶大学的 An Coosemans 等人在 Journal for Immunotherapy of Cancer 上发表了题为 Exploring the tumor microenvironment in diffuse intrinsic pontine glioma: immunological insights and therapeutic challenges 的综述,该文全面根据最新研究全面概述DIPG的免疫状况,并提出了未来研究的潜在领域,以改善DIPG患者的治疗结果。

传统观点认为DIPG是一种典型的“冷肿瘤”:肿瘤内部免疫细胞浸润稀少、炎症信号微弱、整体呈现免疫抑制状态,因此难以用基于免疫系统的靶向疗法治疗。最新研究不仅证实了这种“冷”特性,更揭示了其内部惊人的异质性和复杂的免疫格局(图1)。基于全面的免疫特征分析,DIPG可被划分为三种主要免疫亚型:淋巴细胞耗竭型(占50%,免疫细胞极少)、免疫寂静型(占14%,免疫活动极低)和炎症型(占14%,相对活跃)。虽然大部分属于“冷”肿瘤,但炎症型的存在提示部分患儿可能对免疫治疗更敏感。
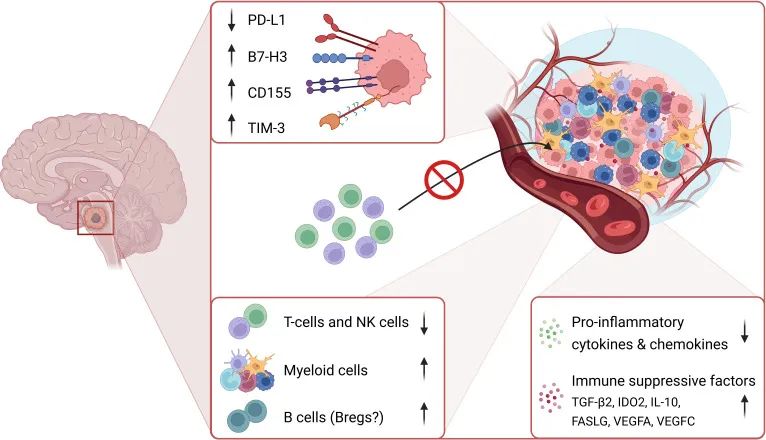
图1 DIPG肿瘤免疫微环境示意图
淋巴细胞:
T细胞在DIPG中浸润稀少,仅占CD45+白细胞的1.72–2.65%,远低于成人胶质母细胞瘤(GBM),且DIPG中CD8+ T细胞的存在与更差的生存率相关。即使T细胞存在,DIPG肿瘤细胞也能层层抑制T细胞的激活和功能,导致其“瘫痪”。
自然杀伤(NK)细胞在DIPG患者外周血和肿瘤内浸润稀少,且其存在与生存改善无关。然而,最新研究发现了在直接接触培养的DIPG细胞时,NK细胞的杀伤效果优于T细胞,且CAR-NK细胞在DIPG模型中展现出较好的抗肿瘤活性。这提示CAR-NK可能成为DIPG免疫治疗的新方向,但仍需克服其在体内难以有效浸润和激活的障碍。
B细胞在DIPG初始诊断和疾病进展期会升高,这可能是具有免疫抑制功能的调节性B细胞(Bregs)扩增所致,Bregs通过分泌TGF-β、IL-10等抑制因子,促进肿瘤逃逸,但确切的角色和机制仍需深入研究。
髓系细胞:
髓系细胞在DIPG中的比例较高,是肿瘤内最主要的免疫细胞群,能促进肿瘤生长、进展和免疫抑制。在DIPG中的小胶质细胞(脑内常驻巨噬细胞)活化,表现为突起变短、胞体增大,但肿瘤坏死因子(TNF)信号传导、免疫反应和补体途径显著下调,其功能表现为免疫抑制。
巨噬细胞传统上被分为M1和M2表型,但在DIPG中的巨噬细胞分为三类:促炎型、疾病相关型和增殖型,H3.3K27M突变型DIPG含有最低比例的促炎型巨噬细胞和最高比例的疾病相关型及增殖型巨噬细胞,共同营造了高度免疫抑制的环境。
髓系来源的抑制性细胞(MDSC)在多种癌症中通过抑制免疫反应、促进血管生成等机制驱动肿瘤进展。在胶质瘤中,其密度与肿瘤恶性程度呈正相关,与患者生存呈负相关。在H3.3K27M 突变型DIPG小鼠模型中,MDSC占比较高,MDSC可能是DIPG极具潜力的治疗靶点。
免疫检查点:不同于其他肿瘤,DIPG中经典免疫检查点分子PD-L1和CTLA-4表达并不升高,DIPG具有其独特的免疫检查点格局。B7-H3(CD276)被鉴定为DIPG细胞上高度表达的检查点分子,CD155参与调节免疫逃避和肿瘤生长,TIM-3在DIPG肿瘤细胞和TME内的髓系细胞上高表达。
细胞因子和趋化因子:DIPG的TME以低炎症因子和趋化因子环境为特征,这种“寂静”阻碍了免疫细胞的招募和激活。然而,TGF-β2却在DIPG中显著高表达,高水平TGF-β2是DIPG患者不良预后的独立预测因子,TGF-β2主要由肿瘤相关巨噬细胞分泌,并能显著抑制NK细胞功能。临床数据也提示,CAR-T细胞治疗后脑脊液中TGF-β1水平升高与疾病进展相关,表明TGF-β信号通路可能削弱免疫治疗效果。
癌症相关成纤维细胞 (CAF): CAF是多种实体瘤TME中最丰富的细胞成分之一,通过分泌因子、塑造物理屏障等方式促进免疫抑制和治疗抵抗。最新研究推翻了“脑瘤无CAF”的旧观念,在成人GBM中已发现CAF的存在及其促瘤作用。然而,在DIPG背景下,CAF的作用仍是一个充满潜力的研究空白。
三级淋巴结构 (TLS): TLS是在肿瘤等慢性炎症部位形成的异位淋巴组织,高TLS密度与多种癌症患者生存改善相关。在DIPG中,TLS尚未被研究,但最新研究发现,通过使用TLR激动剂和肿瘤抗原诱导TLS形成,在胶质瘤小鼠模型中已显示出增强抗肿瘤免疫、改善预后的效果,为DIPG治疗提供了极具吸引力的新思路。
最后,研究人员提出了未来DIPG的研究方向。当前,尽管在理解DIPG的遗传和分子景观方面取得了进展,但DIPG的非炎症性TME对免疫治疗提出了重大挑战,未来的研究关键在于深入理解儿童发育中大脑独特的免疫环境,以及DIPG如何利用并重塑这种环境。精确解析髓系细胞各亚群的功能、阐明独特免疫检查点的作用机制、探索CAF和TLS在DIPG中的可能性等对于推动DIPG的治疗至关重要。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#肿瘤免疫微环境# #弥漫内生性脑桥胶质瘤#
15 举报